
今天馆长分享的这篇文章确实是难得一见的纯生信思路,走过路过的朋友千万不要错过哦!
这篇文章来自复旦大学附属中山医院团队,首先文章关注肝细胞癌的DNA损伤修复,在
选题上就比较新颖
;
方法上
,采用包括scRNA-seq、bulk RNA-seq和靶向蛋白组学(RPPA)等在的
多组学技术
,全面分析了免疫治疗诱导不同DNA损伤修复(DDR)状态下HCC肿瘤微环境(TME)的分子异质性。使用
101种机器学习算法组合
建立了DDR评分框架(DDRscore),并确定了专门针对HCC高DDR状态的潜在治疗靶点(BRAF)。
这篇文章全程不需要测序,仅靠公共数据集和软文分析完成,可复现性比较高,感兴趣的朋友可以直接联系馆长复现哦!
定制生信分析
生信服务器
加好友
备注“99”
领取试用

题目:通过深度转录组分析解读免疫调节和
肝细胞癌DNA损伤修复
模式的治疗意义
研究背景
DNA损伤修复(DDR)
与肿瘤发生、进展以及治疗反应相关,其在肝细胞癌(H
CC)中具有重要作用
。然而,在HCC中DDR介导的免疫细胞和免疫调节通路机制尚不明确。
研究思路
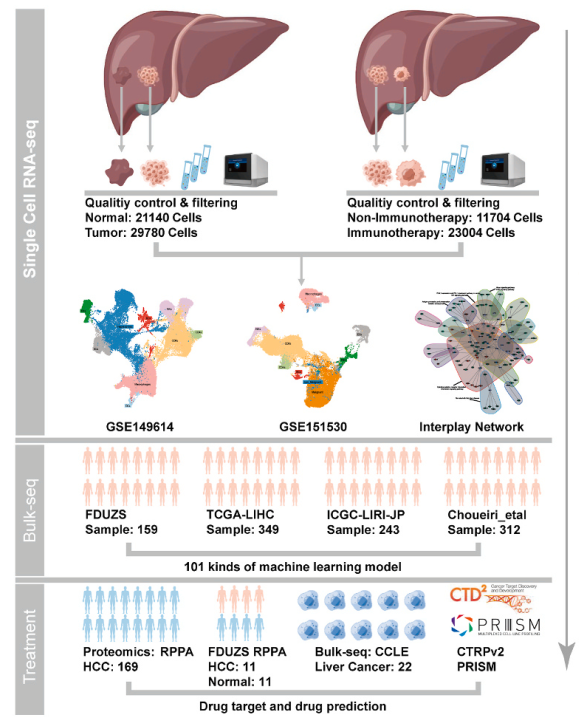
获得单细胞RNA测序数据,并对原发性或免疫治疗后病例的85,628个细胞进行分析。大规模HCC数据集,包括1027名内部患者和公共数据集,用于101个机器学习模型构建,并在单细胞分辨率下导出了新的DDR特征(DDRscore)。利用169例HCC患者的逆相蛋白阵列(RPPA)蛋白质组学分析和22种肝癌细胞系的RNA-seq数据预测了可靶向的药物靶点。(
ps:单细胞和机器学习数据处理量较大,建议大家通过服务器完成,有需要的朋友可以联系馆长试用!)
研究结果
肝癌恶性细胞的DDR异质性分析
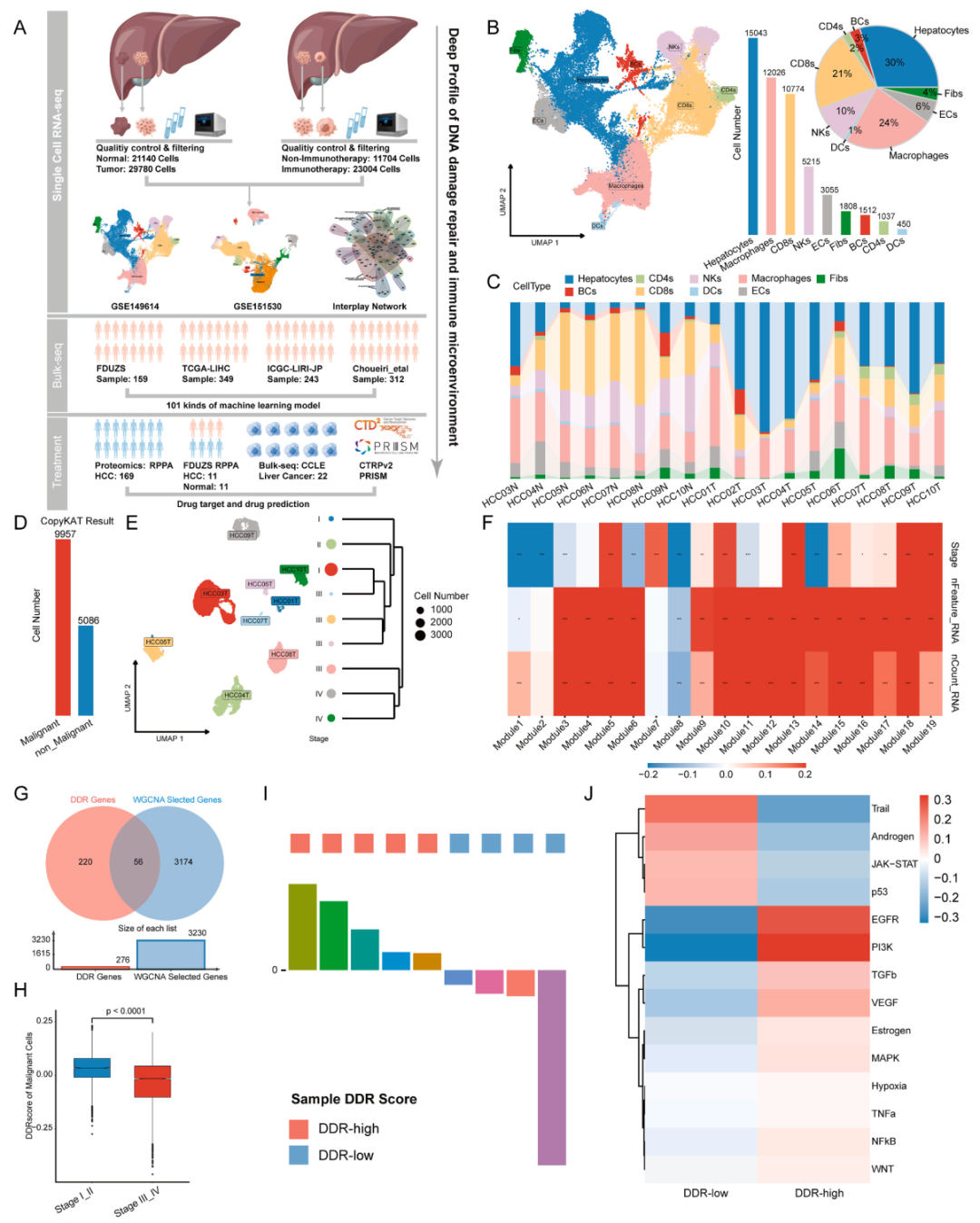
基于单细胞数据集GSE149614进行单细胞分析。使用标记基因对每个细胞簇进行了注释和划分。上皮细胞和免疫细胞在正常组织和癌组织之间表现出明显的组织起源差异。肿瘤旁细胞中免疫细胞占主导地位,而HCC组织中恶性上皮明显扩大,可能是由于肿瘤样本中恶性细胞的生长。
在获得HCC TME的基本特征后,应用CopyKAT算法通过专门关注肝癌细胞来评估大规模染色体拷贝数改变。观察到肿瘤间异质性。此外,鉴定出的恶性细胞群的频率在不同的样本之间有所不同。
从所有鉴定的模块中选择与TNM分期显著相关的基因作为肿瘤进展的关键指标。其中,已知有56个基因参与DDR过程。根据临床分期推断DDR状态,使用这56个共享基因开发了参数化评分系统(DDRscore),允许基于恶性细胞定量评估DDR状态。这些结果表明恶性肿瘤细胞具有明显的肿瘤间异质性,可能促进肿瘤进展。
不同DDR条件下HCC中TME生态系统的不同概况
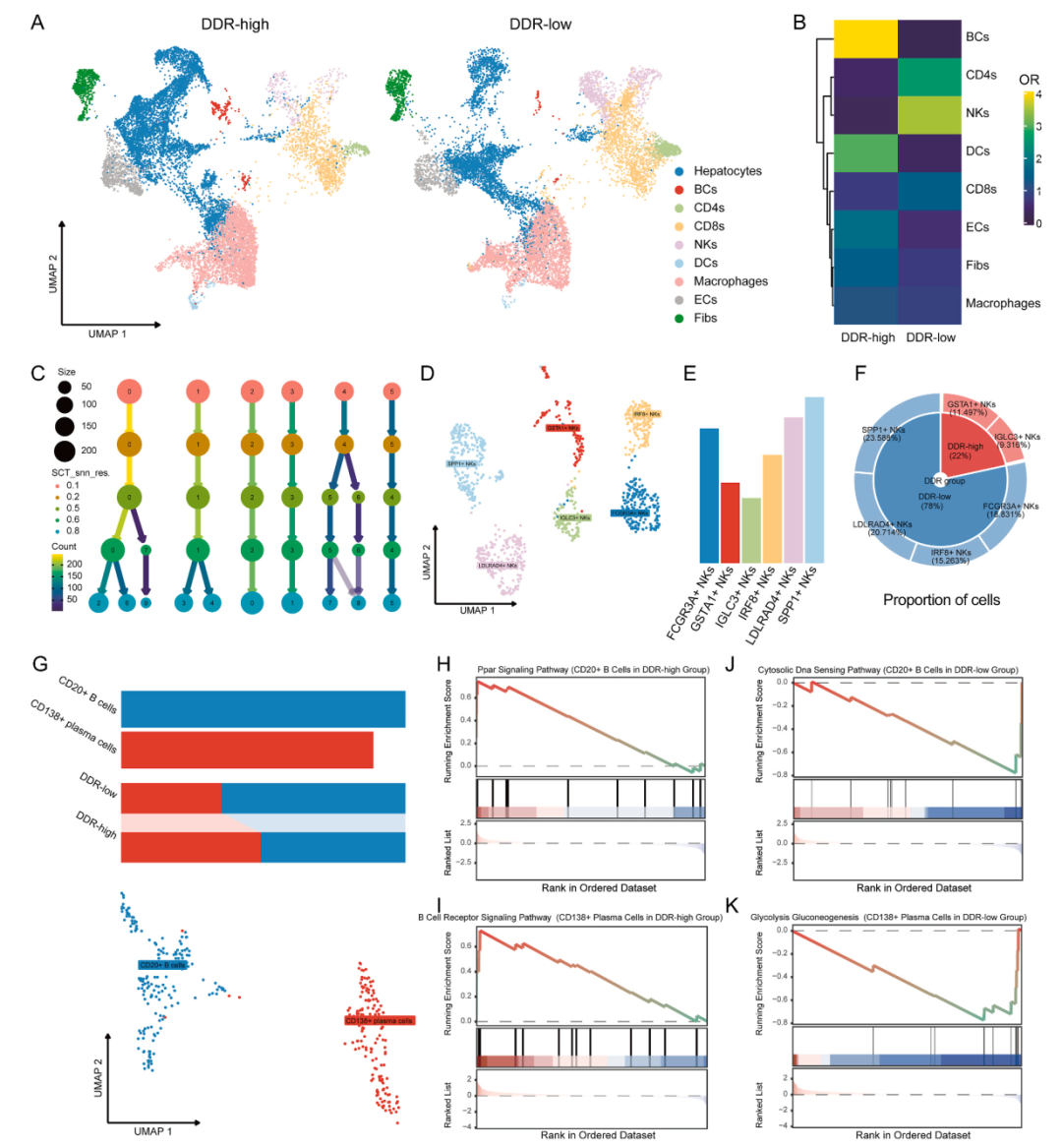
在阐明DDR驱动的致瘤性改变后,继续从TME角度探索HCC样本之间的差异。在单细胞分辨率下生成 DDR-high和DDR-low TME。虽然NK细胞与“DDR-low”组的相关性最强,但B细胞似乎在“DDR-high”组中富集最多。研究结果支持NK和B细胞通过重新编程免疫生态系统和代谢过程,从有效的DNA修复状态 (DDR-高)到功能受损状态(DDR -低)的肝癌致癌转换。
免疫检查点阻断后高DDR介导免疫抑制的特点
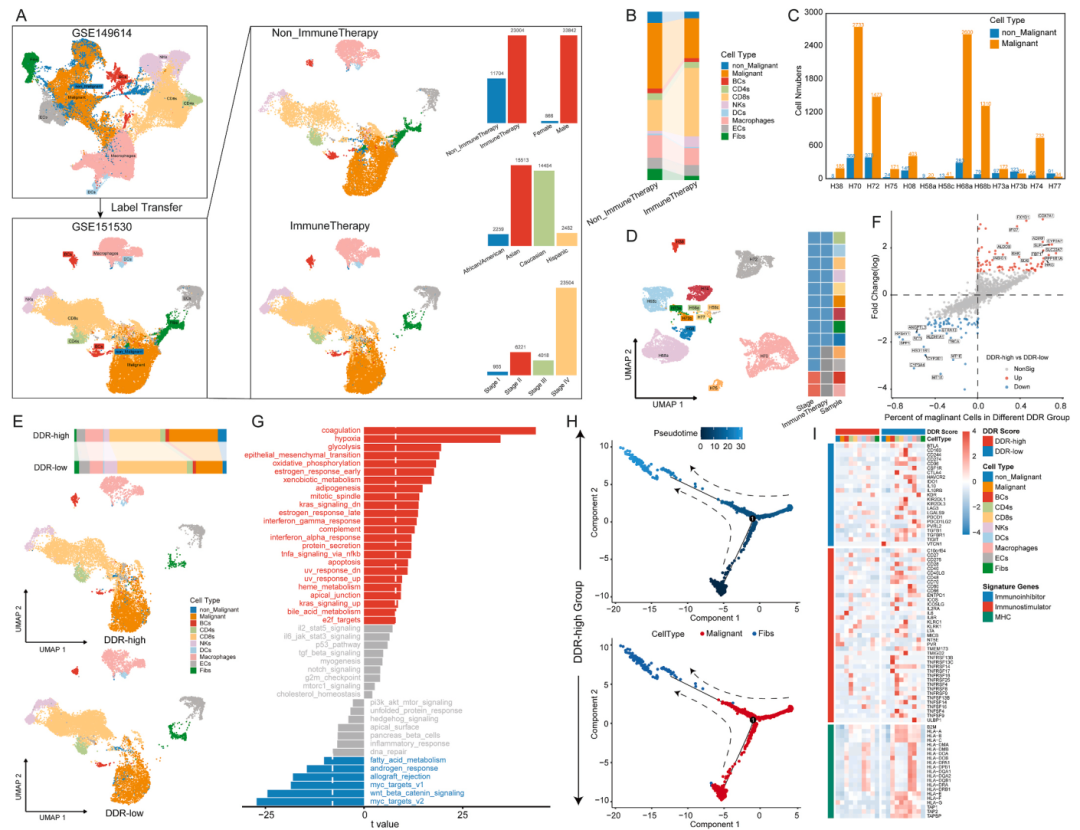
为了揭示导致免疫治疗诱导的生物学差异的关键细胞成分,首先使用“TransferData”算法通过参考从上述sing cell数据(GSE149614)推断的细胞类型来注释细胞类型。可以识别上皮细胞,主要免疫和基质细胞。与非免疫治疗组相比,免疫治疗组的恶性细胞较少,CD8+ T细胞较多。与未经免疫治疗的HCC相似,H08、H68、和H74均表现出相当大的肿瘤间异质性。
接下来,通过使用从上面开发的DDRscore算法来探索这些ICI治疗样本中的DDR状态。在患者水平上,不同的DDR状态形成了不同的TME,并改变了一些免疫表型组成。这些现象提示以DDRscore为表征的DDR状态在鉴别HCC患者接受ICI免疫治疗的TME中具有一定的调节作用。
CXCL10-CXCR3轴诱导DC在低DDR状态下交叉呈递抗原并识别CD8+ T细胞
接下来使用多种生物信息学工具(CellPhoneDB, NicheNet和scMLnet)来鉴定ICI治疗患者在不同DDR状态下特定细胞类型内配体-受体对之间的分子相互作用。结果表明,HLA-DRA和GSTP1在“低DDR”状态下在DC中高表达,而在“高DDR”状态下则下调。另一个高调控群体巨噬细胞在“DDR-low”组中GRN上调,HLA-DRA在“DDR-low”组中表达显著升高。
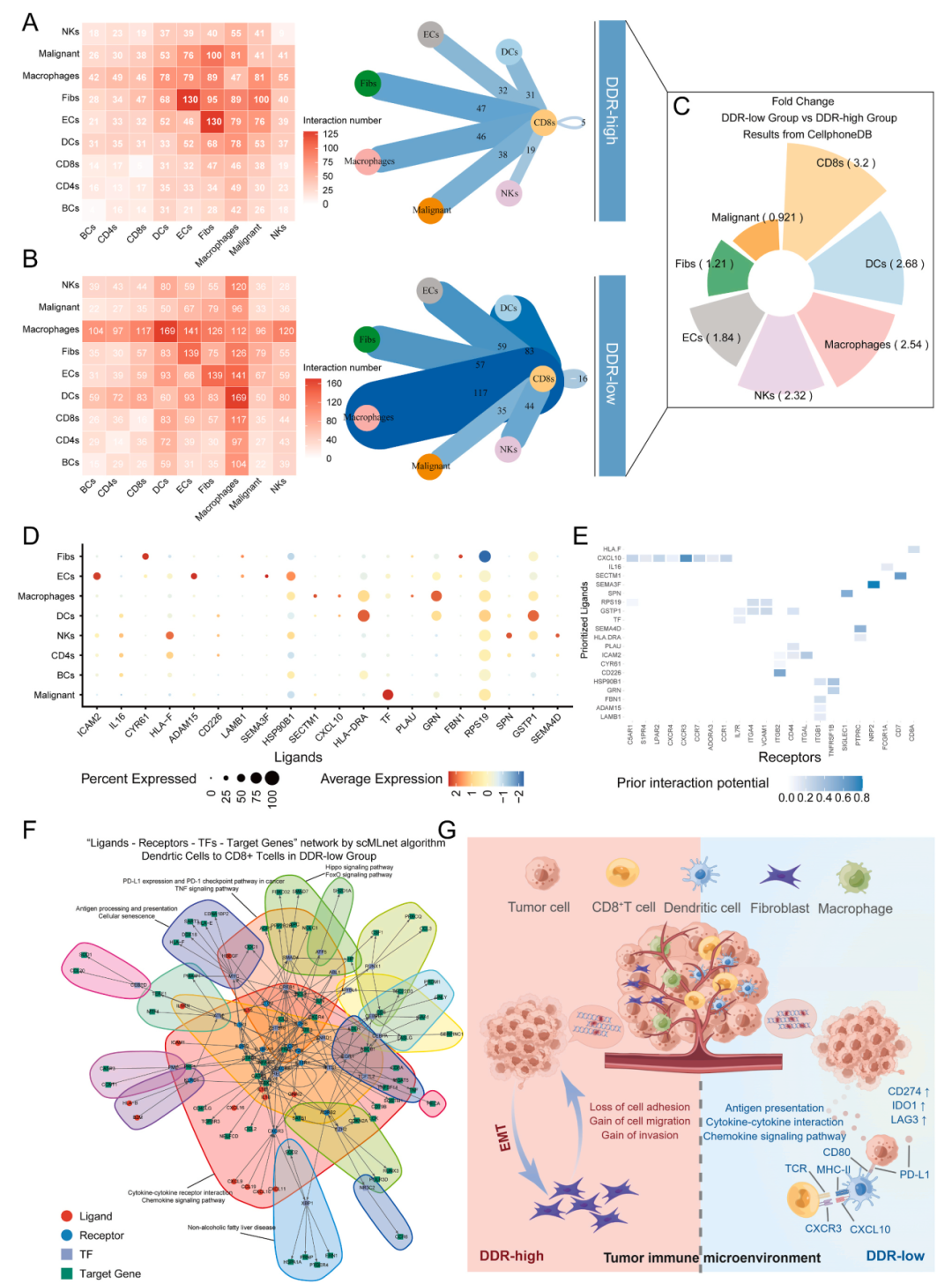
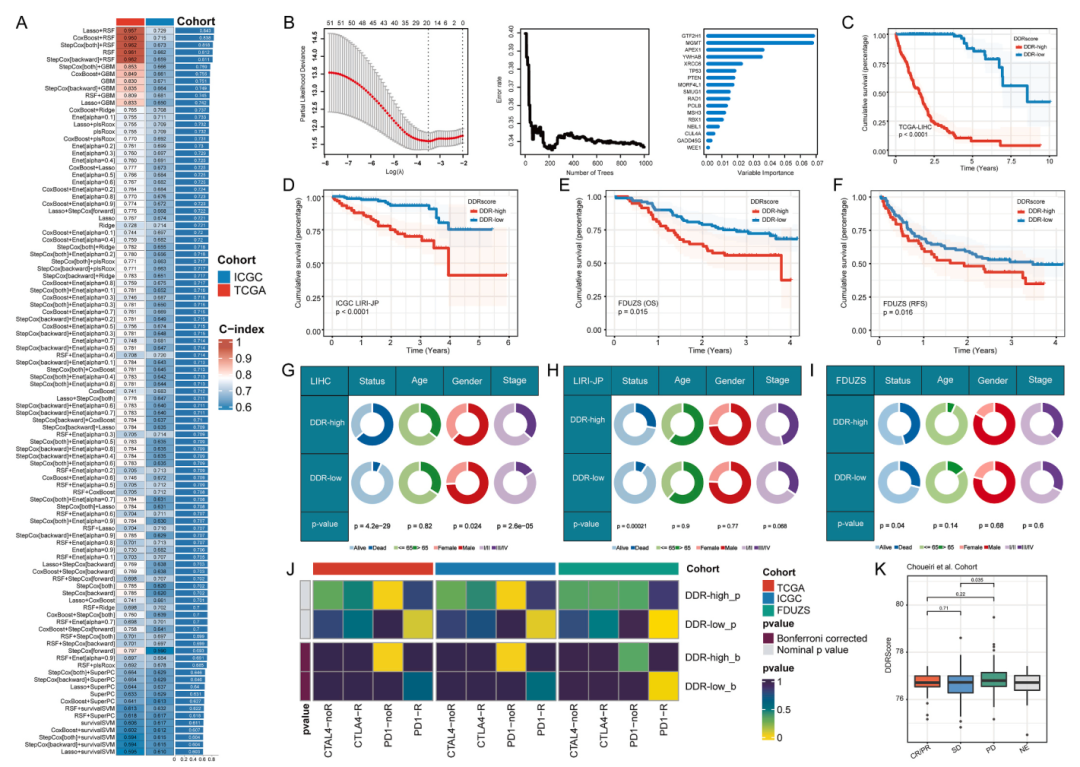
DDR共识特征预测HCC预后和免疫治疗反应性
为了进一步利用上述转录特征,提取了通过单细胞RNA-seq鉴定的56个必需的DDR基因,并开发了一种基于机器学习的集成技术,使用外部bulk RNA-seq数据集生成DDR分数。利用LOOCV框架拟合了101种组合机器学习方法,并使用TCGA-LIHC队列作为训练数据集,并使用ICGC-LIRI-JP队列进行验证。采用非零Lasso系数的RSF分析最终确定了17个重要的DDR基因。随后将患者分为“DDR-高”组和“DDR-低”组。发现在TCGA-LIHC和ICGC-LIRI-JP数据集中,“DDR高”患者的总生存期(OS)明显低于“DDR低”患者。
使用TIDE算法来估计DDR评分与免疫治疗反应之间的可能关系。结果表明DDRscore可能与免疫治疗疗效有关。
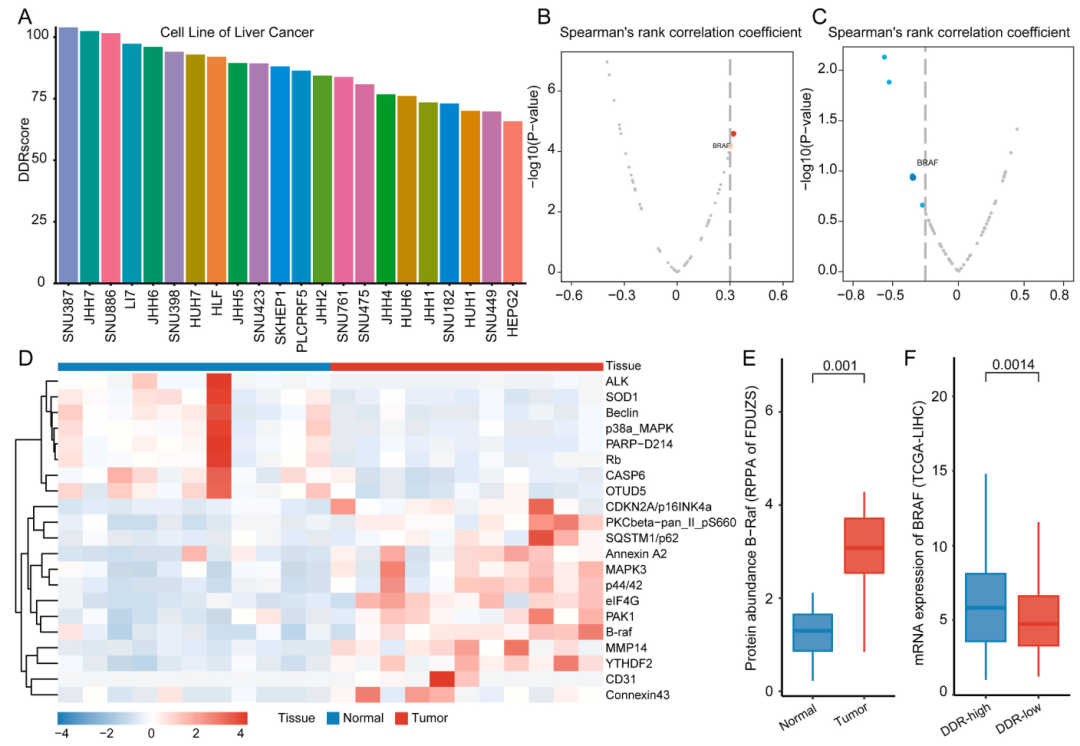
通过B-Raf通路抑制靶向DDR评分高的HCC患者
为了确定与DDR状态相关的潜在治疗靶点,特别是那些具有高DDR评分且可能临床结局差的患者,首先计算了22个HCC细胞系的DDR评分。然后,从TCGA-LIHC队列中检索了反向相蛋白阵列(RPPA)数据,并将个体患者的DDRscore与配对的RPPA蛋白质组学数据相关联。发现B-Raf表达与DDRscore呈正相关。接下来,应用CERES评分来评估个体基因依赖性与基于的22种肝癌细胞系的DDR评分之间的相关性,并再次筛选BRAF基因作为高DDR评分的重要预测因子。发现DDR-high组BRAF显著上调。总之,结合外部TCGA数据和内部RPPA分析,通过靶向DDR高患者的BRaf通路,解开了潜在的治疗脆弱性,这可能对患者分层具有重要的临床意义。
文章小结
总之,这篇文章通过单细胞
结合多组学以及机器学习
,揭示了DDR与肿瘤微环境之间的相互作用,并开发了具有临床价值的DDRscore评分系统,无论是选题还是分析方法全在线,
不愧是能发9分+的好思路!
最关键的是全程基于的是公共数据集,可复现性强,想要复现本文思路的朋友可以滴滴馆长,从方案设计到生信分析馆长可以帮你一站式搞定!
馆长会持续为大家带来最新生信思路,也可以提供特色数据库构建、免费思路评估、付费生信分析等服务,对数据库构建和生信分析感兴趣的朋友可以咨询馆长哦!



















