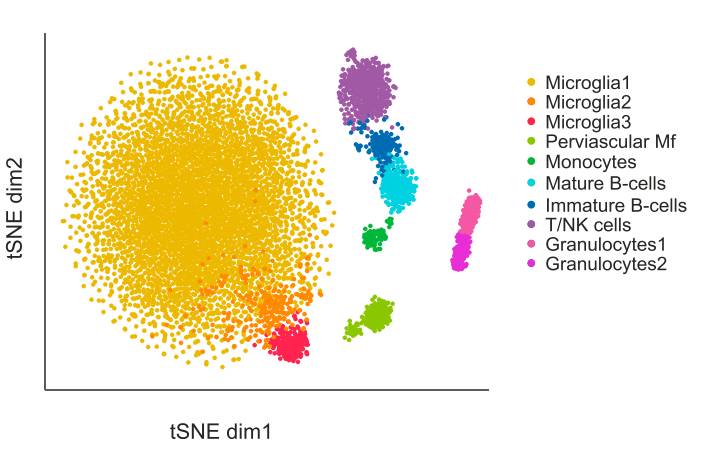
从AD小鼠中提取的免疫细胞分类,黄色是普通小胶质细胞,橙色是group2,红色是具有吞噬作用的DAM
那么与普通小胶质细胞相比,DAM有那些特殊的地方呢? 首先,普通小胶质细胞处于免疫抑制状态,而DAM中与
免疫抑制相关的基因都下调了
,同时,group3细胞中与
吞噬以及脂质代谢相关的基因也被激活,具有很强的吞噬能力,但group2没有
。意味着group2可能是group3的过渡态。也就是说,完全激活的DAM具有吞噬功能,而普通小胶质细胞没有。
其次,之前的研究发现,小胶质细胞被激活后有时也会吞噬正常的神经(4),那么完全激活的DAM会不会呢?通过组织免疫染色以及单细胞荧光标记,研究人员发现,
DAM只存在于β淀粉样蛋白周围,吞噬β淀粉样蛋白块,不会引发炎症,更不会损伤正常神经
。
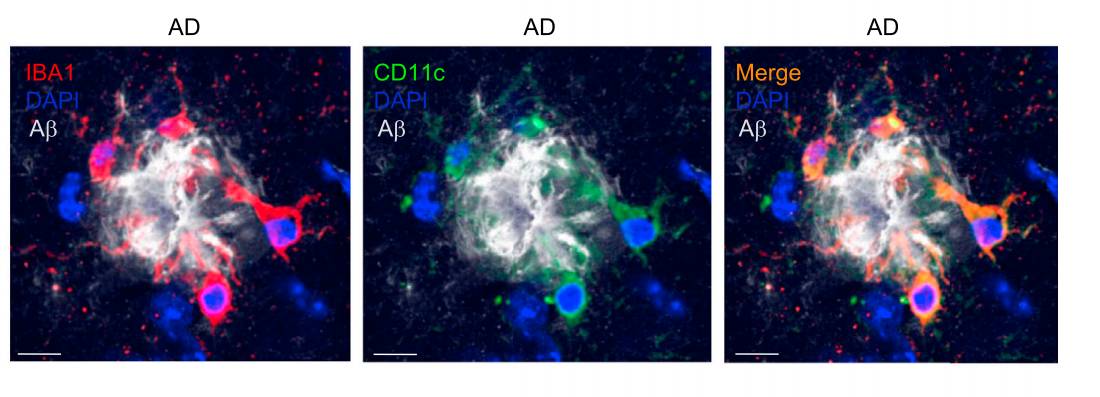
红色的IBA1是小胶质细胞表面标志物,绿色的CD11c主要是DAM表面的标志物,混合染色后,黄色的DAM集中在β淀粉样蛋白(灰色)附近
最后一般来说,大佬都是用来压轴的,DAM也是如此。由于AD的进展会逐渐加速(6),所以研究人员分时间提取AD小鼠和正常小鼠大脑免疫细胞进行分析,以确定不同时间,AD小鼠大脑内免疫细胞的区别,结果发现,
DAM在AD进展后期才出现,并且DAM只占小胶质细胞的2.8%
。也就是说,
如果DAM能早点出现并且数量再多点,也许可以延缓AD进展。
随后,研究人员还发现了这种特殊的小胶质细胞的激活机制。通过分析小胶质细胞内的基因表达,研究人员发现了两种与小胶质细胞激活相关的蛋白质,Tyrobp以及其受体Trem2。同时,结合之前的研究(7)
,
研究人员还发现
,当敲除小鼠
Trem2基因后,会导致DAM无法形成,AD小鼠疾病进展会显著加速
。也就是说,
DAM存在可以显著限制AD进展
。
随后,通过进一步研究,研究人员发现,
小胶质细胞的激活必须分为两步
。第一步,是在AD,年龄等因素刺激下,小胶质细胞转化为中间状态的细胞,即group2。
可惜的是,这一步的具体机制仍然未知
。第二步,通过Trem2蛋白和Tyrobp蛋白结合,激活group2细胞中与吞噬以及脂质代谢相关基因,转化为完全激活的DAM,即group3。
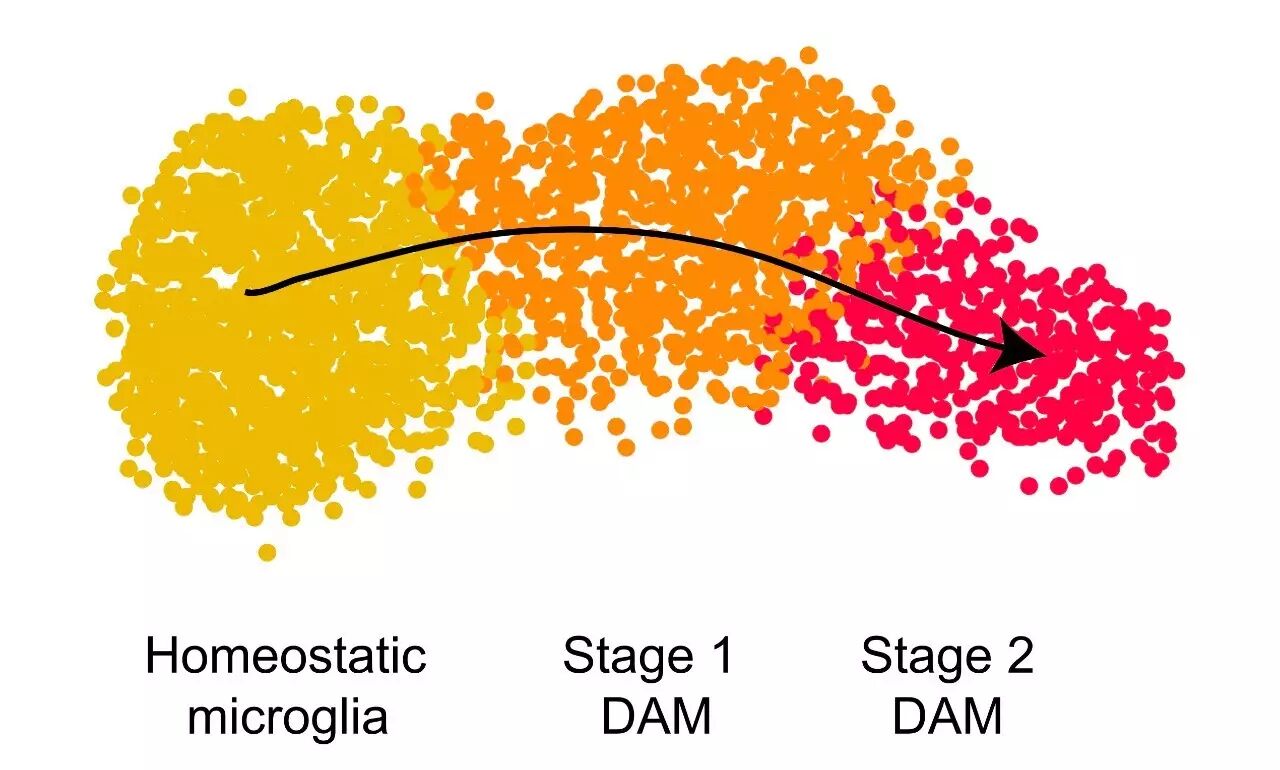
小胶质细胞的转化
既然DAM可以显著限制AD进展,研究人员便想,这种神奇的小胶质细胞是否也存在于AD患者大脑内呢?通过对AD死者以及非AD相同年纪死者大脑内的免疫细胞进行分析,研究人员发现,
DAM同样存在于AD患者脑内
,而非AD患者,脑部同样不存在DAM。
由于目前尚无有效治疗AD的药物,DAM的发现显然是很振奋人心的。
如果能在AD进展早期激活小胶质细胞转化为DAM,就算不能治愈AD患者,至少也能控制病情。改善患者的生活质量,延长其生存期。
参考资料:
1.Movement AsI. 2015. Researching Alzheimer's Medicines: Setbacks and Stepping Stones Summer 2015. PhMRA
2.Keren-Shaul, H., Spinrad, A., Weiner, A., Matcovitch-Natan, O., Dvir-Szternfeld, R., Ulland, T. K., ... & Itzkovitz, S. (2017). A Unique Microglia Type Associated with Restricting Development of Alzheimer’s Disease. Cell.
3.
Griffin W S, Stanley L C, Ling C, et al. Brain interleukin 1 and S-100 immunoreactivity are elevated in Down syndrome and Alzheimer disease[J]. Proceedings of the National Academy of Sciences, 1989, 86(19): 7611-7615.
4.Hong S, Beja-Glasser V F, Nfonoyim B M, et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models[J]. Science, 2016, 352(6286): 712-716.
5.
Bruch
aK, Deczkowska A, Rosenzweig N, et al. PD-1 immune checkpoint blockade reduces pathology and improves memory in mouse models of Alzheimer's disease[J]. Nature medicine, 2016, 22(2): 135-137.
6.
Ballard, C., Gauthier, S., Corbett, A., Brayne, C., Aarsland, D., and Jones, E.
(2011).Alzheimer’s disease. Lancet 377, 1019–1031.
7.Yuan, P., Condello, C., Keene, C.D., Wang, Y., Bird, T.D., Paul, S.M., Luo, W., Colonna, M., Baddeley, D., and Grutzendler, J. (2016).
TREM2 haplodeficiency in mice and humans impairs the microglia barrier function leading to decreased amyloid compaction and severe axonal dystrophy. Neuron 90, 724–739.






