 关注小药说药,一起成长!
关注小药说药,一起成长!
嵌合抗原受体(
CAR
)是一种受体蛋白,它赋予免疫细胞新的能力,以靶向特定的抗原蛋白。
CAR-T细胞治疗在血液恶性肿瘤取得了巨大的成就。
2017年,美国食品药物监督管理局(
FDA
)首次批准了两种CAR-T疗法,即tisagenlecleucel(
Kymriah®
)和Axicabatagene ciloleucel(
Yescarta®
),分别用于治疗急性淋巴细胞白血病和弥漫性大B细胞淋巴瘤。到目前为止,已有5种CAR-T疗法得到了批准。CAR-T细胞疗法作为癌症治疗方面革命性的生物技术产品,展现出未来征服癌症的卓越潜力。
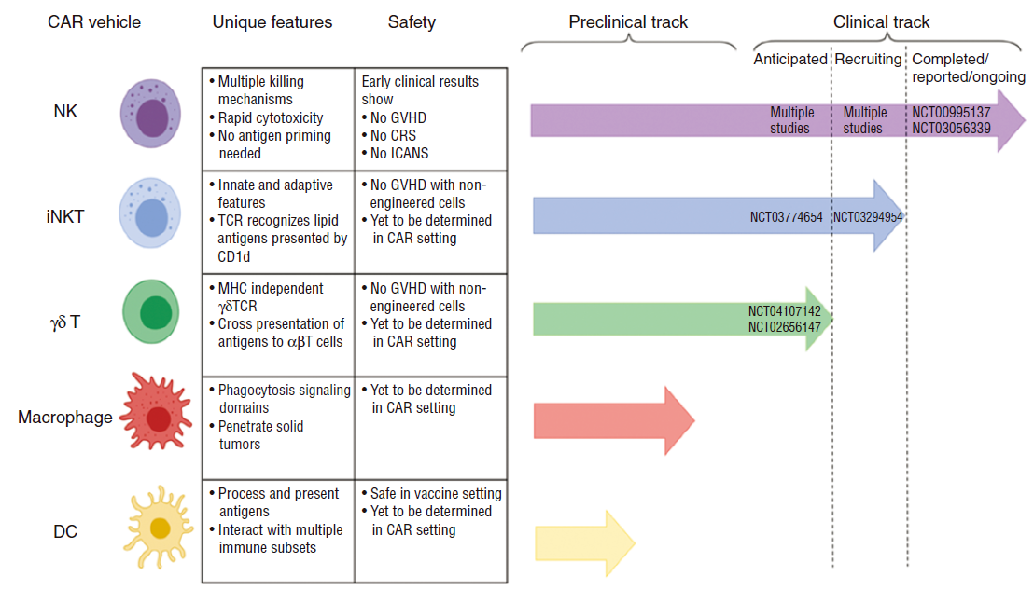
然而CAR-T细胞仍存在一些不足,例如副作用、毒性、T细胞耗竭,并且在实体瘤的治疗中显示出很低的疗效等。目前,
以CAR技术为核心的新型细胞疗法,CAR-NK、CAR-NKT、CAR-巨噬细胞(CAR-M)、CAR-Treg、CAR-γδT等异军突起,尤其CAR-NK和CAR-M在肿瘤的免疫治疗中展现出广阔的前景。
回顾CAR-T的发展史,首先要提到1957年Thomas及其同事报告的首次白血病患者骨髓移植以及随后Miller等人发现了T细胞的起源。然而,直到1986年Steven Rosenberg报告了一项关于肿瘤浸润淋巴细胞(
TIL
)的研究,这才让人们将目光锁定在“患者自身的免疫细胞可以对抗自身癌症”的理念上。
1992年,Sadelain等人成功地建立了逆转录病毒介导的基因转移到T淋巴细胞的方法,使基因修饰成为在实验或治疗环境中控制免疫的手段。几乎与此同时,ZeligEshhar及其同事利用抗体结合域和T细胞受体上免疫球蛋白的γ或ζ亚单位,通过嵌合单链设计了细胞毒性淋巴细胞的特异性激活,从而开发出第一代CAR-T细胞。
五年后,Sadelain博士的研究小组证明,将CD28等共刺激信号整合到CAR-T中可增强生存、增殖并保持活性,从而开发出第二代CAR。随后,携带靶向CD19的CAR-T细胞被开发出来,并启动了慢性淋巴细胞白血病(
CLL
)和急性淋巴细胞白血病(
ALL
)的I期临床试验。试验结果证明CAR-T疗法在化疗难治性ALL的成人中诱导有效缓解,随后生物工艺生产规模扩大。
2017年,FDA批准了CD19 CAR-T细胞疗法(
Tisagenlecleucel
)适用于儿童和年轻人的ALL。到目前为止,FDA批准了五种用于癌症治疗的CAR-T细胞治疗药物。
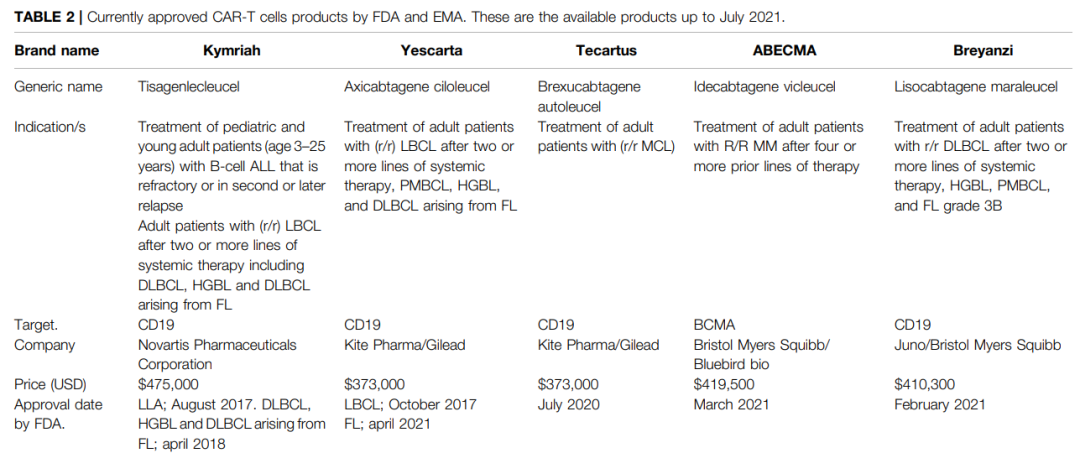
CAR-T细胞治疗面临的挑战,主要与副作用、毒性、T细胞耗竭和恶性肿瘤微环境(
TME
)有关。此外,在大规模生产中的制造过程目前既耗时又昂贵,因此,使尽可能多的患者接受CAR-T细胞免疫治疗成为一个更大的挑战。
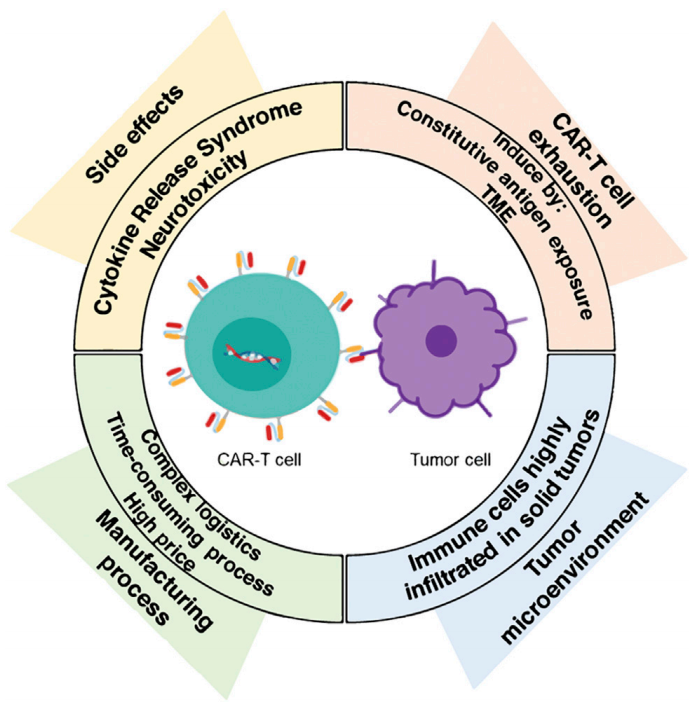
副作用和毒性
在CAR-T细胞输注后,这种免疫疗法可能具有潜在的致命毒性。毒性主要有两类:细胞因子释放综合征(
CRS
)和神经毒性(
NTX
)或CAR-T细胞相关脑病综合征(
CRES
)。
CRS或“细胞因子风暴”是一种全身炎症反应,由大量活化淋巴细胞(
B细胞、T细胞和自然杀伤细胞
)以及髓系细胞(
巨噬细胞、树突状细胞和单核细胞
)引起广泛的临床症状,包括发热、疲劳、头痛、皮疹、关节痛和肌痛。
NTX是CAR-T细胞免疫治疗的另一常见并发症,发生在40%以上的患者中。
患者表现出各种症状,如困惑、迟钝、震颤、谵妄、找词困难和头痛
。
CAR-T细胞耗竭
尽管CAR-T细胞治疗完全缓解率高,然而大部分获得缓解的患者在几年内表现出疾病复发,B-ALL的复发率从21%到45%不等,并随着随访时间的延长而增加。治疗失败的部分原因是实体瘤产生的TME导致的CAR-T细胞耗竭。
CAR-T细胞耗竭是指一种功能障碍状态,其特征是由于持续的抗原刺激、CAR结构的共刺激域和抑制性受体的表达增加而导致抗原特异性T细胞的缺失。体外CAR-T细胞研究表明,在CAR-T细胞耗竭过程中,抑制性受体(
如PD-1、Lag3、Tim3和TIGIT
)的表达上调,以及通过CTLA-4抑制PI3K/AKT通路,是导致抗肿瘤功能丧失的主要原因。细胞因子在其中也起着重要作用,如耗竭的CAR-T细胞降低表达分泌IL-2、TNF-α和IFN-γ的能力此外。其他因素,如转录因子、代谢和表观遗传修饰,也在CAR-T细胞耗竭发展中发挥重要作用。
肿瘤微环境
CAR T细胞免疫治疗在实体瘤中尚未取得成功。一个可能的原因是TME的免疫抑制性质影响过继免疫治疗的疗效。实体瘤存在高度浸润间质细胞,如癌相关成纤维细胞(
CAF
)和抑制性免疫细胞,包括髓源性抑制细胞(
MDSCs
)、肿瘤相关巨噬细胞(
TAM
)、肿瘤相关中性粒细胞(
TAN
)、肥大细胞,和调节性T细胞(
Treg
),它们有助于建立一种免疫抑制性TME,能够干扰CAR-T细胞疗法的疗效。
NK细胞是第一个被鉴定的先天性淋巴细胞(
ILC
)亚型,能对病毒感染和/或转化的细胞产生多种效应器功能,主要是细胞杀伤和产生促炎细胞因子。
CAR-NK
疗法的研究目前处于起步阶段,临床前和临床研究的数量逐年增加
,这体现在每年都在增加的关于CAR-NK的研究论文。
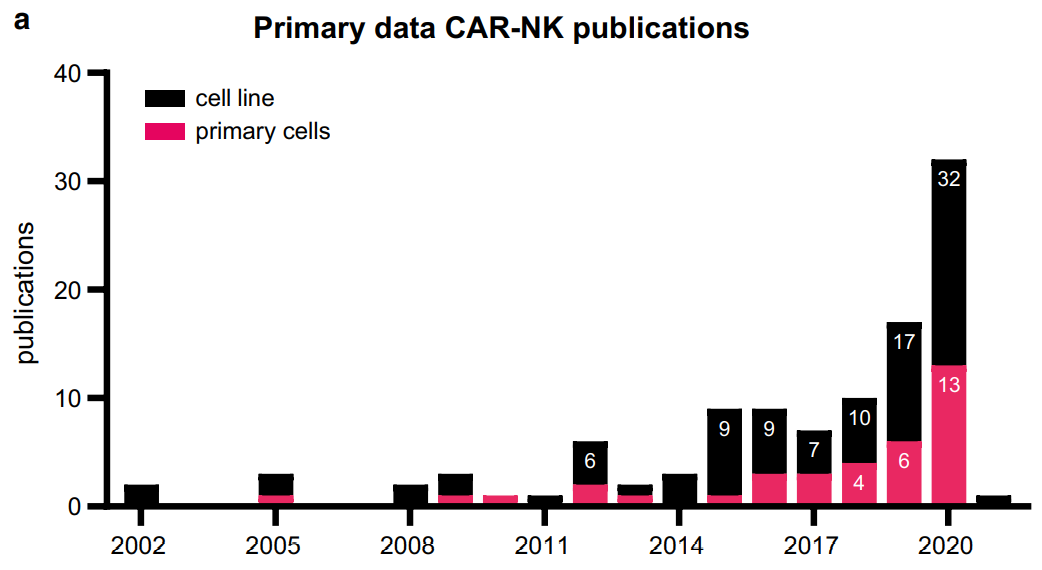
此外,在研究的靶标方面,Her2是实体瘤最常用的靶点,而CD19抗原在血液肿瘤中最常见。使用原代NK细胞的研究中,65%的人在研究B细胞恶性肿瘤,CD19是最受欢迎的靶点。有趣的是,在使用NK细胞系的研究中,研究实体瘤是血液恶性肿瘤的2倍以上。

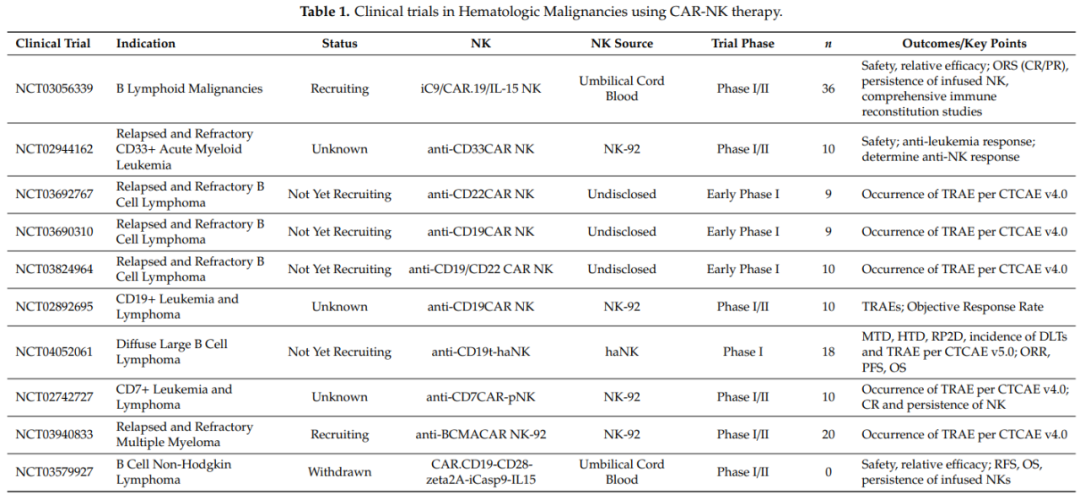
在临床研究方面, CD19-CAR-NK细胞对血液系统肿瘤有很高的应答率。除了CD19外,淋巴瘤和白血病的CAR-NK细胞临床研究也针对CD7(
NCT02742727
)和CD33(
NCT02944162
)。目前,有几种针对血液恶性肿瘤的CAR-NK细胞临床试验正在进行中。
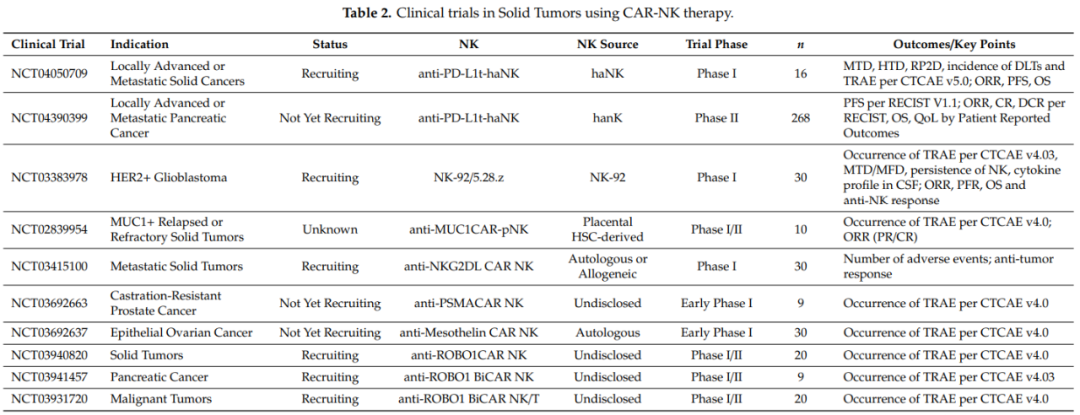
还有多项针对实体瘤的研究处于启动或招募阶段。
CAR-NK细胞和CAR-T细胞一样存在胞外、跨膜和胞内信号传导域。NK细胞通过另外两个共刺激分子,即NKG2D和CD244(
2B4
)增加其细胞毒性能力和细胞因子的产生。因此,比CAR-T细胞具有更强的肿瘤特异性靶向性和细胞毒性。CAR-NK细胞疗法可能在未来成为CAR-T疗法的替代方案,因为CAR-NK细胞具有以下超越CAR-T的几个独特特征。

首先,异基因NK细胞对于过继性细胞治疗(
ACT
)是相当安全的,因为它们通常不介导发生GVHD。此外,NK细胞仅分泌少量IFN-γ和GM-CSF,不产生启动CRS的IL-1和IL-6。其次,除了通过单链抗体识别肿瘤表面抗原来抑制癌细胞外,NK细胞还可以通过多种受体识别各种配体来抑制癌细胞,例如自然细胞毒性受体(
NKp46、NKp44和NKp30
)、NKG2D和DNAM-1(
CD226
)。最后,NK细胞在临床样本中非常丰富,可以从外周血(
PB
)、脐带血(
UCB
)、人类胚胎干细胞(
HESC
)、诱导多能干细胞(
IPSC
)甚至NK-92细胞系中产生。
与此同时,CAR-NK也面临着一些挑战。首先,
在缺乏细胞因子支持的情况下,输注细胞缺乏体内持久性是过继NK细胞治疗的主要缺点之一。
虽然它可能更安全的,但它也会限制NK细胞免疫治疗的效果。其次,
快速归巢到肿瘤床对于过继性细胞治疗效果至关重要,并且受NK细胞和肿瘤细胞释放的趋化因子之间复杂相互作用的控制。
然而,NK细胞归巢到肿瘤部位的效率一直存在争议,因此促使人们不断努力去进行改进。第三,同CAR-T类似,
TME包括免疫抑制分子、免疫抑制细胞和妨碍免疫细胞功能的不利环境,是CAR-NK细胞治疗的主要障碍。最后,
基于慢病毒的转导系统是细胞内基因修饰和传递的最常用的方法之一。然而,由于自然特性,NK细胞对慢病毒具有抗性,这使得基于慢病毒的转导成为一个挑战。
鉴于CAR-T细胞治疗的成功和CAR-NK细胞的发展潜力,研究人员对开发用于肿瘤免疫治疗的CAR巨噬细胞(
CAR-M
)产生了极大的兴趣。CAR-M的出现为治疗实体瘤开辟了新的可能性:用特异性CARs修饰人巨噬细胞,以提高巨噬细胞对肿瘤的吞噬活性和抗原呈递。
目前使用CAR-M治疗癌症已进行了多种尝试。研究人员设计了嵌合抗原受体吞噬细胞(
CAR-P
),它可以引导巨噬细胞吞噬特定的靶细胞。
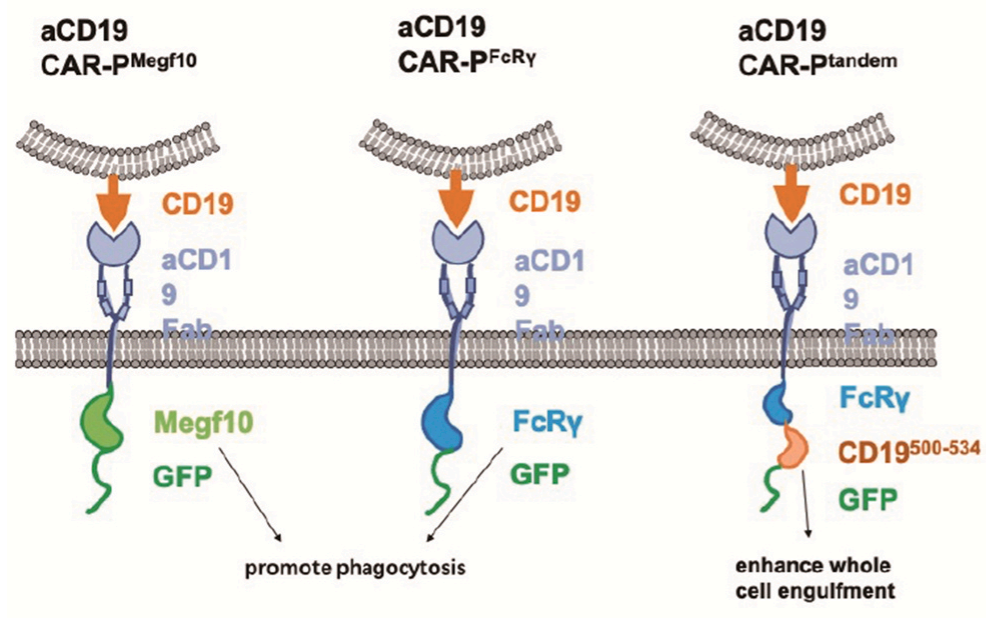
研究证明,表达Megf10或FcRv胞内结构域的CAR-P可促进对靶抗原的吞噬能力。CAR-PMegf10可以特异性地触发对靶向配体的吞噬作用,通过酪氨酸磷酸化的局部信号级联反应启动吞噬,TCR-CD3ζ可能通过招募syk激酶而促进CAR-P的吞噬作用。
全细胞吞噬是比较罕见的,而啃咬靶细胞更为频繁,这表明CAR-P巨噬细胞与靶细胞之间的相互作用不足以触发直接的全细胞吞噬。已有研究发现,PI3K信号在大靶点的内吞过程中起重要作用,可以促进巨噬细胞的吞噬作用。研究人员将pI3K p85亚单位与CAR-P-FcRv连接起来,形成一个“串联”CAR(
CAR-Ptandem
)。CAR-Ptandem具有较好的全细胞吞噬功能。
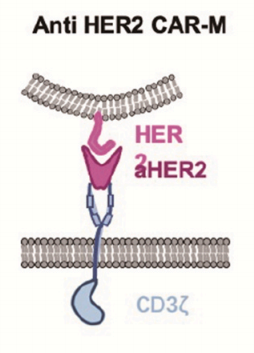
宾夕法尼亚大学的研究人员使用含有CD3-ζ胞内结构域的抗HER2的CAR-M。在两种实体瘤移植的异位小鼠模型中,单次注射抗HER2-CAR-M可降低肿瘤负荷,延长小鼠存活时间。在人源化小鼠模型中还发现, HER2-CAR-M能够将M2巨噬细胞转化为M1巨噬细胞,诱导炎症性肿瘤微环境,增强T细胞的抗肿瘤细胞毒性。此外,还发现HER2-CAR-M可能产生表位扩散,为避免肿瘤免疫逃逸提供了新思路。
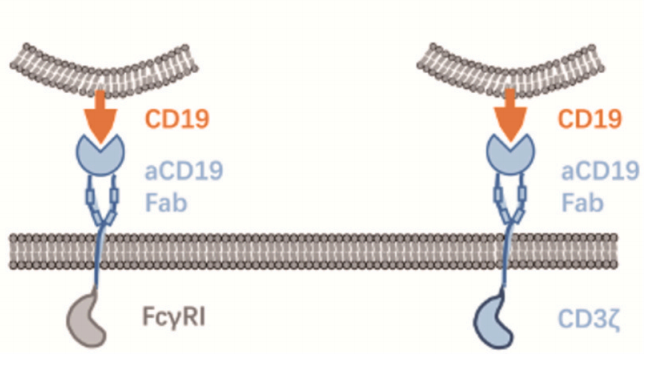
Zhang等人利用诱导多能干细胞(
iPSCs
)表达CAR结构并分化为巨噬细胞,命名为CAR-iMac。研究表明,表达CAR的iPSCs能分化为巨噬细胞样细胞,在无抗原的情况下,CAR-iMac更接近M2极化状态。然而,在存在特异性抗原的情况下如CD19,CAR介导的信号促进了CAR-iMac的吞噬作用,并导致CAR-iMac向促炎的M1型的转化。iPSC来源的巨噬细胞可能成为髓系肿瘤免疫治疗的重要细胞来源。
CAR-T治疗实体瘤无效的一个重要原因是T细胞难以进入肿瘤组织。这是因为实体瘤细胞外基质(
ECM
)形成的物理屏障阻止了T细胞进入肿瘤组织。ECM由高度有序的纤维分子、糖蛋白和其他大分子产生,其合成和降解主要受基质金属蛋白酶(
MMPs
)和金属蛋白酶组织抑制剂(
TIMPs
)的调控,而巨噬细胞就是MMP的重要来源。
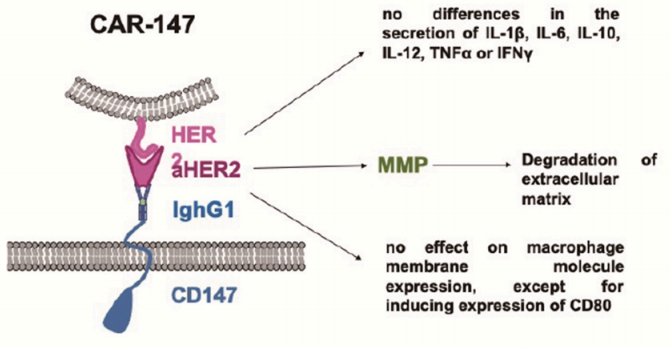
研究人员设计了一种CAR-147的结构,它由靶向人HER2的单链抗体、IghG1的铰链区和小鼠CD147分子的跨膜和细胞内区域组成。CAR-147与HER2+人乳腺癌细胞共培养后,在CAR-147巨噬细胞中诱导多个MMP的表达,证明CAR-147能特异性识别HER2抗原,有效激活巨噬细胞中MMP的表达。CAR-147巨噬细胞在体外不抑制肿瘤细胞增殖,但静脉注射CAR-147巨噬细胞可显著抑制4T1乳腺癌小鼠模型的肿瘤生长。同时发现用CAR-147巨噬细胞治疗的肿瘤中T细胞所占的比例远高于对照巨噬细胞治疗的肿瘤,说明CAR-147巨噬细胞能破坏肿瘤细胞外基质,促进T细胞向肿瘤浸润。













