
对药物释放速率的精确控制对于增强治疗效果、减少副作用和保持药物水平稳定至关重要。虽然微针(MNs)为经皮药物递送提供了一种有前景的方法,但传统的被动响应系统通常缺乏对不同药物和疾病模型的适应性,限制了其通用性。
来自华南理工大学的袁友永团队
展示了一种柔性生物电子微针贴片(FBMP),它集成了柔性电子器件,以实现主动控制的经皮递送。FBMP结合了柔性印刷电路板(FPCB)、共晶镓铟(EGaIn)加热膜以及具有聚乙烯醇(PVA)核心和聚己内酯(PCL)外壳的双层微针。这种配置允许通过智能手机控制的蓝牙实时调整热响应速率,从而实现在2分钟内快速释放药物或在10小时内持续释放。在各种动物模型中,FBMP展示了在递送多种药物类型、优化疗效以及最小化急性和慢性疾病的副作用方面的通用性。总的来说,这项工作介绍了一个灵活的、通用的电子微针平台,该平台具有显著的潜力,通过实现可定制的、主动控制的药物释放,推动精准医学和个性化医学的发展。相关工作以题为“
A Wireless Operated Flexible Bioelectronic Microneedle Patch for Actively Controlled Transdermal Drug Delivery”
的文章发表在2025年02月05日的期刊
《Advanced Materials》
。

【设备设计与工作原理】
柔性生物电子微针贴片(FBMP)的概念示意图如图1所示,该设备设计为便携且可穿戴式。如图1A所示,FBMP主要包含一个柔性电路板(FPCB)、一个柔性基底、一个EGaIn加热膜以及一个双层微针。整个设备可以通过智能手机上的应用程序进行无线控制。通过调节FPCB的PWM输出,可以控制液态金属加热膜的温度,从而控制微针模块的释放速率。当发送“高功率”指令时,微针将快速释放,这有望替代传统的注射给药方式。这适用于需要快速给药的应用场景,例如应对急性疾病或进行快速麻醉(如图1B所示)。当发送“低功率”状态时,微针将以缓慢且持续的速率释放药物。这将适用于慢性疾病,如肿瘤。一些抗癌药物,如细胞因子、干扰素-γ,在短时间内快速给予可能会引发细胞因子风暴。而对于PROTAC药物,另一方面,则需要以适当的剂量持续释放,以避免降低疗效的钩状效应(如图1C所示)。因此,对于某些药物,持续缓慢的给药方式可以避免其毒性副作用,并提高治疗效果。
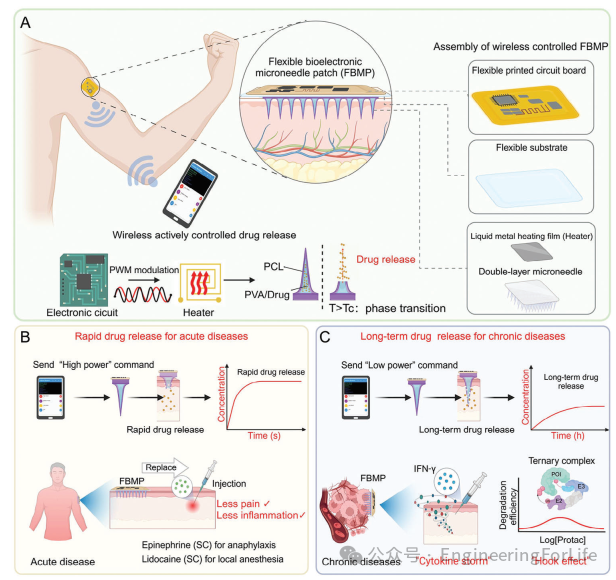
图1 通过FBMP主动按需经皮药物递送
双层微针由PVA内核和PCL外壳组成。双层微针的图像如图2A、B所示。双层微针(DLMN)是通过在聚二甲基硅氧烷(PDMS)阴模上使用微成型技术制造的。微针阵列的结构和形态使用扫描电子显微镜(SEM)和共聚焦激光扫描显微镜(CLSM)进行表征(图2A、B)。每个金字塔形微针(MN)整齐地排列成10×10的方阵,中心距为900µm。每个微针的平均高度、尖端直径和基底直径分别为900µm、400µm和400µm。通过喷涂的方式将PCL涂覆在双层微针(DLMN)的表面。此外,在PCL中引入荧光素异硫氰酸酯(FITC),在PVA中引入罗丹明B(RhB),以帮助通过这些染料的发射波长差异区分两部分。显然,在DLMN的每个针中同时观察到红色和绿色两种发射光。在每个微针尖端,红色和绿色信号并不完全重叠,确认了两个独立的部分。DLMN应穿透皮肤的角质层(SC)而不破裂,以进行经皮药物递送。将微针阵列应用于小鼠皮肤后,可以明显观察到微针形成的针孔,并且这些针孔在9分钟内完全恢复。DLMN在机械测试中的穿透力如图2C所示。由于猪皮的固有阻力特性,力随加载位移逐渐增加。在插入过程中,在点“P”处可以清楚地观察到插入力的一个小突变下降。这表明微针阵列的尖端压缩已经超过了皮肤破裂极限,已经刺穿了皮肤。因此,DLMN的穿透力=0.51N,远小于断裂力。微针的断裂力测试结果如图2D、E所示。通常,成年人用拇指按压微针的平均压缩力=20N。因此,本文的DLMP只需用拇指按压即可轻松穿透皮肤而不会破裂。为了确保本工作中加载药物的微针具有足够的机械性能来刺穿皮肤,本文还测试了加载不同药物的DLMN的机械性能以及用于模拟皮肤组织的Parafilm的穿刺深度。
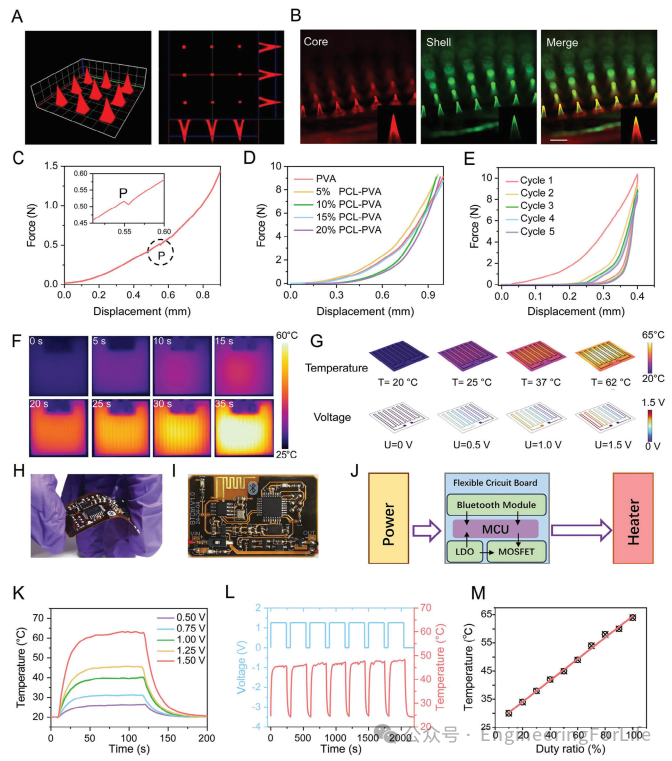
图2 设备设计与工作原理
【FBMP的活性控释药物释放】
为探究FBMP的释放性能,将微针阵列插入猪皮组织后,在相同时间内对加热器施加不同电压。5分钟后取出微针,在扫描电子显微镜下可观察到微针的降解情况,如图3A所示。结果表明,在0 V下,DLMN在5分钟内未溶解。在0.5 V和1.0 V下,DLMN仅轻微溶解,且1.0 V驱动的DLMN尖端部分的溶解程度略高于0.5 V驱动的DLMN,而在1.5 V下,DLMN在5分钟内完全溶解。我们还使用新鲜的小鼠皮肤组织验证了FBMP穿透角质层并释放药物的能力。如图3B所示,微针穿透角质层并将染料释放到组织中。由于施加不同电压后加热器的最终温度不同,DLMN的降解速率也不同。在小鼠皮肤组织和活鼠背部,观察到较高电压导致更快的释放,而较低电压则导致FBMP的持续缓慢释放。
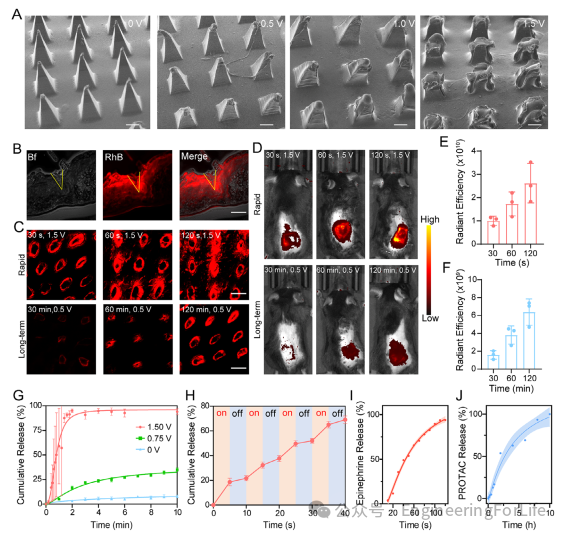
图3 FBMP的药物递送性能
【通过FBMP快速治疗过敏性休克和局部镇痛】
作为概念验证,本文通过FBMP快速经皮递送肾上腺素来评估急性和异质性过敏性休克事件的管理。使用被动全身性过敏性休克协议建立了小鼠过敏性休克模型。然后,测试了通过FBMP按需递送肾上腺素来治疗过敏性休克的效果(图4A)。在诱导过敏性休克后约10分钟,过敏性休克小鼠接受了治疗。使用FBMP经皮递送肾上腺素。微针加载了肾上腺素,并测试了体外可控的肾上腺素递送。为了验证本文的设备在治疗急性过敏性休克中的有效性,使用体温、行为评分和血清组胺水平跟踪了过敏性休克小鼠的动态进展和治疗反应。在注射过敏原DNP-HAS后,五只小鼠的行为评分和体温急剧下降,表明过敏性休克诱导成功。过敏性休克小鼠通过FBMP接受了肾上腺素的突发递送,箭头表示过敏性休克后10分钟的突发递送。正常化的行为评分和体温表明过敏性休克得到了逆转。每只小鼠实验期间记录的体温和行为评分如图4B所示。与空白(FBMP)组相比,肾上腺素(FBMP)组在给药后的行为评分和温度记录显示出明显的逆转趋势(在图4B中,箭头表示给药的时间点)。通过给予肾上腺素来逆转急性休克,肾上腺素(FBMP)组的最终行为评分和最终体温恢复正常。相比之下,未经任何治疗的过敏性休克小鼠无法恢复正常状态。通过ELISA试剂盒测试全血样本得到的血液组胺水平的结果显示在图4C中。与空白组相比,肾上腺素治疗后,平均组胺水平从891.98降至140.24 pg/mL。两组小鼠最高体温下降的统计结果如图4D所示,两组的平均值分别为3.4℃和14.48℃。Epinephrin(FBMP)组和Blank(FBMP)组的肺组织H&E染色图像。结果表明,与Epinephrin(FBMP)组相比,空白(FBMP)组小鼠肺实质中的细胞数量增加。在高倍镜下,空白(FBMP)组的急性过敏性休克导致肺泡空间显著萎缩和肺泡间隔增宽。同时,观察到肺泡空间出血和渗出、肺泡上皮细胞和细支气管上皮细胞肿胀和脱落。这些情况在Epinephrin(FBMP)组中得到了显著改善。总的来说,行为评分和体温的恢复表明我们成功地使用了该设备递送肾上腺素并逆转了急性过敏性休克。这些结果表明,通过FBMP快速经皮递送肾上腺素可以有效治疗急性过敏性休克。

图4 FBMP在快速药物释放中的应用
【通过FBMP长期联合递送IFN-γ和PRO治疗肿瘤】
钩状效应是一种现象,即过量的PROTAC分子倾向于与目标蛋白或E3连接酶形成二元复合物,这会抑制三元复合物的形成,并导致目标蛋白的降解减少。含溴结构域蛋白4(BRD4)在肿瘤细胞中CD274基因(编码PD-L1)的启动子区域富集,促进CD274基因转录和PD-L1的上调。BRD4与肿瘤细胞中PD-L1水平的增加有关。因此,通过降解BRD4可以抑制PD-L1的上调。如图5A所示,本文使用Western blot实验来探索PRO的最佳浓度。当浓度为2.5 µM时,PRO对BRD4蛋白的降解效果最好。当浓度超过这个值时,条带恢复,证明了钩状效应的存在。此外,干扰素-γ(IFN-γ)是一种具有广泛免疫调节作用的淋巴因子,尽管它已被证明具有显著的抗肿瘤效果,但IFN-γ也能上调肿瘤细胞中PD-L1的含量,从而导致免疫逃逸。同时,短时间内给予大量细胞因子有导致细胞因子风暴的风险。本文验证了IFN-γ在细胞水平上诱导PD-L1上调的作用。如图5B所示的共聚焦激光扫描显微镜图像显示:与PBS组和PRO组相比,单独给予IFN-γ后细胞膜表面的PD-L1荧光显著增强,而同时给予PRO和IFN-γ则能有效抑制PD-L1的上调。这证明了两种药物联合使用的意义。为了避免IFN-γ带来的细胞因子风暴和PRO的钩状效应,IFN-γ和PRO需要在给药期间持续作用以达到更好的治疗效果,如图5C所示,两种药物的协同作用应表现出更强大的杀瘤效果。这表明FBMP系统在两种药物联合持续释放方面具有潜在的应用潜力。
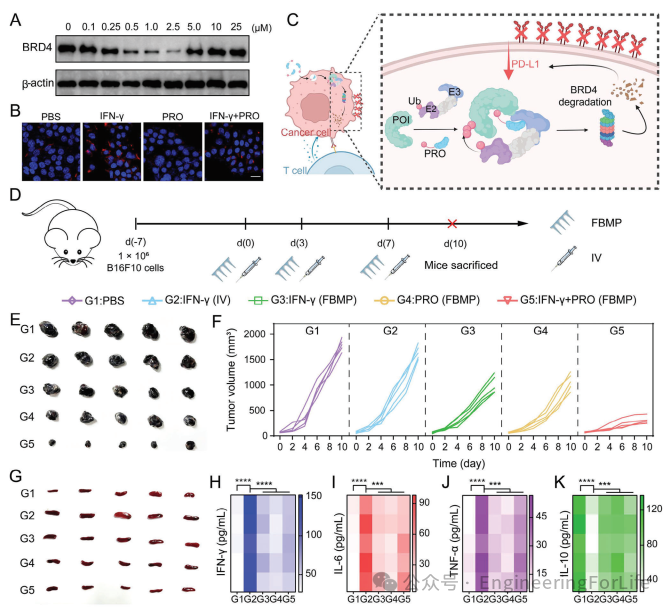
图5 FBMP在长期药物释放中的应用
【FBMP联合递送IFN-γ和PRO诱导抗肿瘤免疫反应】
IFN-γ能够促进细胞毒性T(CTL)细胞的分化和增殖,并抑制调节性T细胞的分化。同时,PRO可以逆转IFN-γ引起的肿瘤细胞上PD-L1上调以及CTL细胞浸润肿瘤组织减少的情况。为了评估这种策略的有效性,在小鼠牺牲后对肿瘤组织进行了免疫流式细胞术分析。值得注意的是,在IFN-γ和PRO的联合治疗后,肿瘤内CD8+和CD4+ T淋巴细胞的浸润显著增加(图6A)。CD8+和CD4+ T淋巴细胞在CD45+淋巴细胞中的比例显著增加,从3.12%和8.59%(PBS组)分别增加到24.1%和24.4%(G5组)(图6C、D)。由于IFN-γ的免疫激活作用或肿瘤原有免疫检查点的减少,接受PRO或IFN-γ治疗的组中肿瘤浸润T淋巴细胞的数量也有所增加。相比之下,联合组(G5)能够产生更有效的免疫反应。Treg细胞通过干扰效应T细胞的功能来抑制抗肿瘤免疫,而IFN-γ作为一种促炎细胞因子,可以抑制Treg细胞的分化和功能。本文发现,在IFN-γ治疗组中,Treg细胞的比例从16.7%(G1)分别降低到8.70%(G2)、4.65%(G3)和3.85%(G5)(图6B、E)。然而,微针组(G3和G5)的效果比注射组(G2)更好,因为药物能够直接到达肿瘤部位。免疫荧光染色检测了肿瘤组织中PD-L1和BRD4的表达(图6F–I)。上述结果进一步得到解释,PRO降低了肿瘤中PD-L1的表达水平,这可以逆转IFN-γ在体内诱导的肿瘤激活的负面效应。这些结果表明,通过FBMP递送IFN-γ + PRO的策略在产生抗癌免疫反应方面非常有效。















