

在全球范围内,恶性肿瘤已经成为威胁人类健康甚至生命的最严重疾病之一,与糖尿病和心脑血管疾病并称为“三大疾病杀手”。使用小分子药物杀死肿瘤细胞的化学治疗(简称化疗)是恶性肿瘤的传统且重要的治疗方法之一。虽然小分子药物可以在一定程度上抑制肿瘤的进展,然而其容易被肝脏和肾脏等代谢和清除,体内半衰期短,治疗效果并不理想。同时,小分子药物缺乏组织选择性,从而引起其对正常组织和细胞的杀伤等严重毒副作用。通过构建纳米载体可控传输小分子药物成为解决该问题的有效途径。作为该领域的研究热点,高分子纳米载体可以帮助小分子药物有效地减缓肝脏和肾脏等的清除,并通过增强渗透与滞留(EPR)效应提高其在肿瘤组织的聚集,从而达到增效减毒的目的。
聚乙二醇−聚丙交酯(PEG−PLA)嵌段共聚物因其良好的生物降解性和生物相容性而被广泛用作药物传输载体。以其为载体的紫杉醇胶束制剂Genexol®-PM于2007年在韩国上市,作为一线药物治疗复发性、转移性乳腺癌,并与顺铂联用治疗非小细胞肺癌。然而,PEG−PLA胶束在血液循环中的稳定性较差,这限制了其治疗效果的进一步提高。
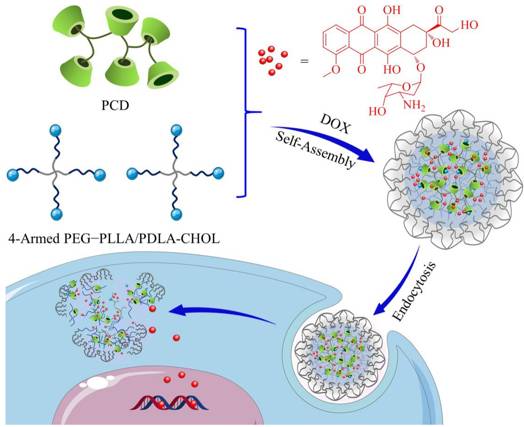
▲ 立体复合和主客体相互作用调控PEG−PLA胶束用于持续性细胞内药物释放
聚(L-丙交酯)(PLLA)和聚(D-丙交酯)(PDLA)是PLA的两种不同构型,其立体复合相互作用能够一步提高PEG−PLA胶束药物传输体系的稳定性。中国科学院长春应用化学研究所丁建勋副研究员与法国巴黎大学RuxandraGref教授合作在四臂PEG−PLLA和四臂PEG−PDLA的末端分别修饰胆固醇(CHOL),并将不同量的聚(β-环糊精)(PCD)中的β-CD结构单元与CHOL的主客体相互作用引入该立体复合体系中,调控PEG−PLA胶束的理化性能、载药能力,并进一步影响载药胶束的生物学功能。研究表明较高比例PCD的引入在提高胶束内核稳定性的同时赋予其一定的亲水性,从而实现高载药能力与快速细胞内药物释放,进而提高细胞内药物浓度以及对肿瘤细胞的抑制作用。综上所述,立体复合和主客体等弱相互作用协同调控的PEG−PLA胶束药物传输体系在恶性肿瘤治疗中具有很大潜力。
参考文献:
Xiang-ru Feng, Jian-xun Ding,Ruxandra Gref, Xue-si Chen, Poly(β-cyclodextrin)-mediated Polylactide-cholesterolStereocomplex Micelles for Controlled Drug Delivery, Chinese Journal of Polymer Science, 2017, 35(6): 693-699

来源:CJPS
声明:凡本平台注明“来源:XXX”的文/图等稿件,本平台转载出于传递更多信息及方便产业探讨之目的,并不意味着本平台赞同其观点或证实其内容的真实性,文章内容仅供参考。
我们的微博:高分子科学前沿,欢迎和我们互动。
在菜单中回复“交流群”:可加入导师学术群,企业界及一系列技术交流群
投稿 荐稿 合作:[email protected]














