本文作者为首都医科大学附属北京妇产医院麻醉科 刘野和徐铭军,本文已发表在《麻醉学大查房》上。
1. 病例摘要
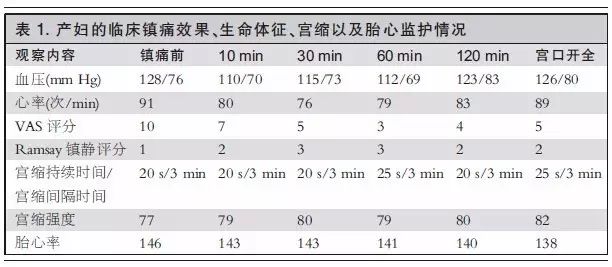
患者女,29岁,161 cm, 73 kg,诊断:孕2产0,孕39+4周,腰椎间盘突出症。宫口开大3 cm,心率(HR)91次/min,血压(BP)128/76 mm Hg(1 mm Hg=0.133 kPa),产妇自诉宫缩后腰骶部疼痛难忍,要求分娩镇痛。既往腰椎间盘突出症病史2年,患者入院前2年出现腰痛,伴右下肢大腿后方及右小腿后外侧疼痛,给予理疗、椎管阻滞等治疗后好转,3个月前腰腿疼痛症状加重,咳嗽时明显,伴走路跛行。查体:脊柱无畸形,L4~L5、L5~S1棘突右侧旁压痛伴叩击痛,并向右下肢后方放射,右下肢直腿抬高45°,双下肢无畸形,右小腿外侧皮肤触觉减退,双下肢肌力正常,双侧巴氏征阴性。腰椎CT示:L4~L5、L5~S1椎间盘突出。实验室检查示:血常规、凝血及其他检查无异常。麻醉医师评估产妇情况及各项指标,镇痛前视觉模拟评分(VAS)10分,胎心率146 次/min,宫缩持续20 s,宫缩间隔3 min,宫缩强度77 mm Hg。向家属交代麻醉镇痛相关风险,家属同意签字后拟行静脉分娩镇痛。开放静脉,输注乳酸林格氏液8 mL·kg-1·h-1,静脉给予昂丹司琼8 mg,5 min后经小壶给予曲马多注射液1.5mg/kg缓慢滴注,连接BaxterAP-Ⅱ电子泵,配置的镇痛溶液为0.70%曲马多+昂丹司琼8.0 mg,容量为50 mL,背景剂量2 mL/h,患者自控镇痛(PCA)剂量2 mL,锁定时间10 min。实施镇痛期间产妇的VAS评分、Ramsay镇静评分、生命体征、宫缩情况以及胎心情况见表1。产妇镇痛6 h后顺利娩出一女婴,体重3160 g,出生后1、5和10 min的阿普加评分为9-10-10;镇痛中产妇出现轻度恶心,未呕吐,出汗增多,出血280 mL。
【关键词】分娩镇痛;患者自控镇痛;曲马多;麻醉;椎管内阻滞
2. 静脉分娩镇痛的管理分析
分娩疼痛是一种正常的生理现象,是产妇在临产时由于子宫收缩引起的一种重要的生物学效应,提示产程的开始。但进而出现的持续性难以忍受的疼痛,不仅使产妇感到痛苦、烦躁或忧郁,而且以此为应激所产生的神经-内分泌反应,可引起一系列生理改变,最终对分娩过程和胎儿造成不利影响[1]。
2.1 分娩疼痛的产生机制
分娩过程中,由于子宫肌阵发性收缩,子宫下段和宫颈管扩张以及盆底和会阴受压可激惹其中的神经末梢产生神经冲动,沿内脏神经和腰骶丛神经传递至脊髓,再上传至大脑痛觉中枢,使产妇产生剧烈疼痛的感受,即分娩疼痛(或称“产痛”),产痛还与产妇的心理因素有关。产痛的强度因个体的痛阈而异,也与分娩次数有关。大多数初产妇自子宫收缩开始即出现疼痛,且随着产程的进展而加剧。经产妇则多在第二产程开始后方见疼痛加剧[2]。经阴道自然分娩分为三个阶段(产程),产痛主要出现于第一和第二产程,不同产程疼痛的神经传导亦不同:①第一产程自规律子宫收缩开始到宫口开全,其间子宫体、子宫颈和阴道等组织出现巨大变化,胎头下降促使子宫下段、宫颈管和宫口呈进行性展宽、缩短、变薄和扩大;子宫肌纤维伸长和撕裂;圆韧带受到强烈牵拉而伸长。这些解剖结构的迅速变化构成了强烈的刺激信号,刺激冲动由盆腔内脏传入神经纤维及相伴随的交感神经传入T10~T12和L1脊髓节段,然后再经脊髓背侧束迅速上传至大脑,构成典型的“内脏痛”,疼痛部位主要在下腹部、腰部及骶部。第一产程疼痛的特点是:腰背部紧缩感和酸胀痛,疼痛范围弥散不定,周身不适;②第二产程自宫颈口开全至胎儿娩出,此阶段除了子宫体收缩及子宫下段扩张外,胎儿先露部压迫盆腔组织以及会阴扩张也是引起疼痛的原因。疼痛冲动经阴部神经传入S2~S4脊髓节段,并上传至大脑,构成典型的“躯体痛”,其疼痛性质与第一产程完全不同,表现为刀割样尖锐剧烈的疼痛,疼痛部位明确,集中在阴道、直肠和会阴部;③第三产程胎盘娩出,子宫体缩小,子宫内压力下降,痛觉明显减轻[3]。
2.2 分娩镇痛常用的方法
理想的分娩镇痛应具备以下条件:
①对母婴的影响小;
②易于给药,起效快,作用可靠,满足整个产程镇痛的需求;
③避免运动神经阻滞,不影响子宫收缩和产妇运动;
④产妇清醒,可参与分娩过程;
⑤必要时可满足手术的需要[4]。
(内容有略,具体见全文)
常用的分娩镇痛方法主要包括非药物性分娩镇痛和药物性分娩镇痛两大类。
2.2.1 非药物性镇痛
精神镇痛法
自然分娩法:主要是对孕妇进行解剖和生理知识教育,消除紧张和恐惧,训练肌肉放松,在分娩期加强特殊呼吸及体操训练,减轻疼痛[5];
精神预防性分娩镇痛法: 50年代初苏联根据巴甫洛夫的条件反射学说,结合按摩方法实施无痛分娩,主要是增强大脑皮层的功能,使皮层和皮层下中枢之间产生良好的调节,让分娩在无痛感下进行。此法我国亦曾广泛应用,并取得一定的效果。精神预防性分娩应首先从产前做好,成立孕妇学校,让孕妇及其丈夫参加听课。在孕期给予生动、易理解的宣传教育,介绍妊娠和分娩知识,让孕妇了解分娩的机理,学会分娩时的助产动作,建立家庭式病房,由其丈夫及家属陪伴。
拉马策法:是由法国医师Fernaudl Lamage改进发展后,欧美多国采用的分娩镇痛法。对孕妇及其家属进行教育,消除其紧张情绪,临产开始后行镇痛呼吸技术,采取深而慢的胸式呼吸,每一次宫缩的开始和结束时,从鼻孔吸气,用嘴呼出,以此来缓解紧张情绪,也称净化呼吸,宫缩间歇时停止。第一产程末期,产妇宫口开全,采用快而浅的呼吸和喘气,第二产程用向下屏气代替了喘气,产妇屈膝,两手握膝,在第一产程活跃期,宫缩时可按摩下腹部或嘱产妇侧卧按摩腰骶部,与深呼吸相配合,宫缩间歇时停止。同时嘱产妇双手拇指按压骼前上棘、骼嵴或耻骨联合,或呼气时两手握拳,压迫两侧腰部或骶部,与按摩法交替使用[6];
Doula陪伴分娩: 70年代由美国医师M.Klaus首先倡导,其内容是由一名有经验的妇女帮助另一名产妇。
针刺镇痛法
针刺镇痛法包括:① 针刺镇痛;② 经皮电神经刺激法(TENS);③ 韩氏疼痛治疗仪(HANS)等。
2.2.2 药物性镇痛
药物镇痛法
临床上主要应用的方法有麻醉性镇痛药、镇静药或静脉麻醉药,包括氧化亚氮(笑气)、哌替啶(杜冷丁)、地西泮(安定)和曲马多等。
麻醉镇痛法
麻醉镇痛主要包括区域阻滞(宫颈旁神经阻滞、阴部神经阻滞)、持续静脉镇痛和椎管内阻滞镇痛。其中经椎管内阻滞镇痛是目前常用的分娩镇痛方法,最为有效且不良反应相对较少,该方法可使产妇保持一定的活动能力,主动参与分娩过程,即使自然分娩失败,仍可继续用于剖宫产的麻醉,并且对胎盘功能不全的胎儿有益[7]。
椎管内镇痛方法包括:
连续硬膜外阻滞:具有镇痛效果确切,运动阻滞轻,对循环动力学影响较小,对中枢神经系统无抑制等优点;
腰-硬联合阻滞:具有起效快,镇痛完善,不易出现单侧阻滞不全的现象,平面易于控制,临床用药量相对较小,灵活性高,在分娩后期,也可注射阿片类药物进行镇痛[8];
连续蛛网膜下腔阻滞:经蛛网膜下腔Spinocath导管连续或分次小剂量注入阿片类镇痛药,可获得满意的分娩镇痛,并可避免低血压和运动神经阻滞,减少全身不良反应[9]。
尽管每一种方法均有其特点和优点,但是,椎管内镇痛仍然存在以下不足之处:
①椎管内镇痛属于有创操作,可发生椎管内血肿、脓肿,脊髓神经损伤,穿刺后头痛和腰背部疼痛等并发症;
②产程进展迅速错过硬膜外穿刺时机;
③产妇对硬膜外穿刺存在恐惧心理;
④不适合进行硬膜外穿刺(腰椎间盘突出症等椎管内病变,腰椎手术史,背部感染、凝血功能异常等);
⑤硬膜外穿刺操作失败[10]。
有些产妇不适合实施椎管内阻滞镇痛,如拒绝穿刺的产妇、有腰椎病变者、有发热和对局部麻醉药过敏的产妇等。对于这类产妇,可以给予安全、简便、易行的静脉分娩镇痛,临床上常用的药物有:芬太尼、阿芬太尼、舒芬太尼、瑞芬太尼、地西泮、氯胺酮、哌替啶、布托啡诺、曲马多等[11]。瑞芬太尼因其特殊的药理特性成为静脉分娩镇痛研究的热点。瑞芬太尼起效时间为30 s,峰效应时间为1 min,作用时间为5~10 min,血浆时量相关半衰期(cotext-sensitive half time, CSHT)为3~5 min,停药后快速清除,长时间滴注无蓄积顾虑,给药时机不受限制,优于传统的全身用药。由于产痛呈间歇性,滞后子宫收缩10~20 s疼痛出现,理论上患者自控镇痛(PCA)模式可使瑞芬太尼血药浓度的变化与宫缩同步[12]。幼儿和新生儿的药物分布容积大,清除速率更快,瑞芬太尼虽然容易通过胎盘,但可被胎儿快速代谢,不会引起呼吸抑制[13]。瑞芬太尼在孕妇体内也可快速清除,平均清除率为93.1 mL·kg-1·min-1,为非孕妇(41.2 mL·kg-1·min-1)的2倍,清除加快与妊娠后血容量、心输出量和肾脏灌流量增加有关。推荐瑞芬太尼单次剂量0.5 μg/kg,锁定时间3 min或复合背景剂量0.05 μg·kg-1·min-1能提供安全有效的镇痛,复合背景剂量可减少按压次数。Balcioglu等[14]使用瑞芬太尼负荷剂量20 μg,背景剂量0.15 μg·kg-1·min-1,单次剂量15 μg,锁定时间5 min,取得了较好的镇痛效果。考虑到种族差异,冯善武等[15]使用瑞芬太尼负荷剂量20 μg,较小的背景剂量0.1 μg·kg-1·min-1,单次剂量0.25 μg/kg,锁定时间2 min的方法,取得了良好的效果。景晨萌等[16]应用瑞芬太尼静脉自控给药,研究显示,在第一产程平均使用瑞芬太尼0.1 μg·kg-1·min-1或单次剂量0.5 μg/kg时,胎儿可以较好地耐受,第二产程药物代谢完全,未发生新生儿药物性呼吸抑制。但是瑞芬太尼用药剂量大于0.2 μg·kg-1·min-1时,患者出现明显的呼吸抑制。瑞芬太尼用药剂量为0.15 μg·kg-1·min-1时,在宫缩间歇期可以观察到产妇呼吸次数减少、幅度减小,并随宫缩来临而逆转。虽然在确保不发生呼吸抑制的情况下,瑞芬太尼静脉分娩镇痛的效果尚不及现在使用的成熟的椎管内阻滞镇痛技术,但许多研究者认为,该方法确实不失为一种可行的分娩镇痛方法[17,18]。Volmanen等[19]对瑞芬太尼单次剂量0.5 μg/kg和50%氧化亚氮间断吸入的镇痛效果进行了比较,结果发现瑞芬太尼的镇痛效果明显优于氧化亚氮。
曲马多是人工合成的非吗啡类强效镇痛药,镇痛强度弱于芬太尼,其镇痛强度为吗啡的1/10,作用维持时间约30 min,治疗剂量的曲马多不产生欣快感,对呼吸、循环无抑制,不释放组胺,无成瘾性,对平滑肌和横纹肌无松弛作用[20],很少有耐药性。由于曲马多具有低阿片受体亲和力,因此降低了药物滥用的可能性和与其他药物发生相互作用的可能性。Keskin等对比观察了哌替啶和曲马多应用于分娩镇痛的效果:两组产妇分别肌肉注射哌替啶100 mg和曲马多100 mg,给药30和60 min时,曲马多组产妇的VAS评分略高于哌替啶组,但是曲马多组产妇的恶心、呕吐发生率低于哌替啶组,给药后两组产妇的血压下降、心率增快,与给药前相比具有统计学意义(P<0.05);两组产妇的产程以及新生儿阿普加评分无统计学差异,无新生儿窒息发生[21]。龙健晶等[22]采用先静脉注射负荷剂量曲马多1 mg/kg,然后连接静脉镇痛泵,采取患者自控静脉镇痛(PCIA)(0.75%曲马多,单次剂量2 mL,锁定时间10 min,背景剂量2 mL/h)。结果显示,曲马多静脉镇痛可以有效地缓解分娩时的疼痛,可以降低剖宫产率,但是潜在新生儿阿普加评分降低的风险。曲马多最常见的不良反应是恶心和眩晕,二者均发生于超过10%的患者;其次为胃肠道反应,最常见的皮肤异常情况为出汗,发生率为1%~10%。曲马多的不良反应可能是由其激动阿片受体作用引起(如恶心、呕吐、困倦、便秘、尿潴留等),或由5-羟色胺、去甲肾上腺素再摄取抑制作用引起(如头疼、眩晕、出汗、口干等)[23]。本例患者镇痛后循环稳定,有效地缓解了分娩疼痛,产妇未出现呼吸抑制,新生儿阿普加评分仍属于高评分。本例产妇发生的主要不良反应为出汗,但是未发生循环虚脱等严重不良反应。
(内容有略,具体见全文)
2.3 分娩镇痛时机的研究
传统观点认为,椎管内阻滞镇痛应待产妇进入活跃期(宫口开大3 cm至宫口开全)再开始,过早实施镇痛会使潜伏期延长、甚至停滞或增加剖宫产率等[24,25] 。根据上述说法,许多教科书和绝大多数医疗机构将分娩镇痛的时机选择在活跃期。但潜伏期(规律宫缩开始至宫口开大3 cm)长达8 h,占到第一产程2/3的时间,而且许多产妇的疼痛已经很明显,随着临床应用的不断拓展,研究工作的不断深入,国外更多先进的研究和文献认为,潜伏期镇痛可行[24-28],国内也有学者研究认为,潜伏期可以实施分娩镇痛[29]。潜伏期分娩镇痛是近年来研究的热点,上述中外学者就潜伏期镇痛对宫缩、产程、产力及对分娩转归的影响(尤其是对剖宫产率的影响)等方面做了深入的研究,认为潜伏期分娩镇痛安全可行。美国产科麻醉临床指南和中国产科麻醉专家共识均对潜伏期的分娩镇痛进行了肯定。
2.4 镇痛对分娩方式、胎心率和发热等的影响
药物性分娩镇痛几乎与现代麻醉学的发展同步,但硬膜外分娩镇痛只有短短的数十年历史,1979年Revil在首届欧洲产科会议上,提出并确认硬膜外阻滞是产科止痛最有效的方法。椎管内阻滞镇痛技术中外趋于一致,均认为不会增加剖宫产率,有众多文献均支持此观点。“突变理论 (catastrophe theory)”研究表明,在同一医疗单位突然大量实施硬膜外分娩镇痛,在此前后剖宫产率并没有显著变化。一项“突变理论”研究的荟萃分析纳入不同国家的3.7万名产妇,结果发现,在不同的产科条件,不同时期,并没有因为突然大量实施硬膜外分娩镇痛而使剖宫产率显著增加[30]。
但在阴道器械助产率方面,中外差异较大,国内文献几乎千篇一律地认为,椎管内阻滞镇痛不会增加器械助产率,国外文献表明,镇痛使器械助产率增加是较普遍的现象。随机研究的荟萃分析表明,硬膜外分娩镇痛可使阴道分娩的器械助产率成倍增加[31]。Sharma 等[32]研究表明,硬膜外分娩镇痛的阴道分娩器械助产率为12%,应用阿片类药物镇痛为3%。目前造成这种差异的原因尚不十分清楚,可能由子宫收缩性和产力减弱引起。冯丹等[33]研究表明,硬膜外分娩镇痛可使宫缩持续时间缩短、间期延长、宫缩时宫腔内压力降低。Arici等[34]研究表明,布比卡因和罗哌卡因可抑制大鼠离体子宫平滑肌的收缩性。此外,椎管内阻滞可能阻断肌梭的传入冲动而抑制腹肌和盆底肌的牵张反射,使腹肌和盆底肌肌力和肌张力减弱,从而使总产力有所减弱[35]。















