华人抗体协会2024年年会,将于2024年5月11日(周六)在美国马萨诸塞州剑桥市(Cambridge, MA)召开,年会主题为:
Beyond Borders: Advancements in Antibody-Based Therapeutics in Uncharted Territories,详情参见:
欢迎参加华人抗体协会2024年年会

经授权转载自微信公众号小药说药。
胃癌在癌症相关死亡率中排名第三,被认为是全世界最难治愈的癌症之一。在晚期或转移性胃癌或胃食管交界处(
GEJ
)腺癌患者中,中位总生存期(
mOS
)不超过10个月。虽然人类表皮生长因子受体2(
HER-2
)靶向治疗和免疫检查点抑制剂已经为特定人群带来福音,但在进展期胃癌中寻找其他靶点势在必行,claudin18.2(
CLDN18.2
)随之而来。
Claudins是一个蛋白质家族,其作用是维持控制细胞间分子交换的紧密连接。广泛分布于胃、胰腺和肺组织,可用于诊断和治疗。CLDN18.2亚型是一种胃特异性亚型,自从Sahin发现CLDN18.2是一种高度选择性的分子,并且只在癌细胞中广泛表达,它就成为一种理想的靶点。CLDN18.2通常埋藏在胃粘膜中,正常组织中的单克隆抗体基本上接触不到,恶性肿瘤的发生会导致紧密连接的破坏,使肿瘤细胞表面的CLDN18.2表位暴露出来,成为特定的靶点。因此,CLDN18.2赋予靶向治疗的特异性。最近发现在胰腺癌(
50%
)、食管癌和肺癌中的表达也显示了诊断和治疗其他肿瘤的潜力。
Claudins是一个组成紧密连接(
TJs
)的完整膜蛋白家族,TJs是主要的细胞间连接,充当通透性屏障,通过划分膜上下区域赋予上皮细胞极性。目前,哺乳动物claudin家族由27种蛋白质组成,许多选择性剪接claudin蛋白在各种组织中表达。
Claudins是四次跨膜蛋白,包括四个跨膜结构域(
TM1-4
)、细胞内N端和C末端以及两个细胞外环(
ECL1和ECL2
)。ECL1包含四条β链和一条胞外螺旋(
ECH
),ECL2包含一条β链和一个细胞表面暴露的部分跨膜结构域。
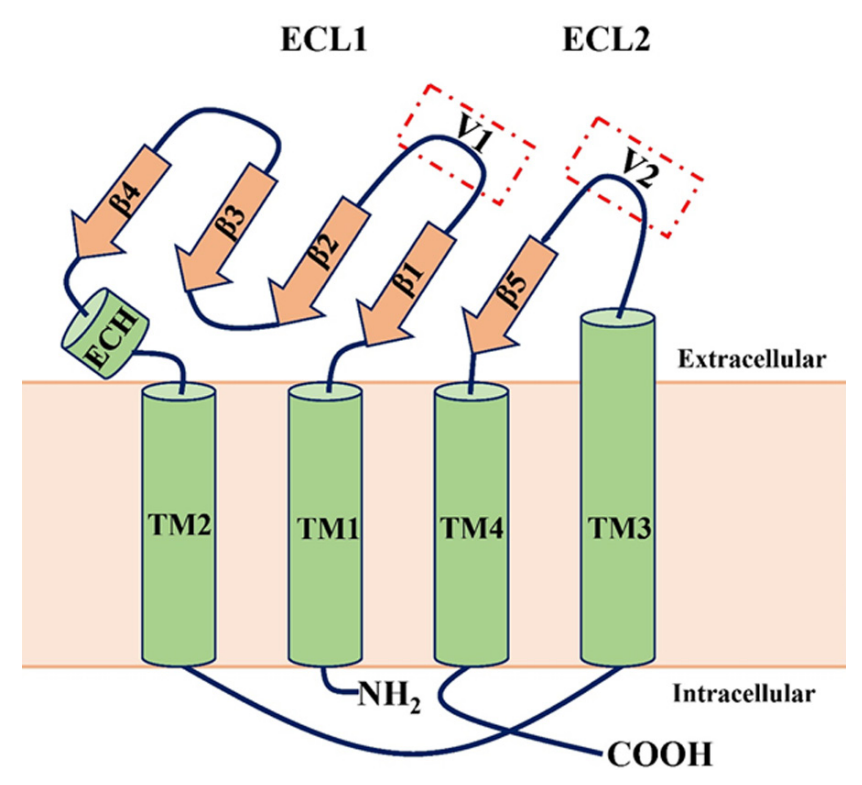
ECL参与claudin链之间相互作用的形成,并通过两个可变区域形成基于claudin的闸门功能。根据生理学研究,提出了两种闸门功能机制:“孔隙”机制,其中溶质或离子通过由TJ链形成的细胞旁通道,以及“泄漏”机制,溶质可能通过TJ链中的断裂。此外,通过与许多其他信号分子的相互作用,claudin主要作为抑制因子发挥作用,从而影响细胞生长、存活、增殖和分化。
包括
claudins
在内的紧密连接复合体被认为在致癌作用中具有抑制作用,类似于细胞粘附分子的肿瘤抑制功能。
CDH1
突变引起的钙粘蛋白表达不足已认为是肿瘤发生的机制之一。
大约
20-30%
的胃癌
claudin 18.2
表达下调或缺失,
claudin 18.2
的下调也被认为与癌细胞侵袭和增殖水平的增加有关。
然而,支持
claudin 18.2
下调与胃癌发生之间相关性的证据仍然有限。

除了claudin 18.2表达的变化外,在胃癌患者中还检测到涉及CLDN18的融合。在3%的胃癌患者和10%的扩散型胃癌患者中检测到CLDN18-ARHGAP融合基因。这些融合破坏了连接复合体,可能是由于C末端结构域的缺失以及由此导致的与肌动蛋白调节蛋白的相互作用的缺失,再加上ARHGAP的Rho-GTPase结构域的异位定位,这种破坏导致转化蛋白RHOA的下游失活,可能导致恶性转化。然而,目前仍然没有确凿的证据表明claudin
18.2的表达与致癌作用之间存在直接联系。
各种研究已经描述了
claudin 18.2
在胃癌中表达的临床病理特征和预后意义。
在
SPOTLIGHT
和
GLOW
试验中使用了
43-14A
抗
claudin 18
抗体识别
claudin 18.1
和
claudin 18.2
的
C
末端。
使用
43-14A
分析的样本的阳性标准被定义为
IHC
评分
>2+
和染色
≥
癌细胞表面积的
75%
。
在SPOTLIGHT和GLOW试验的联合分析中,38.4%的患者被认为患有claudin 18.2阳性肿瘤。当排除HER2阳性癌症患者时,这一百分比增加到42.3%。白人(
42.3%
)和亚裔(
36.4%
)患者的claudin
18.2阳性率存在统计学显著差异(
P = 0.0004
)。此外,根据对SPOTLIGHT和GLOW试验样本的生物标志物分析,中国大陆claudin 18.2阳性胃癌患者的百分比(
35.0%
)与北美(
37.7%
)相似,但低于欧洲和中东(
44.0%
)。claudin 18.2的表达与年龄或性别之间也存在统计学上显著的相关性。在≤65岁的患者(
40.9%
)中观察到的claudin
18.2阳性肿瘤比例高于>65岁的患者(
34.3%
),在≤75岁的患者中(
39.0%
)高于>75岁的患者(
30.9%
)。claudin 18.2阳性癌症的女性患者比例(
43.7%
)高于男性患者(
36.9%
)。在弥漫型组织学肿瘤中观察到claudin 18.2阳性的发生率(
48.3%
)高于肠型组织学(
38.8%
)。
值得注意的是,尽管已经报道了claudin 18.2状态与几个患者或临床特征之间具有统计学意义的相关性,但大多数组之间claudin 182阳性率的数字差异通常很小。
此外,胃癌和GEJ癌之间claudin 18.2阳性率没有一致性差异。
Claudin18.2阳性胃癌的基因组和免疫学特征
分子表征方法的进展揭示了胃癌独特的分子特征。在TCGA分析中,研究人员提出了四种分子亚型:EB病毒(
EBV
)阳性、微卫星不稳定(
MSI
)、基因组稳定(
GS
)和染色体不稳定(
CIN
)肿瘤。一项研究的结果表明,Claudin18.2在EBV阳性癌症中的阳性率仅为26%。关于claudin 18.2在其他TCGA癌症亚型中表达率的数据有限,claudin 18.2在20.8%的错配修复缺陷(dMMR)癌症中表达。其他研究报道了claudin 18.2阳性与MSI-H之间的有限关联,特别是对于具有高水平claudin 18.2-表达的肿瘤。
claudin 18.2的表达与其他生物标志物之间的关系也有研究。三项独立的回顾性研究分析了claudin 18.2和HER2的重叠表达,患者的重叠阳性率约为3.4%-4.9%。对SPOTLIGHT和GLOW数据的探索性分析表明,17.2%的claudin 18.2阳性进展期胃癌(
AGCs
)也是PD-L1阳性(
定义为CPS≥5
)。
此外,还评估了claudin 18.2阳性胃癌及其肿瘤微环境(
TME
)的免疫学特征。自然杀伤(
NK
)细胞计数减少和中性粒细胞计数升高是claudin 18.2阳性胃癌的普遍特征。转录分析还表明,TME中调节性CD4+T细胞、CD8+T细胞和髓系树突状细胞数量有限,B细胞水平升高,而巨噬细胞存在的数据在各研究中不一致。对80个癌症标本的多重IHC分析显示,在claudin 18.2阳性肿瘤中,不表达免疫检查点和/或其相关配体(
如PD-1、PD-L1、LAG3和TIM3
)的CD8+T细胞比例较高。这些发现表明,claudin 18.2阳性胃癌可能具有“冷”免疫表型,具有有限的免疫细胞浸润和免疫抑制性TME。
Cl
audin
18.2
作
为极具前景的肿瘤靶向治疗靶点,众多创新药企争相布局,成为必争之靶点高地。
目前为止,国际国内
20
多
家药企布局了
claudin 18.2
靶向药物的临床开发,大部分在研项目属于单靶点抗体药物,此外还包括
claudin 18.2
双抗药物、
ADC
和
CAR-T
等。

单克隆抗体
Zolbetuximab
(
IMAB362,claudixmab
)是第一种针对该靶点的开发药物,是一种嵌合的IgG1单克隆抗体,在肿瘤细胞表面与CLDN18.2特异结合,从而引发抗体依赖性细胞毒性(
ADCC
)、补体依赖性细胞毒性(
CDC
),凋亡和抑制细胞增殖。临床前研究已经成功地证实了它具有清除癌细胞和控制疾病的强大能力。随后,通过多个I/II期试验评估了其临床疗效和安全性。
第一项人体临床试验(
NCT00909025
)旨在确定剂量递增队列中Zolbetuximab的最大耐受剂量和推荐剂量,15名先前接受过治疗的进展期胃腺癌/GEJ腺癌患者进入评估。最后评估使用600 mg/m2的剂量为后续的推荐研究剂量。
IIa期临床试验(
NCT01197885,MONO
2013
)研究了其对54例难治性晚期或转移性CLDN18.2阳性胃腺癌患者的疗效和安全性。研究结果显示,中位无进展生存期(mPFS)提高到14.5周,受试者的平均响应时间延长至24.6周。10例患者获得临床改善,其中PR 4例(
9%
),SD 6例(
14%
),其中90%的患者CLDN18.2高表达。
2023年7月6日,根据SPOTLIGHT和GLOW的数据,美国食品药品监督管理局(
FDA
)授予Zolbetuximab优先审评地位,作为不可切除、局部晚期或转移、HER2阴性、claudin 18.2阳性胃癌或GEJ腺癌患者的一线治疗。此外,其它进入临床研究的单克隆抗体还包括
Osemitamab
(
TST001
)、
AB011、MIL93、ASKB589
和
ZL-1211
等。
双特异性抗体
Gresonitamab、ASP2138、AZD5863
和
QLS31905
都是设计用于结合claudin 18.2和CD3的双特异性抗体。Gresonitamab已在一项涉及AGC或PDAC患者的国际多中心I期研究中进行了测试(
NCT04260191
)。QLS31905在一项I期试验中进行了测试,该试验涉及经过大量预处理的晚期实体瘤患者,在接受剂量≥200μg/kg的27名患者中,ORR和DCR分别为11.1%和63.0%。在胃癌或GEJ癌患者中未观察到任何反应。测试ASP2138(
NCT05365581
)和AZD5863(
NCT06005493
)的I期研究正在进行中。
Q-1802
是一种靶向claudin
18.2和PD-L1的人源化双特异性抗体。Q-1802正在一项开放标签单臂I期试验中进行测试(
NCT04856150
)。剂量递增阶段已经完成,未检测到剂量限制毒性,最高可达20 mg/kg剂量。恶心(
62.1%
)、呕吐(
62.1%
)和腹痛(
27.6%
)是最常见的任何级别的不良事件。在剂量扩展队列的9名患者中,2名患者出现部分响应,4名患者疾病稳定。
PT886
是一种针对claudin
18.2和CD47的新型双特异性抗体。该药物正在一项开放标签的I期试验中进行测试,该试验涉及晚期胃癌和GEJ腺癌或PDAC患者。
Givastomig
(
TJ-CD4B/ABL111
)是一种创新的双特异性抗体,同时靶向claudin 18.2和4-1BB。Givastomig目前正在美国和中国的中心进行一期试验(
NCT04900818
)。这项研究的初步数据表明,有三名患者(
16.6%
)出现部分反应。常见的毒性包括1-2级恶心(
22%
)、疲劳(
14%
)和呕吐(
12%
),共报告了7起3级事件。
CAR-T细胞
CT041
是靶向claudin
18.2的第二代CAR-T细胞产品,包含CD8α铰链区、CD28共刺激结构域和CD3ζ信号结构域。临床前数据表明,在小鼠异种移植物模型中,具有强大的抗肿瘤活性,不会对非恶性胃组织或其他器官造成明显损伤。在一项I期研究中,CT041在转移性claudin
18.2阳性的胃腺癌或胰腺癌患者中显示出相当大的潜力(
ORR 33.3%,中位PFS 130天
)。在第二阶段试验中,所有癌症患者的ORR为48.6%,胃癌为57.1%;DCR所有癌症为73.0%,胃癌为75.0%。
其他几种claudin 18.2靶向CAR
T细胞疗法目前正在早期研究中进行测试,包括配备有4-1BB共刺激结构域的第二代CAR
LB1908
以及第四代CAR-T,第四代的两种细胞都被设计为分泌特异性细胞因子和趋化因子
RD07
(
NCT05284968
)和
CT048
(
NCT05393986
)。
ADC
SYSA1801
(
EO3021
)是一种特异性靶向claudin 18.2的ADC,其使用药物抗体比(
DAR
)约为2的MMAE有效载荷。在一项正在进行的I期试验中,33名晚期、重度预处理的claudin
18.2阳性胃癌或胰腺癌患者接受了SYSA1801单药治疗。在21名可评估疗效的患者中,观察到ORR为38.1%,DCR为57.1%,AGC患者的ORR和DCR分别增加到47.1%和64.7%。大多数接受的患者出现恶心和呕吐,≥3级的反应为42.9%和28.6%。33名患者中有7名(
21.2%
)出现干眼症,这也被认为与治疗有关。
CMG901
(
AZD0901
)是以一种人源化IgG1抗claudin 18.2抗体,该抗体通过DAR约为4的可裂解连接子与MMAE有效载荷偶联。CMG901显示出强大的临床前活性。在包含113名晚期、预处理的GEJ或胃癌患者的I期临床试验中,ORR为42%,最常见的不良反应为贫血和中性粒细胞计数减少。
此外,其他大多数ADC仍处于早期临床测试中,包括
TPX-4589/LM-302
(
NCT05001516、NCT05934331
)、
RC118
(
NCT04914117、NCT05205850
)、
SKB315
(
NCT05367635
)、
SOT102
(
NCT05525286
)、
TORL-2-307-ADC
(
NCT05156866
)和
JS107
(
NCT05502393
)。
其它疗法













