1975年,Kohler和Milstein将小鼠的骨髓瘤细胞和脾细胞进行融合,得到了既可分泌抗体又可无限增殖的杂交瘤细胞,单克隆抗体杂交瘤技术得以建立。十一年后,FDA批准了第一个治疗性单抗药物Muromonab-CD3(Orthoclone OKT3,Ortho Biotech),用于治疗器官移植时的免疫排斥。然而,初期的单克隆抗体药物由于来源于小鼠,在人体内有较大的免疫原性,例如Muromonab-CD3就已于2010年退市。渐渐地,在鼠源抗体的基础上,经历了人鼠嵌合抗体、人源化抗体和全人源抗体这一改良过程。其中,目前生产全人源抗体的两个平台一是噬菌体展示,二是转基因小鼠(图1)。
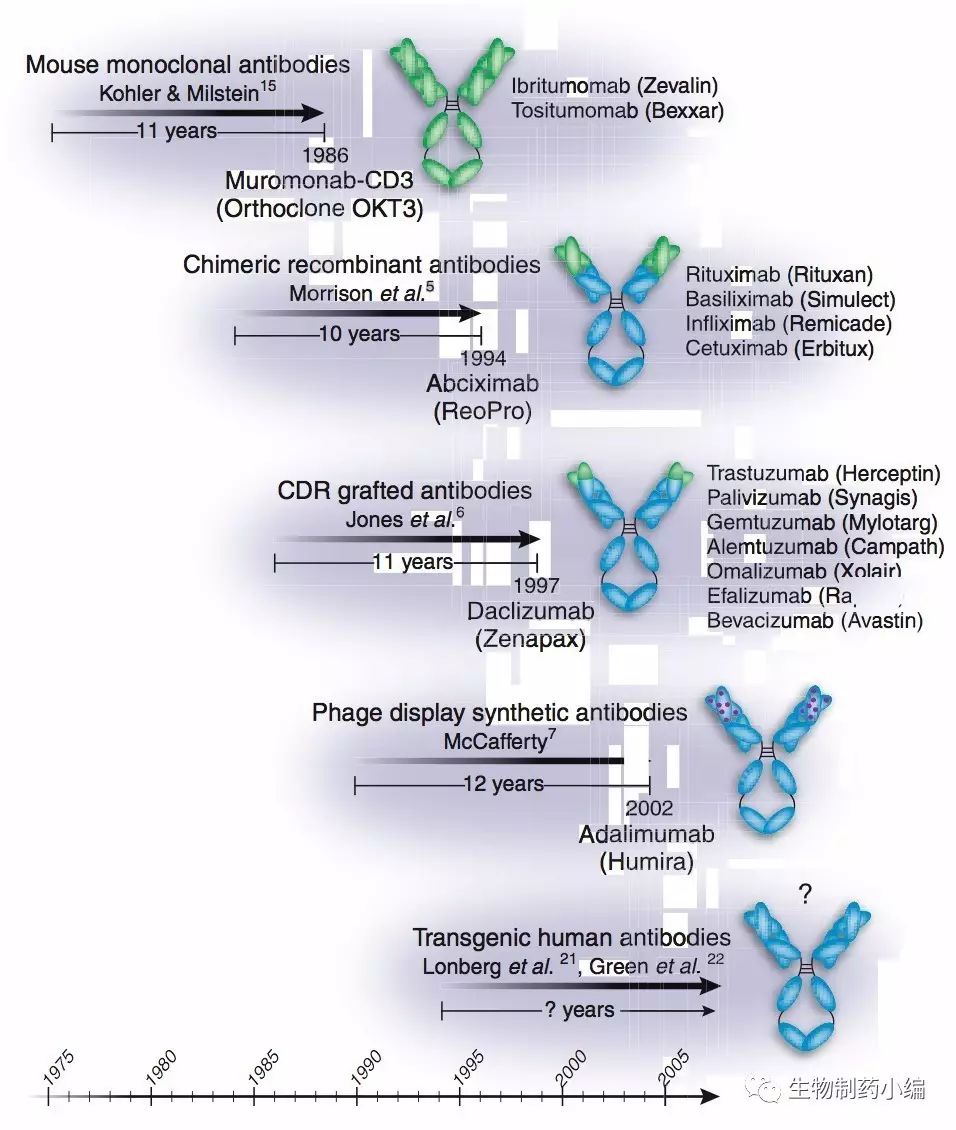
图1. 治疗性单抗技术的演变和临床进展
早在1985年,Alt等人就曾提出可以应用转基因技术得到具有人源序列的单克隆抗体。1989年,Bruggemann等人在小鼠中表达了人源重链,从而产生了转基因编码的免疫应答。而在1994年,Lonberg和Jakobovits的团队分别采用了不同的方法构建了能够表达人源抗体的转基因小鼠。Lonberg利用了核内显微注射的方法,而Jakovovits用的是酵母人工染色体(YAC)的方法。重链包含3个重链可变区(VH),16个D,所有的6个JH区。
Abgenix的XenoMouse®是第一个同时有大部分人源VH和人源Vκrepertoire的转基因小鼠品系。这些XenoMouse®小鼠有百万碱基对大小的酵母人工染色体,在重链基因座,有34个有功能的VH基因,全部的DH和JH区域,作为Cμ和Cδ功能下游的人源Cγ2基因;κ轻链基因座含有18个Vκ基因,全部五个功能性的Jκ区,和Cκ基因。由于YAC可以整合到小鼠染色体中,这样得到的小鼠具有较好的基因稳定性(图2)。2005年,安进以22亿美元收购Abgenix。XenoMouse平台上开发出的第一个单抗药物是Abgenix和安进共同开发的抗EGFR单抗panitumumab(于2006.9被FDA批准),这也是基于转基因小鼠的第一个全人源单抗药物。
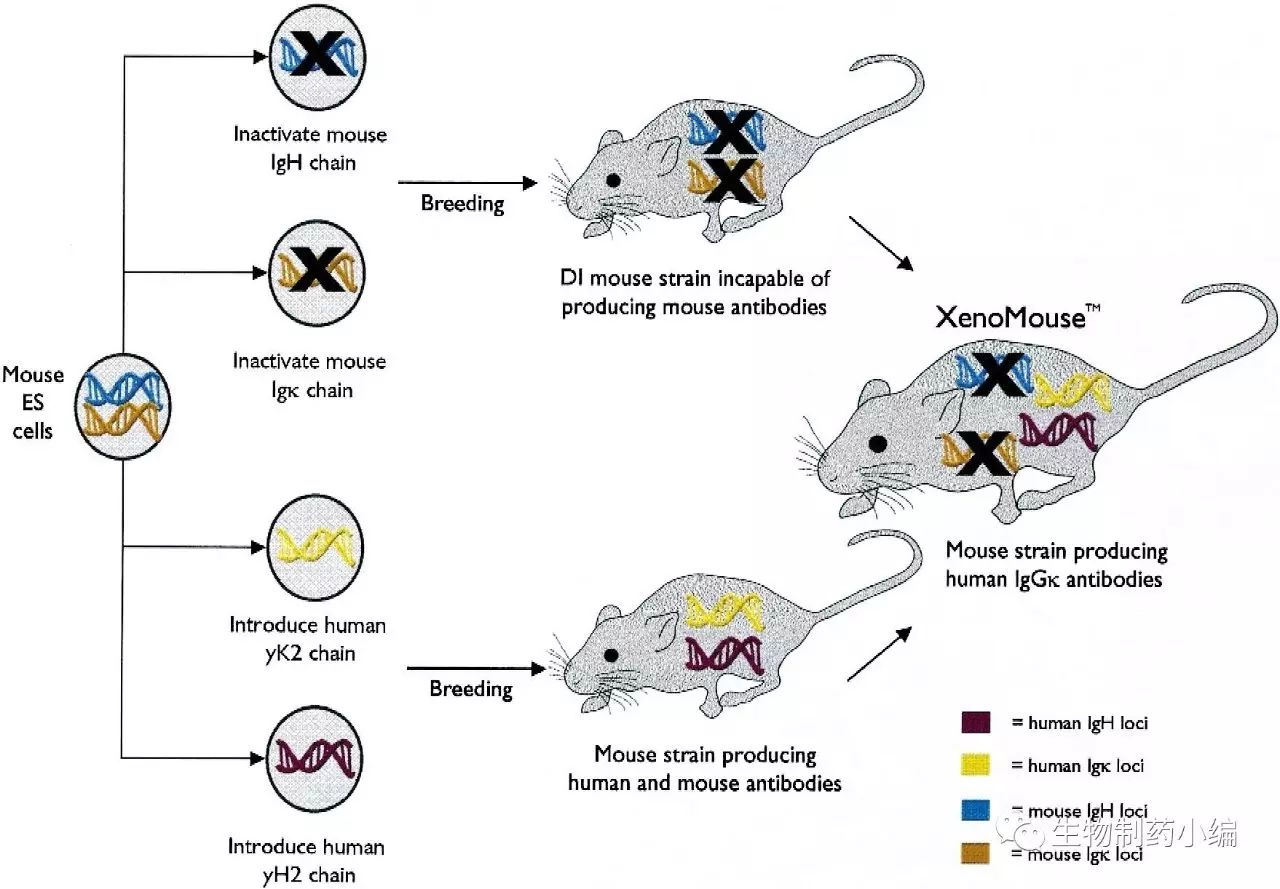
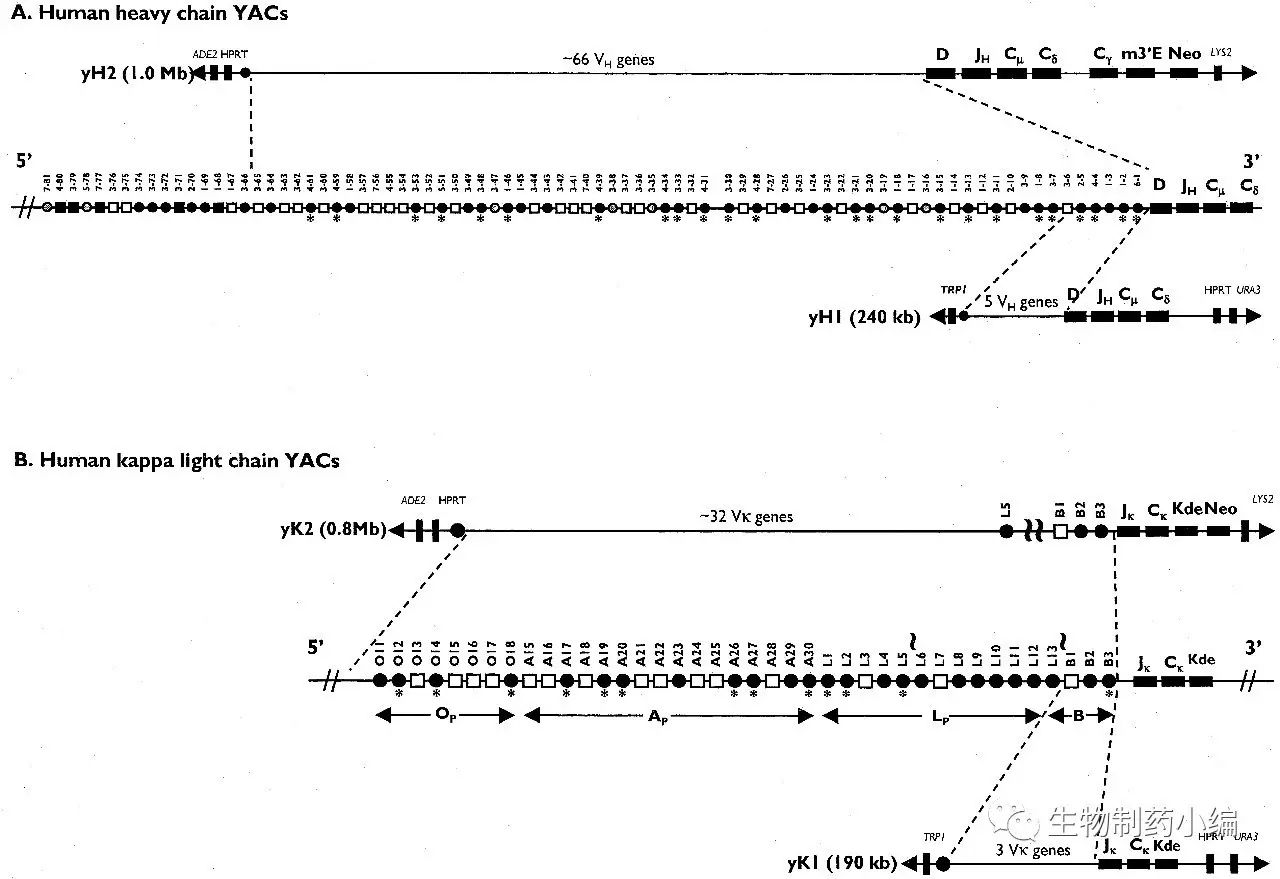
图2. XenoMouse的基因编辑策略
另一个用于产生全人源抗体的小鼠是GenPharm International, Inc开发的HuMab™或者叫Ultimab®。1997年,Medarex收购了该公司获得这一技术平台。2009年,BMS以24亿美元收购Medarex,将Humab小鼠收入囊中。这一平台可产生高亲和力(纳摩到亚纳摩级别)的人源抗体。Ofatumumab是基于Ultimab平台开发出的抗CD20单抗,它和同为CD20抗体的rituximab靶向的表位不同。Ofatumumab于2009年十月被FDA批准用于治疗慢性淋巴细胞白血病。Ultimab平台还有一系列诸如Canakinumab(抗interleukin-1β的IgG1单抗,用于治疗一种罕见的自身炎症性疾病Cryopyrin蛋白相关周期性综合征), Ustekinumab(靶向IL-12和IL-23所共有的p40亚单位,用于18岁及以上活动性银屑病关节炎患者的治疗)等单抗产生。
这之后,Kyowa Hakko Kirin通过人工染色体技术构建了包含失活的小鼠免疫球蛋白基因和编码人IgG1-4, IgA1-2,IgD,IgM和IgE的KM小鼠。
后来,还出现了Regeneron的VelocImmuneMouse,Harbour Antibodies的HarbourMouse等其它可以产生全人源抗体的小鼠品系。我们国内也有自己的CM Mouse。
尽管由于B细胞数量的原因,早期的小鼠品系在抗体滴度,多样性和高突变性等方面无法和野生型小鼠相比,这些小鼠仍然在抗体药物研发中发挥了巨大的作用。
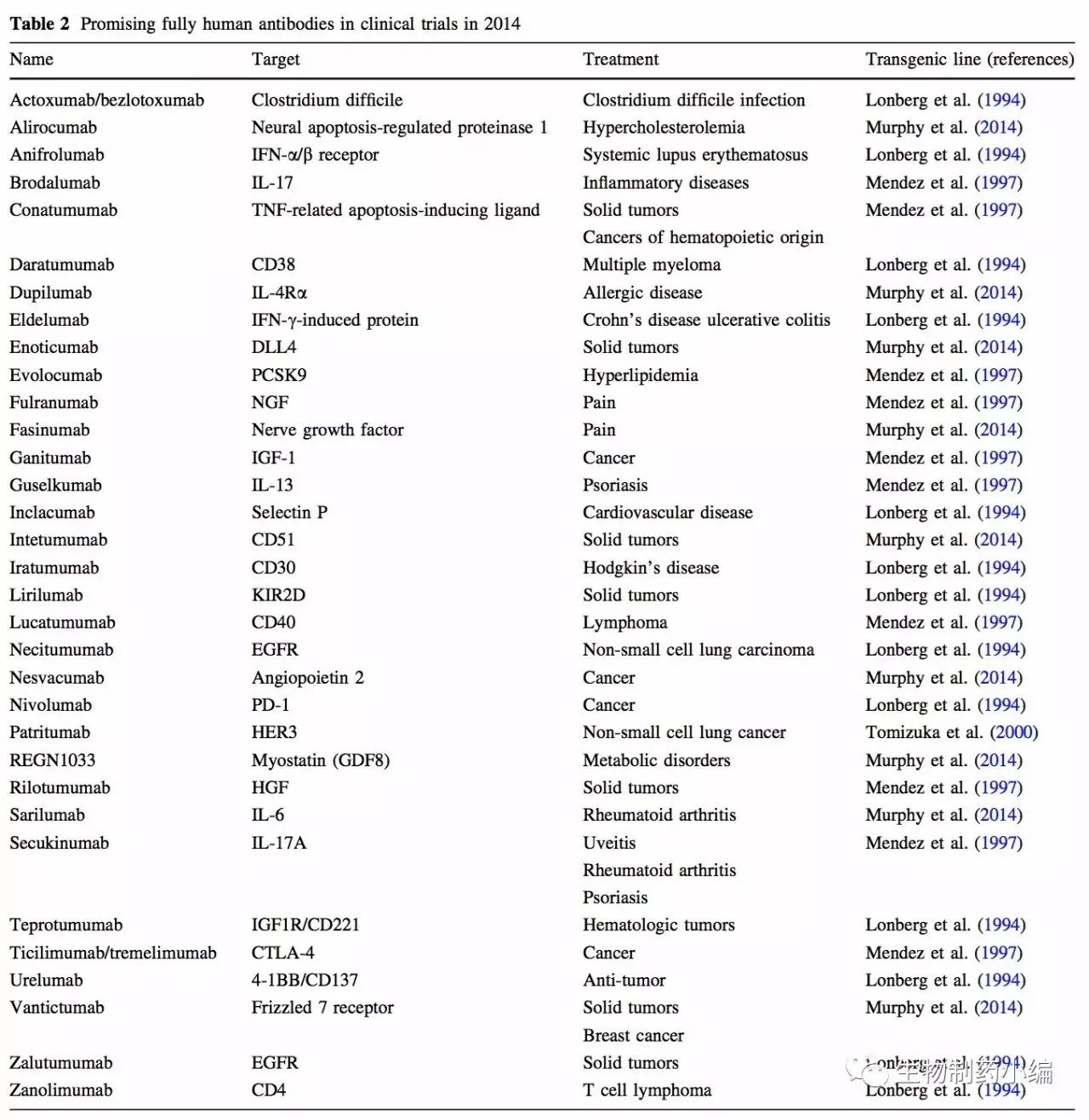
下面的表一中列出了FDA批准的在早期的小鼠品系中得到的全人源单抗。
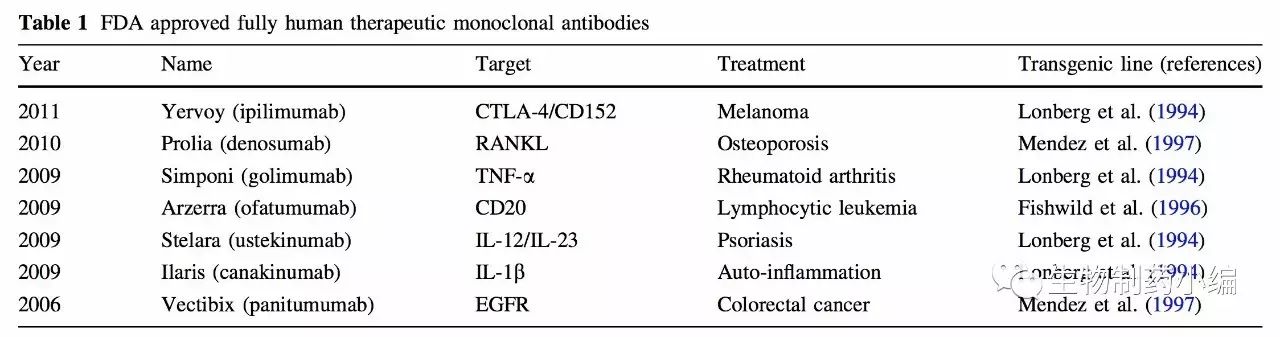
为了克服早期品系中的这些缺陷,人们不断构建出新的小鼠品系。
截至2014年,大量全人源抗体已经或者正在被临床试验评估。表二中列举了部分当时处于临床阶段的从转基因动物中得到的抗体。当时这些抗体主要来自四种不同的小鼠品系:HuMAb antibody或UltiMAb antibody Mouse (Lonberg et al. 1994), Xeno-Mouse (Mendez et al. 1997), TransChromo Mouse (Ishida et al. 2002)和VelocImmune Mouse (Murphy et al. 2014).
三.全人源Heavy chain only antibody(HCAb)和转基因小鼠
一些物种会产生HCAbs(图3a),最有名的HCAbs就是骆驼产生的IgG2和IgG3型的HCAbs。人们发现HCAbs可以识别一些特殊的抗原表位,例如抗原表面的缝隙。它的抗原结合位点,单个可变区(VHH),和传统抗体的VH区很相像。然而,FR2和CDR3区的不同阻止了VHH和轻链可变区配对。HCAbs一般缺失CH1区。缺失CH1区对于HCAbs的分泌很重要,因为CH1区会和分子伴侣结合从而使得完整的重链滞留。
2006年,Rick Janssens等人构建了可产生HCAb的转基因小鼠。他们用人的VH区替换了骆驼的VHH区,所以这些小鼠在免疫后可产生有功能的人源HCAb。和在骆驼内一样,这些小鼠产生的HCAb缺失CH1区。
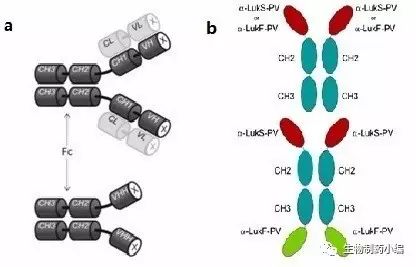
图3. HCAb的结构(a)和双特异性HCAb(b)
相比经典的单抗结构,HCAbs可以识别一些酶活位点等更“困难”的表位。而人们接着也构建出产生一些HCAbs变体的抗体结构的转基因小鼠,例如能产生双特异性人源HCAb的小鼠(图3b),在这些四价双特异性抗体中,特异性和结合亲和力都被保留了下来,而且不论是二价的HCAb还是四价的HCAb,在体外都有着很好的稳定性。同时,更小的分子量使得这些抗体的大规模生产变得更容易。
基于转基因小鼠生产出的这些新结构抗体为我们的抗体药物研发打开了更多的门。
我们知道,嵌合抗体相对于鼠抗,在免疫原性上具有明显优势。然而,由于检测免疫原性所用分析方法灵敏度的不同,以及每个药物实验在患者人群、给药方式、给药频率和剂量等各个因素方面的不同,我们还无法断言全人源小鼠在免疫原性方面是否具有压倒性优势。
References:
1. Human antibodies from transgenic animals. Nature biotechnology. 2005.
2. Antibody discovery: the use of transgenic mice to generate human monoclonal antibodies for therapeutics. Pharmaceutical biotechnology. 2002.
3. Antibody engineering via genetic engineering of the mouse: XenoMouse strains are a vehicle for the facile generation of therapeutic human monoclonalantibodies. Journal of Immunological Methods. 1999.
4. Human antibody production in transgenic animals. Arch. Immunol. Ther. Exp.2015.
5. Mouse platforms jostle for slice of humanized antibody market. NatureBiotechnology. 2013.
6. Generation of heavey-chain-only antibodies in mice. PNAS. 2006.
7. Heavy chain-only antibodies and tetravalent bispecific antibody neutralizing Staphylococcus aurexs leukotoxins. PNAS. 2011.
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。
















