大家好!今天我们来介绍一篇关于免疫治疗的综述,该文章发表在Nat Rev Clin Oncol,题目为“Enhancing immunotherapy in cancer by targeting emerging immunomodulatory pathways”,靶向CTLA4、PD-1和PD-L1的免疫检查点抑制剂(ICIs)的发现和临床应用彻底改变了癌症的治疗,这一突破性的新方法改善了各种晚期癌症患者的预后。然而,接受这些治疗的大多数患者,即使采用联合治疗的方法,也不能临床获益。因此,进一步开发靶向控制T细胞功能的额外免疫检查点的药物至关重要。
本文
主要介绍
了靶向共刺激和共抑制
T细胞受体的药物的潜力和临床发展
,仍
需进一步优化联合
ICI治疗的时机,根据患者特异性和肿瘤特异性特征进行个体化免疫治疗
。

免疫检查点抑制剂(ICIs)的免疫疗法在过去的十年中使各种类型癌症的治疗取得了飞跃式的进步。一个多世纪以来,基于免疫的治疗方法小有成效,其中免疫检查点特异性抑制剂的识别和开发起着关键作用。随着FDA批准数量和范围的增加,美国有资格接受ICIs治疗的癌症患者比例从2011年的1.54%增加到2018年的43.63%。然而,预计这些患者中只有12.46%对ICIs疗法有效果,而且即使在已获得FDA批准的抗PD-1或抗PD-L1抗体的癌症中,患者的临床获益程度也有很大差异。此外在不同癌症类型之间和个体患者之间,获益也存在
高
度可变性。因此,在抗CTLA4、抗PD-1或抗PD-L1抗体的基础上扩大基于ICI的治疗方法显然是一个尚未满足的临床需求。对ICIs的耐药与肿瘤的潜在免疫学特征有关,肿瘤通常分为“热”(炎症)或“冷”(非炎症)表型,炎症性肿瘤的特征是肿瘤微环境中存在淋巴细胞,特别是大量存在肿瘤浸润淋巴细胞(TILs)。因此,研究人员在将冷肿瘤转变为热肿瘤的方法上做出了相当大的努力,这些方法包括扩增和激活肿瘤相关抗原特异性细胞,以及通过对抗肿瘤固有的免疫逃避机制来促进肿瘤内T细胞浸润的增强。此外,将多种类型的溶瘤病毒与ICIs联合使用的多项后期试验目前正在进行中。尽管将现有的ICIs与其他疗法相结合已经取得了较大的成功,但缓解率仍然有限,因此仍需要扩充现有的药物种类,这些药物可以通过调节共刺激或共抑制受体来促进抗癌免疫。本文描述了靶向共刺激和共抑制受体以及在T细胞代谢中发挥作用的其他靶点的新型药物的发展。
具有潜在抗肿瘤活性的
T细胞
是由
初始
T细胞前体发
育
而来
,
T细胞受体(TCR)的结合和共刺激对T细胞的成熟和活化都是必需的。
初始
T细胞启动过程需要TCR与树突状细胞上以MHCs复合物形式呈现呈的同源肽结合,然后进行克隆扩增和激活。启动是初始T细胞发育为效应T细胞的重要步骤
,
这一过程
包含多个步骤,
抗原呈递细胞
(APC)通过吞噬或胞饮作用摄取和处理抗原,并将经过处理得到的含有抗原决定簇的多肽片段与MHC复合体结合,然后表达于细胞表面递呈给CD4+细胞
。
CD4+细胞上的CD28共刺激受体与CD80或CD86结合导致
细胞
增殖
,
需要更多的信号来扩展和保持活跃
的
状态
(Fig.1)。
T细胞
激活
时也可能发生重要的代谢变化
,
为了
维持
整体能量
的
消耗,
需要
氧糖酵解、氧化磷酸化和谷氨酰胺分解,以及
促进
对葡萄糖或氨基酸等营养物质的摄取
。
共刺激信号通路在
T细胞
激活
、分化、效应功能与
生存中
起着至关重要的作用。因此,重新激活
T细胞
免疫
应答的一种有前景的治疗策略包括共刺激受体激活。大多数共刺激受体是肿瘤坏死因子受体超家族
(TNFRSF)或免疫球蛋白超家族(IgSF)的成员。TNFRSF中的重要共刺激受体包括糖皮质激素诱导的TNF受体家族相关蛋白(GITR)、OX40和4-1BB, IgSF中的重要共刺激受体包括CD28和可诱导性共刺激分子(ICOS)
。此外,
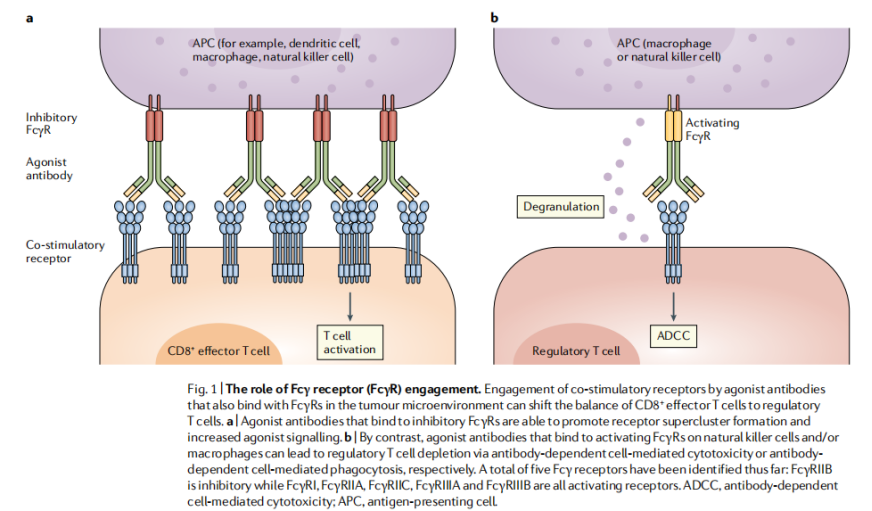
激活
Fcγ受体(FcγR)
介导了共刺激受体的交联和聚集
,
激活性
FcγR与抗体结合,可激活介导抗体依赖性的细胞毒作用(ADCC)
,
抑制性
FcγR会驱动单抗介导的聚集并增强靶细胞中的受体正向信号
,
这凸显了与
FcγR结合的重要性(
Fig.
1)
。虽然
单药治疗的临床获益有限
,但是
使用旨在激活这些共刺激受体的抗体进行的临床试验已显示出药效学活性和免疫调节作用。许多潜在的共刺激靶点已经被确定,尽管以前的经验清楚地表明,药物开发,而不是靶点发现,是该领域的限速步骤。因此
.本文重点
讨论了共同刺激靶点,如
GITR, OX40, 4-1BB和ICOS,这些靶点在临床前和临床研究中是最先进的
。
来自
TCR的激活信号和持续的共刺激信号对于最佳的T细胞激活和增殖是必需的。然而,TCR和共刺激分子的慢性激活可能导致效应T细胞功能受损,从而导致抗肿瘤活性减弱,这
种
T细胞功能失调
的
状态被
称
为耗竭。因此,优化用于激活
T细胞共刺激受体的治疗药物的选择和剂量是避免T细胞耗竭的关键。
肿瘤微环境
(TME)包括一个复杂的代谢通路网络,不仅提供肿瘤细胞生存和生长所需的营养物质,而且还提供改变免疫浸润成分、免疫细胞分化和效应细胞功能的代谢产物
。
葡萄糖代谢长期以来被认为是
T细胞激活的必要条件。
通过
对涵盖
7种癌症的900个临床数据集分析表明,在不同癌症类型中,只有几种代谢物水平发生
的
改变
相一致
,并且能够产生抑制作用
。
此外,研究表明,葡萄糖与乳酸的比例可能会改变
Treg细胞对CTLA4抑制的敏感性,因此糖酵解抑制
将
导致
TME中葡萄糖的利用增加,从而最大限度地减少Treg细胞的不稳定。肿瘤内的Treg细胞能够在高乳酸环境中生长并维持其免疫抑制活
,表明
Treg细胞在不同组织状态下代谢的异质性。因此,开发靶向免疫抑制性代谢物生成相关信号通路的治疗药物
越来越受到人们的关注
。共刺激和共抑制受体及其相关代谢途径之间存在复杂的相互作用,
会
对抗肿瘤免疫产生影响。在调节共刺激或共抑制受体的情况下,调节
T细胞代谢如何影响免疫功能,以及如何调节这些过程
以实现临床效益
仍有待
研究证实。















