
心脏病、心肌梗死等心脏系统疾病是目前全球瞩目的疾病。我们知道,由于心肌细胞(CM,cardiomyocyte)的有丝分裂后的特性,成年哺乳动物的心脏是无法再生的,这就导致了心脏系统疾病的不可逆性,使其成为了极为棘手的医学问题。
近日刚刚发表于《Nature》的一篇论文针对心肌细胞无法再生的问题进行了研究,该研究团队发现了一种胞外基质(ECM,extracellular matrix)蛋白能够大幅提升心肌细胞再生的效果,他们命名这种蛋白为Agrin。
低等脊椎动物中,例如蝾螈和斑马鱼,他们的心肌细胞增殖以及心肌细胞再生功能都极为强大,但较为高等的哺乳动物却反而缺乏这种能力。有趣的是新生的小鼠的心脏在其生命的第一周也具有极强的再生能力。
该研究展示了在这一周内,小鼠ECM的组成变化是如何影响心肌细胞的生长和分化的。
首先,为了研究ECM在心脏再生中的作用,科学家们调查了在小鼠出生后ECM对于CM的再生影响。 P1和P7是通过去细胞化产生的无细胞ECM片段(扩展数据图1a,b)。在体外只处理P1,ECM片段同时提升了P1和P7的CM细胞周期活性(图1a-d)。同时使用广泛的MMP抑制剂(Marimastat)导致CM由P1的ECM引起的CM增殖下降(图1e,f)。
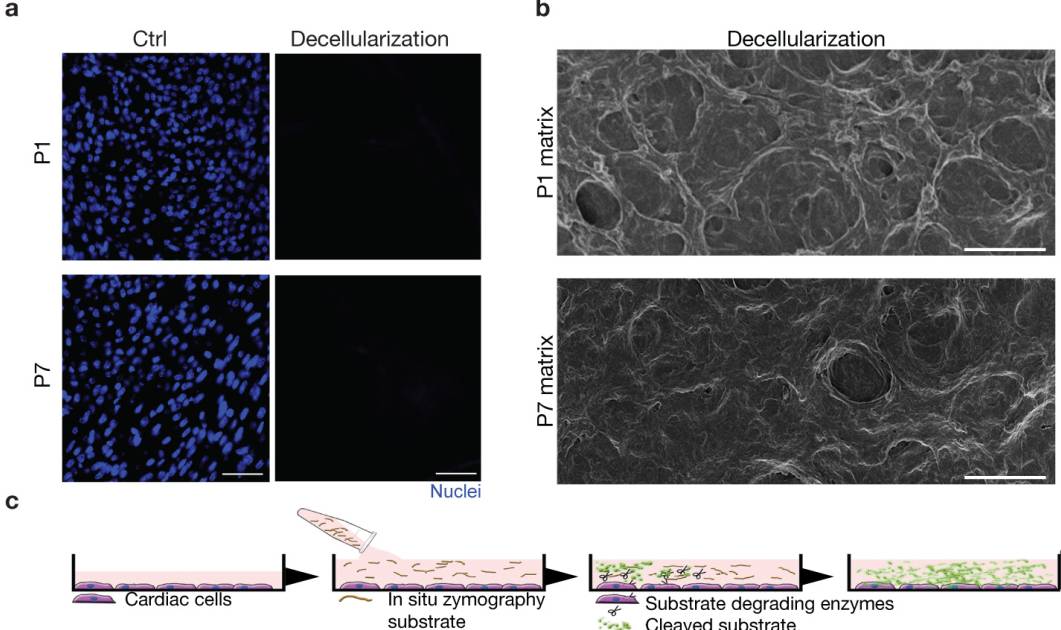

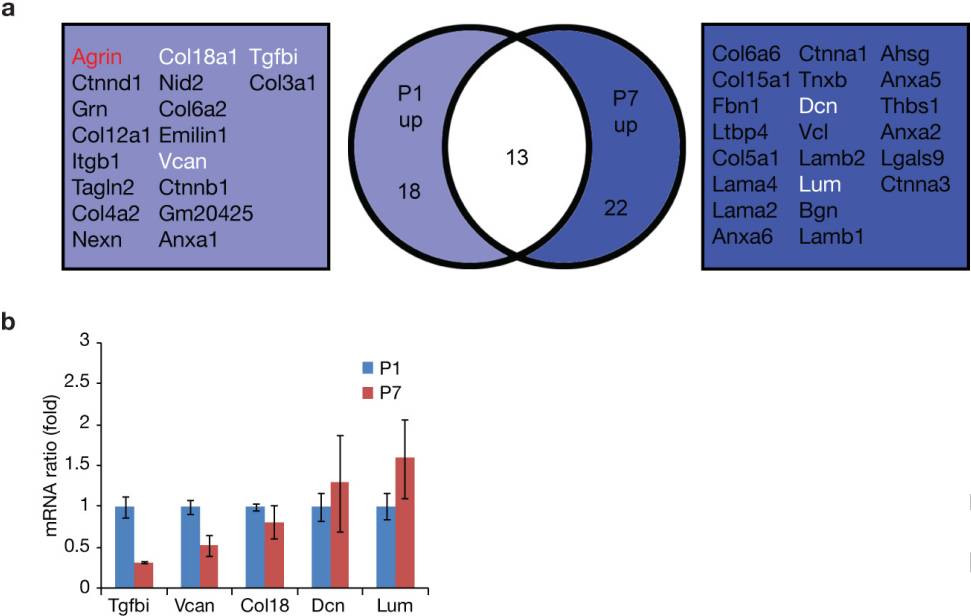
原位酶谱法测定底物裂解特异性的实验表明MMP2/9与心肌细胞再生有关(图1c-e)。实际上,MMP9的裂解在条件培养基中诱导P1或P7的CM增殖(图1g,h)。质谱测定法(LC / MS)分析显示,相对于P7的ECM片段,Agrin在MMP9裂解的P1中含量极为丰富(扩展数据图2a)。此外,科学家们鉴定出了Tgfbi,它是骨膜蛋白的旁系同源物。随后通过qRT-PCR验证了P1和P7的基因表达水平(扩展数据图2b)。这些结果均阐明了用于体外鉴定促进CM增殖的ECM相关分子的新方法的效果。
扩展数据图2a-b
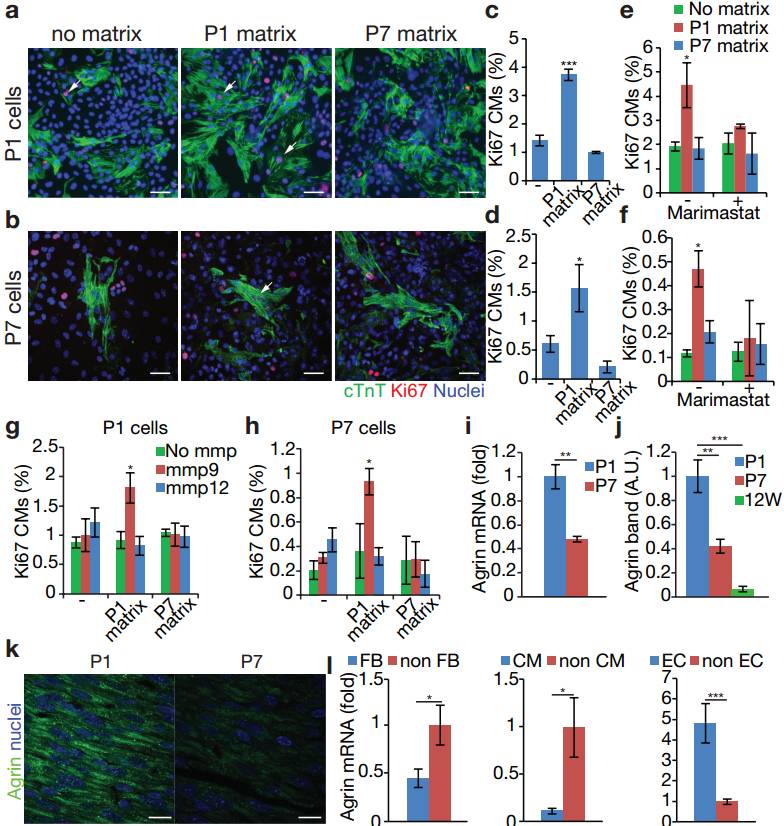 图1a-k
图1a-k
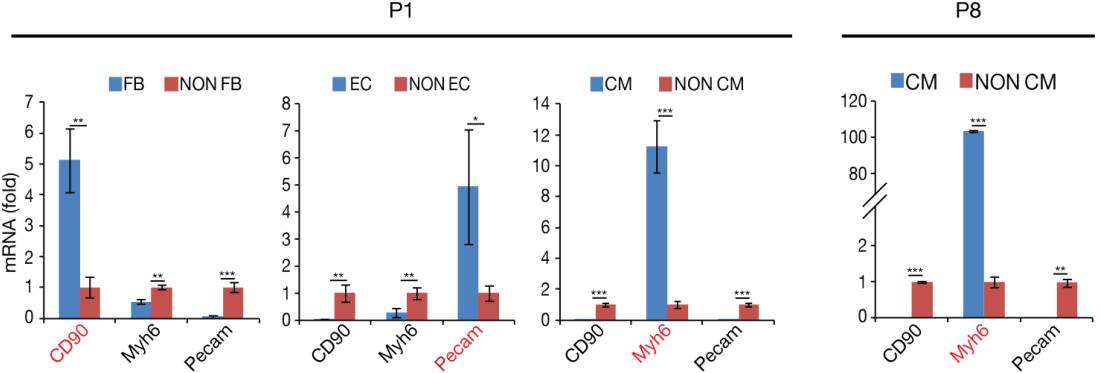
接下来,科学家们进一步证明了Agrin表达与内皮细胞并且能够在体外提升CM增殖效率。图1i-k通过对成人心脏进行RNA、Western blot和免疫荧光分析,展示了在P1和P7之间Agrin的表达的下调。心脏内皮细胞(EC)的P1 Agrin mRNA的表达明显多于成纤维细胞(FB)和CM(图1l,扩展数据图3)。扩展数据图4a-d这些结果表明,Agrin可以在体外刺激CM增殖。
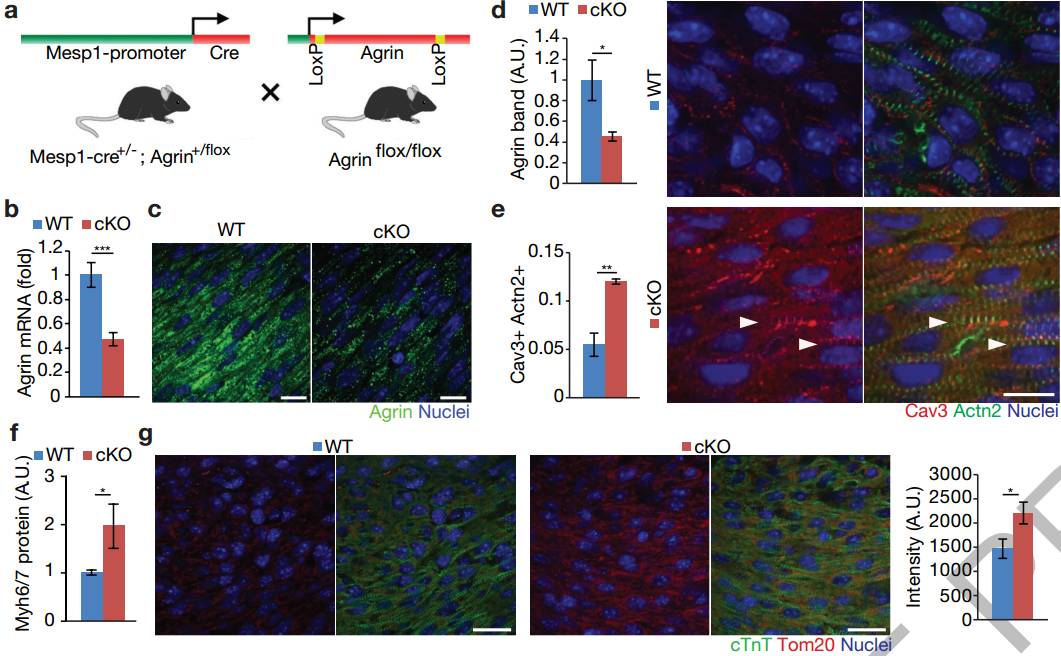
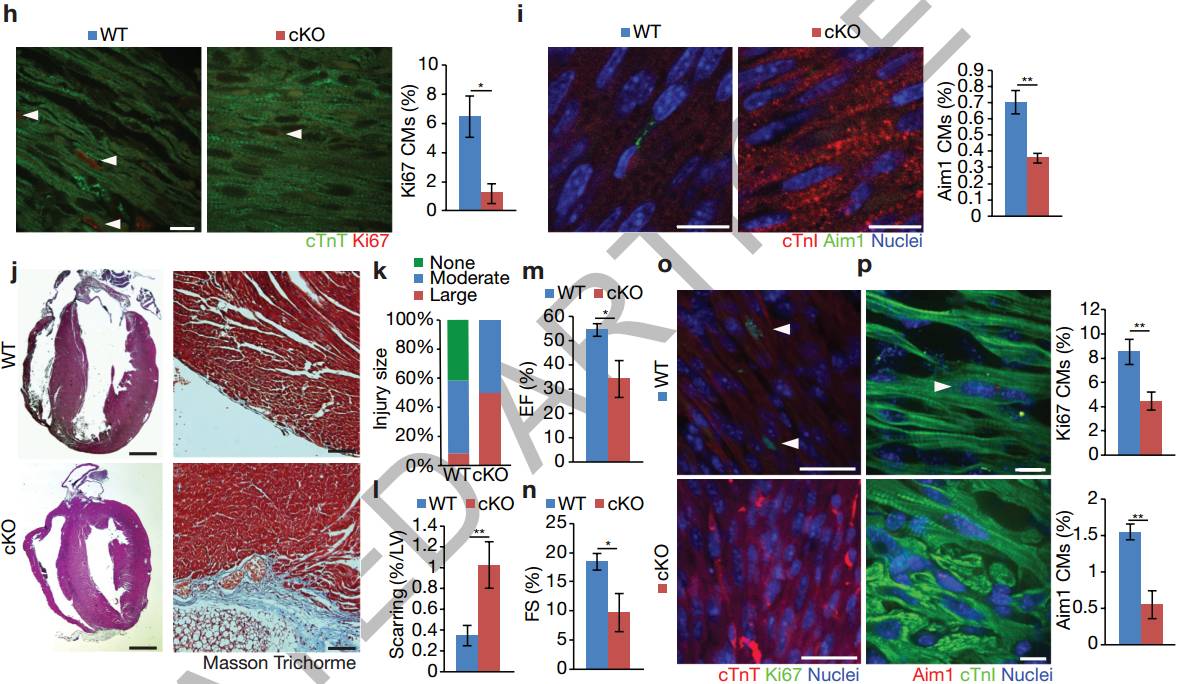
图2a-p
扩展数据图3

扩展数据图4
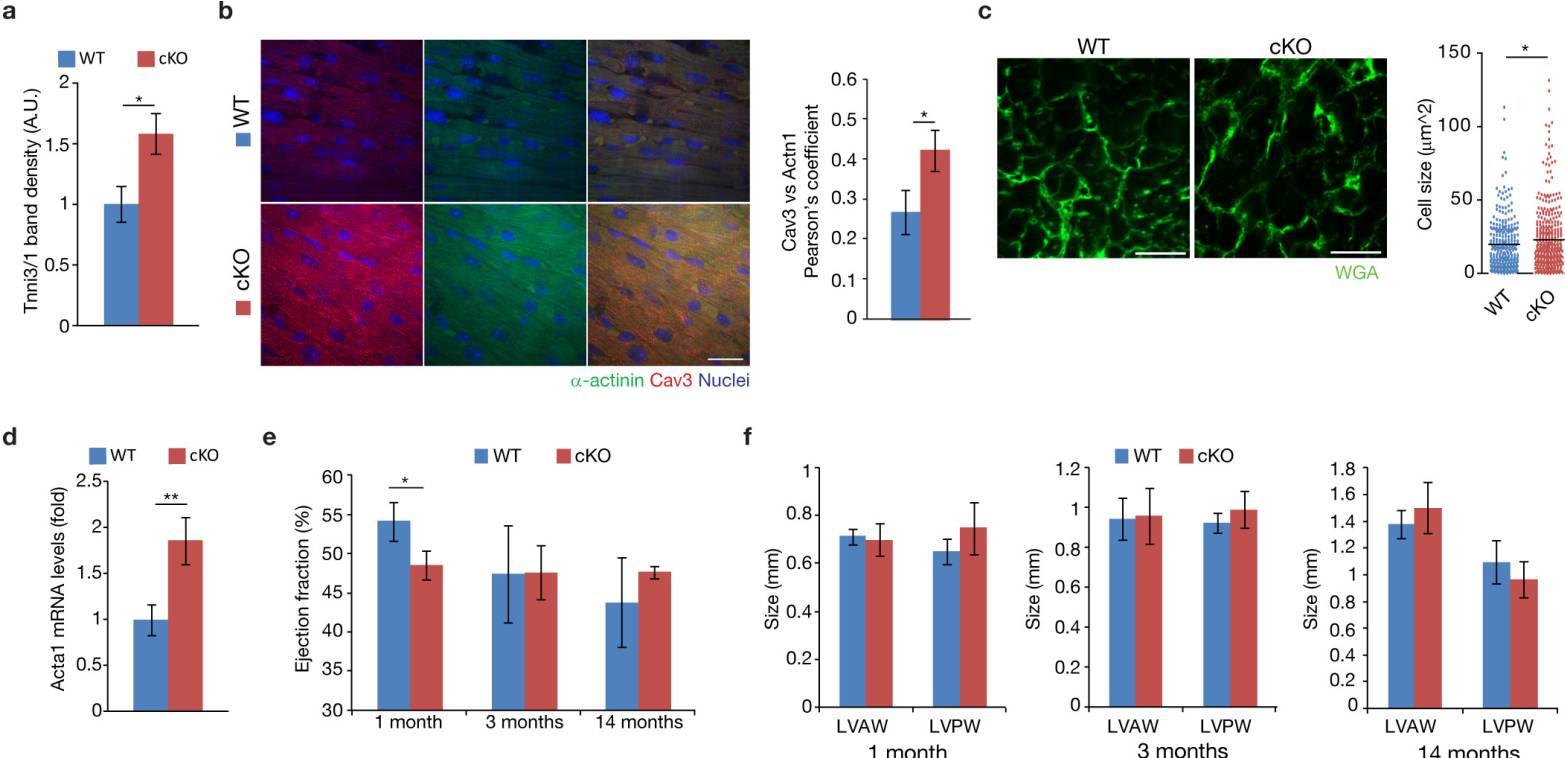
为避免围产期致死的Agrin无效突变体的干扰,科学家们通过将MesP1Cre+/-、Agrnflox/+小鼠与Agrnflox/flox(Agrin-cKO)小鼠杂交来有条件的删除心脏中的Agrn(图2a)。Agrin的蛋白和mRNA的表达分析证实等位基因已被删除(图2b-d)。 Agrin-cKO CMs表现出更为成熟的肌动蛋白结构并增强肌节的α-辅肌动蛋白和Cav3、T小管标记物的共定位(图2e)。同样,Myh6/Myh7的量化比例(图2f)和染色线粒体标记物Tom20(图2g)均显着升高。P1 Agrin-cKO心脏部分显示CM细胞周期活性下降(图2h,i)。结果表明Agrin在新生儿阶段抑制CM成熟(P1-P14,图2e-g,扩展数据图5a,b)。
 扩展数据图5a-k
扩展数据图5a-k
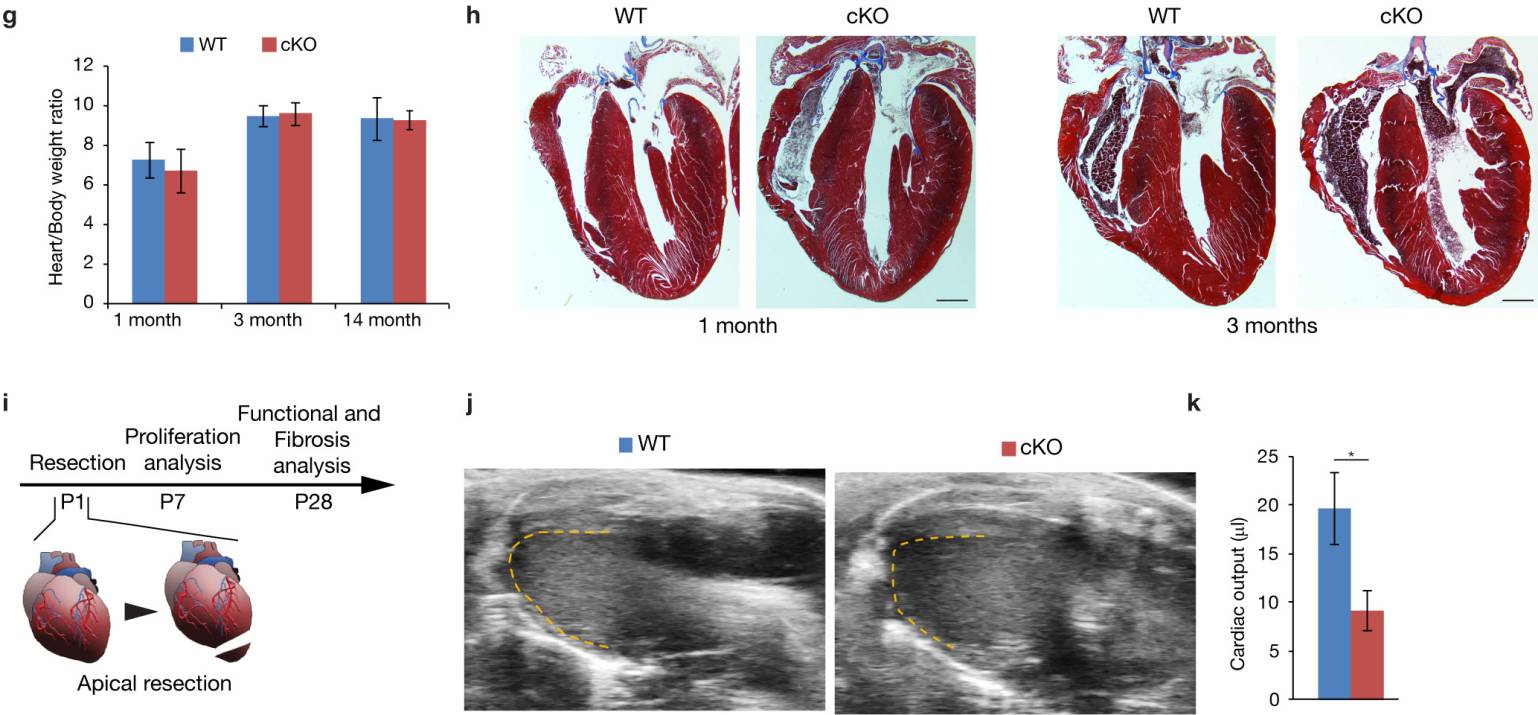
Agrin cKO中CM轻度肥大可以认为是明显的证据(扩展数据图5c,d)。此外,Agrin cKO展出1个月时射血分数轻微下降,在之后的某一时间点消失(扩展数据图5e,f),心/体重比和纤维化染色不受影响(扩展数据图5g,h)。最后,该研究团队检查了Agrin-cKO小鼠心脏再生是否受损。P1小鼠进行心脏切除术后于第1周和第4周进行评估(扩展数据图5i),Masson的三色染色检查显示相对于野生型同窝出生者,纤维化所有所提升(图2j-1),符合心脏功能降低的结果(图2m,n和扩展数据图5K)。相应的,Agrin-cKO中的CM增殖减少(图2o,p)。这些结果证明了Agrin是新生小鼠心脏再生所必需的,但严格来说,并不是出生后心脏生长或功能维持所必需的。
 扩展数据图6a-g
扩展数据图6a-g
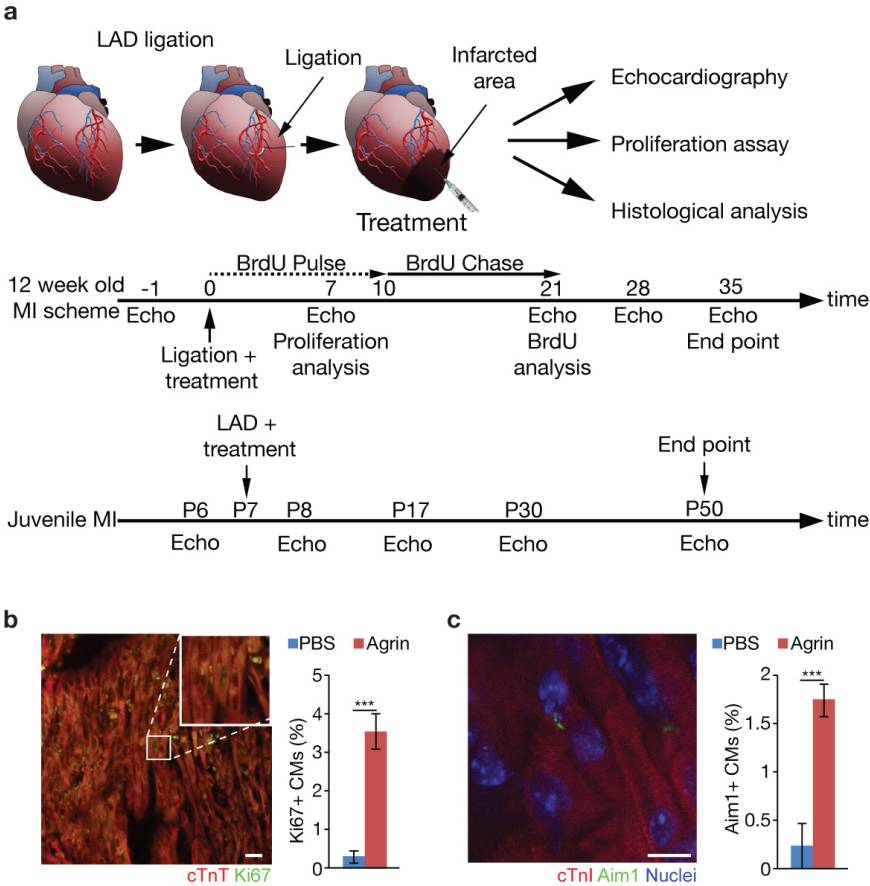
随后科学家们检查了重组Agrin是否可以促进CM的幼年和成年的增殖以及心脏再生(扩展数据图6)(图3)。对小鼠进行左前降支动脉(LAD)永久性结扎并在心肌内注射Agrin(50μl,20μg/ ml)或PBS(作为control)(扩展数据图6a)。Agrin诱导CM细胞周期在与梗塞区域相邻的健康心肌中重新恢复(图3a-c和扩展数据图6b,c)。MI后4天对成年个体的心脏进行组织学分析,结果显示两组的情况相似,然而从第14天起,两组的损伤面积出现差异,在Agrin治疗的心脏中,疤痕区域减少,在第35天显著减少(图3d,e和扩展数据图6d)。此外,超声心动图可以看出MI之后,在这两种模型中Agrin治疗都可以改善心脏功能(图3f,g和扩展数据图6e,f)。Agrin处理的小鼠也显示出防止心肌病的效果(图3h和扩展数据图6g)。Agrin存在于注射后72小时的梗塞心脏中,尽管其水平逐渐下降(扩展数据图7a,b)。

图3a-h

扩展数据图7
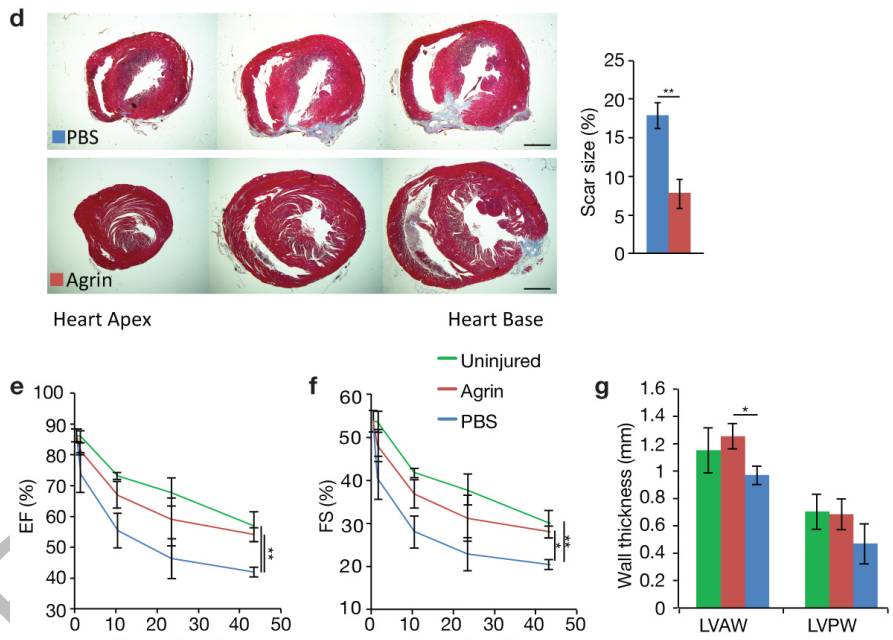
α-dystroglycan (Dag1)在P1中广泛表达(扩展数据图8a,b),然而P8的RNA和蛋白质表达被CM所限制(图4a-c和扩展数据图3)。但在P1或P7中,MuSK表达非常低(图4a)。在单核细胞成熟期,Agrin-Dag1信号传导促进ERK激活(图4d)。Dag1-Agrin结合位点的阻断抗体(IIH6C4)减弱了Agrin诱导的ERK活化(图4e)。此外,使用PD0325901或抗Dag1抗体阻断Agrin诱导的P7Mc增殖(PD,MEK抑制剂)(图4f,g)。用Agrin处理P7心脏培养物2和48小时并通过甘油梯度分离分析全细胞提取物(图4h)。
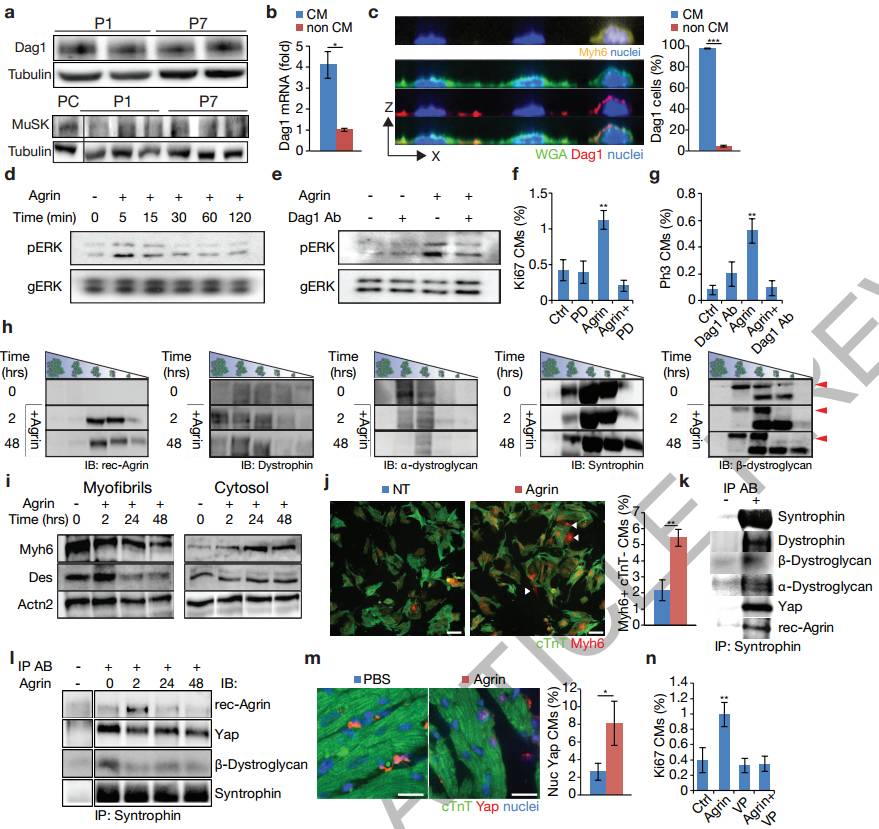 图4a-n
图4a-n
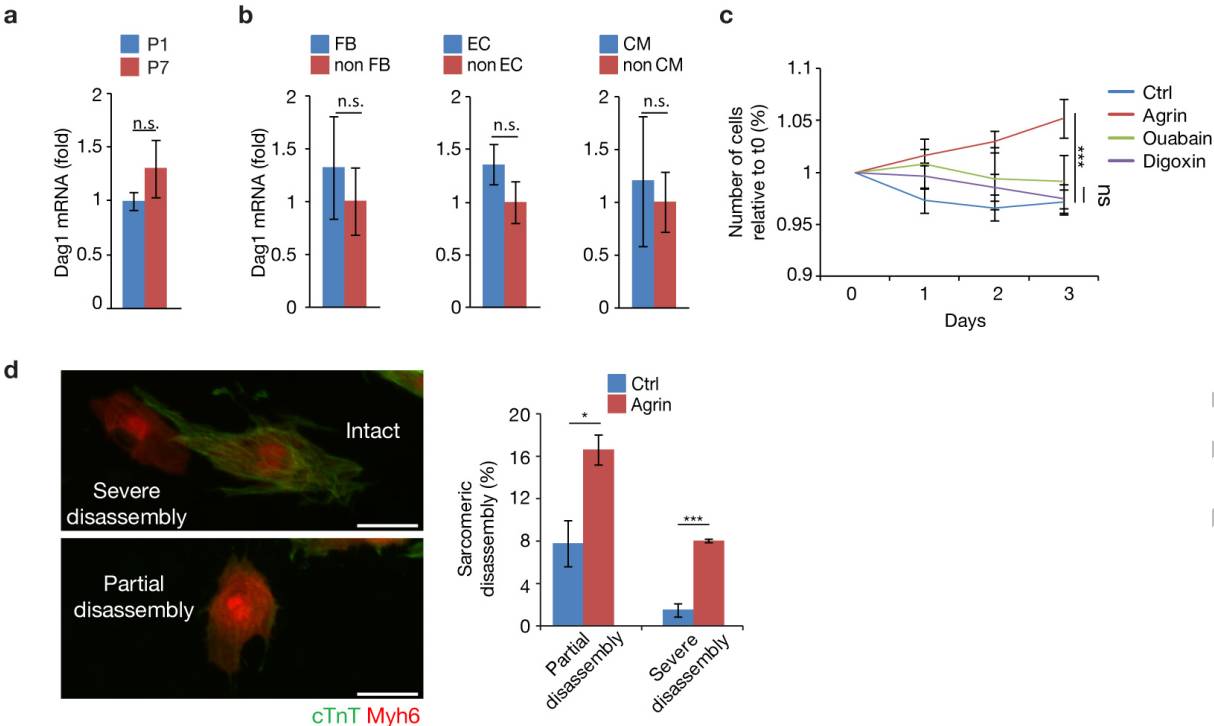
经过2小时的治疗,重组Agrin存在于含有DGC的分组中,表明Agrin与该复合物相结合(图4h)。分离自CMs并接受Agrin治疗的肌原纤维显示Myh6、α-辅肌动蛋白(Actn2)和Desmin(Des)的含量逐渐减少,这一发现说明细胞骨架的完整性符合CM去分化过程(图4i)。Agrin诱导P7中的CMs的肌节分解(扩展数据图8d),这与经Agrin处理后心肌肌钙蛋白T表达完全缺失的CM数量上升了2.5倍的结果相一致(图4j)。
扩展数据图8a-b
DGC成分的co-IP证实,Agrin和Yap都依附于DGC(图4k)。Agrin治疗后,β-dystroglycan和Yap从复合物分离(图4l)。因此,在CM里,Yap的细胞核百分比在Agrin治疗后增加了3-4倍(图4m)。Agrin无法在verteporfin存在的情况下诱导CM增殖(图4n)。Agrin通过Dag1与DGC结合并降低其稳定性,导致肌原纤维分解并激活Yap和ERK等信号分子(扩展数据图9)。
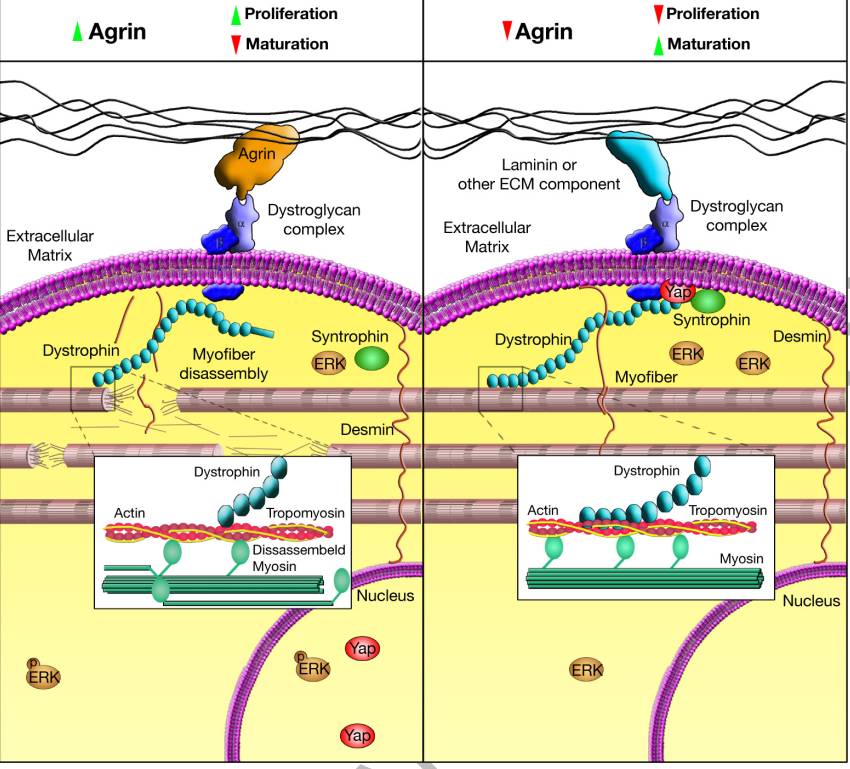
扩展数据图9
为了评估Agrin的转移能力,科学家们通过在明胶涂层上培养2D基板研究了Agrin是否能够促进源于人诱导多能干细胞(hiPSC-CMs)的CM增殖。依据hiPSC-CM细胞周期活性给予人或大鼠集胞苷的剂量(图5a,b)。延长给药(100ng / ml,两周)的人类Agrin提升了CM细胞周期活性约22倍(图5c)。此外,Agrin治疗显著降低了细胞成熟速度(图5d),并降低了功能和成熟标记的表达(图5e,f)。
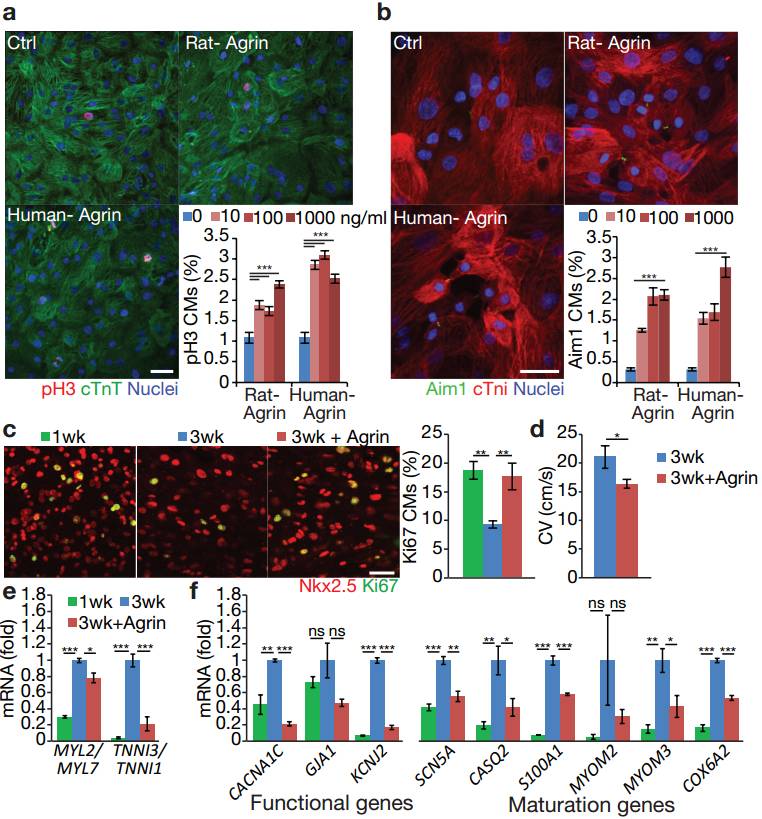
图5a-e
综合分析这些研究结果,得出了与在小鼠中一致的结论,即不论在2D和3D培养系统中,人类Agrin不仅可以促进CM增殖并且能够减缓人类iPSC-CMs的成熟。
参考文献:
Elad Bassat, Yara Eid Mutlak, Alex Genzelinakh, Ilya Y. Shadrin, Kfir Baruch-Umansky, Oren Yifa, David Kain, Dana Rajchman, John Leach, Daria Riabov Bassat, Yael Udi, Rachel Sarig, Irit Sagi, James F. Martin, Nenad Bursac, Shenhav Cohen, Eldad Tzahor. The extracellular matrix protein Agrin promotes heart regeneration in mice. Nature, 2017; DOI: 10.1038/nature22978
未止科技3.0重磅上线,你可以直接在公众号中回复你感兴趣的关键词,即可收到相关文章推送!
未止科技保留著作权,未经许可,禁止转载。否则我们将通过微信公众号平台和律师团队进行维权。如希望转载,请参照公众号菜单中的“转载守则”,在公众号后台或邮件联系我们获得授权。




















