本周根据检索式("exosomes"[MeSH Terms] OR "exosomes"[AllFields]) OR ("extracellular vesicles"[MeSH Terms] OR("extracellular"[All Fields] AND "vesicles"[All Fields]) OR"extracellular vesicles"[All Fields]) OR microvesicles[All Fields]AND ("2017/05/07"[PDAT] : "2017/05/13"[PDAT])共发现文献更新41篇,其中影响因子>10的有5篇,>5的有11篇。
1、Roles of exosomes in cardioprotection.
外泌体在心肌保护方面的作用作者:Barile L,Moccetti T, Marbán E,Vassalli G.
出处:Eur HeartJ. 2017 May 7;38(18):1372-1379. doi: 10.1093/eurheartj/ehw304.
IF=15.064

摘要:外泌体是起源于胞内的胞外小囊泡,它们被认为是细胞间传递信息的关键中介物。所有的心脏内细胞包括心肌细胞、内皮细胞、成纤维细胞都通过释放外泌体来调节细胞功能。从人类心肌祖细胞释放的外泌体具有心肌保护功能并且在发生心梗后可以使受损心肌细胞功能恢复到它们祖细胞水平。心脏祖细胞起源的外泌体富含心肌保护功能的小RNA尤其是miR-146a-3p。循环中的外泌体使远处缺血的心肌进行预处理,用来减少缺血带来的损伤。此外,它们现在还在被研究作为诊断标记物的应用价值。干细胞来源的细胞外信号物质介导的旁分泌效应的发现暗示了未来无需细胞性的治疗策略可以代替细胞移植。这项研究通过关注心脏祖细胞来源的外泌体带来的心肌保护功能讨论了外泌体在心血管系统生理方面的逐渐显露出的地位。
2、ExtracellularVesicles in Metabolic Syndrome.
在代谢综合征中的细胞外囊泡作者:MartínezMC, Andriantsitohaina R.
出处:Circ Res.2017 May 12;120(10):1674-1686. doi: 10.1161/CIRCRESAHA.117.309419. Review.
IF=11.551
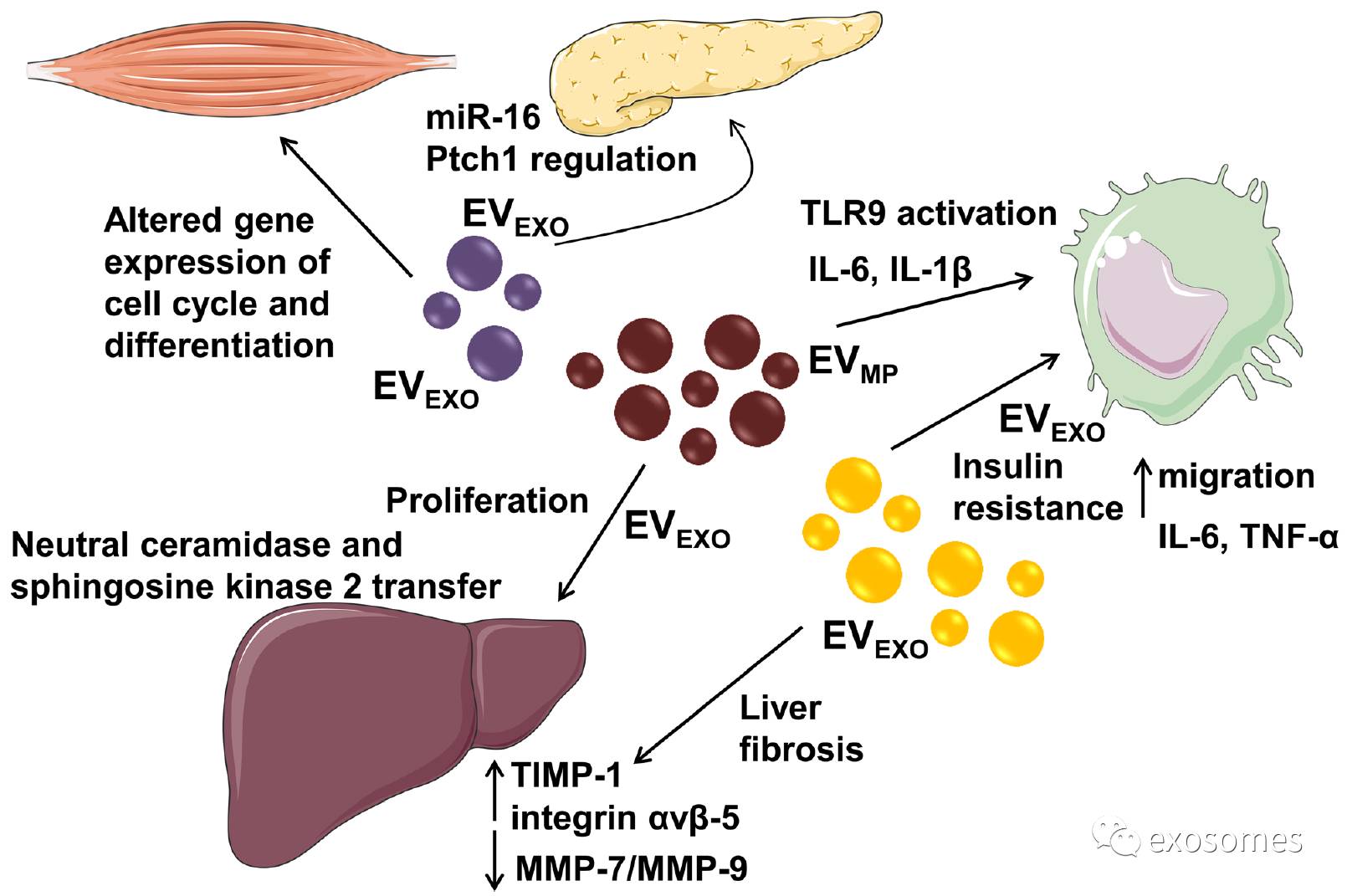
摘要:代谢综合征定义为一系列心血管疾病和糖尿病相互风险因子。这些因子包括代谢异常如高糖血症、高甘油三酯、低高密度脂蛋白胆固醇水平、高血压及肥胖,主要是中枢性肥胖。在这篇文章中,细胞外囊泡(EVs)可能在帮助阐明代谢疾病中疾病相关通路方面发挥了新效应。 事实上,EVs(是涵盖微粒、外泌体和凋亡体的一种术语)是在生理病理方面出现的一种细胞间交流的新兴手段,主要因为它们代表了细胞间基本信息传递的新方式。这些微结构包括蛋白、脂质和可修饰靶细胞表型和功能的基因信息。EVs能携带原始细胞特异性标记物,这样可能用于监测循环中作为潜在生物标志物的动态变化,因为在代谢综合征中EVs循环水平有升高。由于EVs的混合成分,不同原始细胞来源的EVs的数目及含量,细胞刺激的模式及它们产生的机制,很难确定特殊的功能作为疾病的驱动或生物标志物。这篇综述报道了当前关于不同细胞的来源EVs的数据,包括内皮、平滑肌细胞、巨噬细胞、肝细胞、脂肪细胞、骨骼肌细胞及最后的来源于微生物作为信息的生物效应器,导致代谢综合征。描述涉及EVs功能的机制的复杂性可强化EVs是有效生物标记物,并作为靶点用于创新治疗策略的假想。
3、ExtracellularVesicles in Angiogenesis.
血管新生中的细胞外囊泡
作者:TodorovaD, Simoncini S, Lacroix R, Sabatier F, Dignat-George F.
出处:Circ Res.2017 May 12;120(10):1658-1673. doi: 10.1161/CIRCRESAHA.117.309681. Review.
IF=11.551
摘要:过去十年的研究已发现,胞外囊泡(包括凋亡小体、微囊泡、外泌体)在正常生理环境和病理环境中细胞间交流中扮演着重要作用。胞外囊泡封装着各种生物活性分子,转运到附近或远距离的细胞,激发各种信号通路。递送到靶细胞的信号依赖于EV内容物,换句话说,由EV源细胞和周围环境决定。在这些信号反应调节中,EV涉及的血管发育、生长、迁移已被广泛报道,其在再生医学和血管新生相关疾病中的治疗能力已逐渐引起关注。各种不同类型细胞分泌的EV向内皮细胞传递复杂信号,诱导其血管形成或产生抗血管形成的信号。作为一个动态系统,EV通过改变内容物来微调血管形成从而适应微环境的改变。本文回顾了目前已知的微囊泡和不同细胞来源的外泌体在血管形成中的作用,特别是机制的研究,并讨论其作为治疗手段的主要挑战和前提条件。
4、Extracellular Vesicles in Cardiovascular Disease: Potential Applications in Diagnosis, Prognosis, and Epidemiology.
心血管疾病中胞外囊泡的作用:在诊断、预后和流行病学中的潜在应用
作者:Jansen F, Nickenig G, Werner N.
出处:Circ Res. 2017 May 12;120(10):1649-1657. doi: 10.1161/CIRCRESAHA.117.310752. Review.
IF=11.551
摘要: 胞外囊泡来源于不同的亚细胞小室结构,并释放于细胞外。通过转运其内容物至靶细胞和组织中,它们是一种新型的相邻细胞和远隔细胞之间进行细胞间交流的调节者。因为囊泡组成和生物学内容物是细胞活化和受损的特异性特征,所以,它们作为诊断性和预后性生物标志物的潜力在心血管疾病中引起了重大的兴趣。 循环性囊泡结合的或未与囊泡结合的核酸的特点能够作为诊断和监测心血管疾病的一种有价值的工具,近来被称为一种液体活检。最后,胞外囊泡的基因编辑和细胞特异性应用能够为心血管疾病的治疗展示一种新型的治疗选择。在这篇综述中,我们总结了当下对于胞外囊泡用作诊断性和预后性生物标志的了解,以及它们与心血管疾病中的纵向流行病学研究有关的潜在应用。
5、MethodologicalGuidelines to Study Extracellular Vesicles.
学习细胞外小囊泡的方法指导
作者:CoumansFAW, Brisson AR, Buzas EI, de Wever O, Nieuwland R.
出处:Circ Res.2017 May 12;120(10):1632-1648. doi: 10.1161/CIRCRESAHA.117.309417. Review.
IF=11.551
摘要:由于发现了细胞外小囊泡(EVs)的生理和病理条件间的联系,人们对EVs的兴趣呈指数增长。EVs被寄予厚望能在诊断和转化上有新的发现。这篇综述提供了基于专家观点的EVs最新前沿的更新,并且总结了根据收集到的EVs分离、侦查和特征描述的样本提出的最近接受的思考和建议。常见的混淆概念和易犯错误被重点标注。虽然EVs被发现存在在所有体液中,我们将关注人类血液中的EVs,因为它是心血管研究中最复杂也是最有趣的体液。
6、The Micro-Managing Fat: Exosomes as a New Messenger.
微观调控脂肪:外泌体作为一个新信使
作者:Chen XW, Li S, Lin JD.
出处:Trends EndocrinolMetab. 2017 May 10. pii: S1043-2760(17)30063-2. doi: 10.1016/j.tem.2017.04.004. [Epub ahead of print]
IF=8.964
摘要:棕色脂肪分泌内分泌因子,并发挥除产热以外的代谢作用。 除了蛋白质因子和生物活性脂质之外,最近的工作已经揭示了由外来体携带的棕色脂肪衍生的miRNA作为干扰物串扰的新手段,对代谢生理学和疾病具有潜在的重要意义。
7、MSC-derived Extracellular Vesicles Attenuate ImmuneResponses in Two Autoimmune Murine Models: Type 1 Diabetes and Uveoretinitis.
衍生的细胞外囊泡在两种自身免疫小鼠模型中降低免疫应答:1型糖尿病和葡萄膜炎。
作者:Shigemoto-KurodaT, Oh JY, Kim DK, Jeong HJ, Park SY, Lee HJ, Park JW, Kim TW, An SY, ProckopDJ, Lee RH.
IF=7.023
出处:Stem Cell Reports. 2017 May 9;8(5):1214-1225. doi:10.1016/j.stemcr.2017.04.008.
摘要:有证据表明间充质干/基质细胞(MSC)产生的细胞外囊泡(EVs)在几种疾病模型中发挥其治疗作用。我们以前证明MSCs在1型糖尿病(T1D)和实验性自身免疫性葡萄膜视网膜炎(EAU)模型中有抑制自身免疫。因此,在这里,我们使用我们建立的影响胰腺和眼睛的自身免疫性疾病的小鼠模型,研究了MSC衍生的EV的治疗潜力:T1D和EAU。数据表明,MSC衍生的EVs有效地预防了T1D和EAU中疾病的发病。此外,用MSC衍生的EVs进行混合淋巴细胞反应测定表明,EVs抑制抗原呈递细胞的活化并抑制T辅助细胞1(Th1)和Th17细胞的发育。这些结果表明提高MSC衍生的EV可能是免疫疾病预防的细胞治疗的替代方案。
本期更新就到此结束啦!我们下期再见!