2017年基因编辑学术研讨会于近日在沪圆满闭幕,国内一线基因编辑大牛齐聚一堂,共同讨论基因编辑大课题。诚然CRISPR/Cas系统已经风靡全球,但CRISPR-Cpf1作为2015年底才被发现的一种新型DNA编辑神器,对大众而言依然十分陌生。
尽管已知晓CRISPR-Cpf1系统就像一枚导弹,可精确靶向疾病相关基因。但对于这枚“导弹”的作用机制一直无法揭示。而哈尔滨工业大学的黄志伟教授则带领其团队对其进行破译,且有所收获。这项喜人的研究成果《The crystal structure of Cpf1 in complex with CRISPR RNA》于2016年发表于Nature杂志上。

哈尔滨工业大学生命科学与技术学院教授黄志伟
黄志伟教授素有HIV杀手之称,他于2014年在Nature杂志上发表的文章《Structural basis for hijacking CBF-β and CUL5 E3 ligase complex by HIV-1 Vif》,首次揭示了HIV-1病毒vif调控蛋白的结构,阐释了vif与宿主细胞配体及靶标结合方式,为理性设计靶向该复合物的全新艾滋病药物提供了结构基础,且破解了困扰这一领域科学家们30余年的谜团。
而在此次学术研讨议上,黄志伟教授则详细阐述了CRISPR-Cpf1能在人类细胞中高效编辑DNA的系统工作机理,为实现改造Cpf1并对 DNA 中的特定基因进行“关闭”、“恢复”和“切换”等精准“手术”提供了新的可能,也许未来人类通过基因工程手段战胜癌症和艾滋病等重大疾病就不再只是空想。

为了揭示CRISPR-Cpfl识别cr RNA的分子机制,黄志伟研究团队通过SeMet衍生的蛋白单波长异常色散法解析了毛螺科菌(Lachnospiraceae bacterium)中结合crRNA的LbCpf1复合物的晶体结构,其分辨率高达2.38埃(Å)。
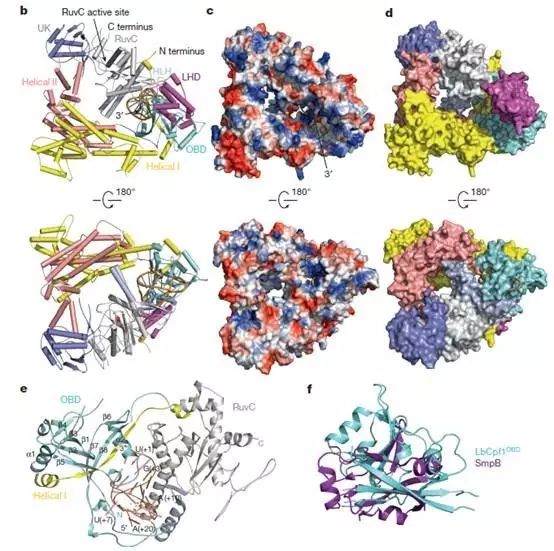
令人意外的是,Cpf1-crRNA并非之前推测的二聚体状态,而呈现出一种三角形结构,且该结构中间有一个带有正电荷的凹槽。而crRNA则通过发卡结构形成高度扭曲的构象紧密结合在Cpf1中心寡核苷酸结合结构域(OBD),和靶基因配对的3’末端位于Cpf1凹槽的一端。而Cpf1对DNA的切割则依赖于其C末端RuvC结构域的催化活性。

和Cas9结合的sgRNA显著不同的是,Cpf1结合的crRNA引导序列部分并没有电子密度,即在没有底物结合的状态下该序列和Cpf1结合比较松散。而在结构观察中发现,结合crRNA的六水合镁离子(Mg(H2O)6)2+对稳定crRNA构象激活Cpf1的催化活性非常关键。
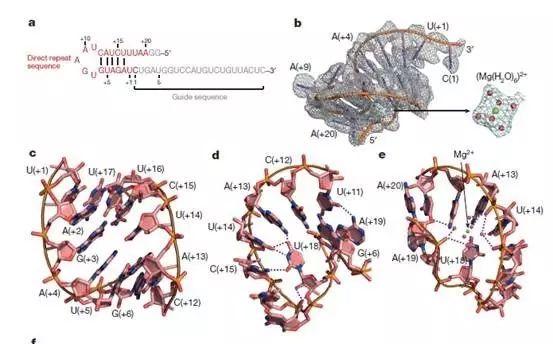
另外,他们还发现Cpf1在没有crRNA结合的状态也处于松散的构象,而crRNA的结合,甚至于仅仅是crRNA的重复序列,就可引起Cpf1发生显著的构象变化,这一点也是与sgRNA结合的Cas9不同。

在进一步深入分析后,这种特殊的结构变化来自于H843、K852及K869催化残基侧链上的氮原子位于一个平面上,同时和RNA A(+20)的磷酸基团形成氢键,该结构证据表明Cpf1剪切pre-crRNA成为crRNA是一个碱催化反应。

此外,黄志伟教授认为Cpf1是一个比Cas9更小、更简单的核酸内切酶,这意味着它能更容易进入需要修改基因的细胞中,因此CRISPR-Cpf1 是比CRISPR-Cas9的更方便的新基因编辑系统。同时也比较了CRISPR-Cpf1 和CRISPR-Cas9系统在编辑机制和结构上的不同点:

1.CRISPR-Cpf1 仅通过较短的crRNA识别目的DNA底物,而CRISPR-Cas9除了crRNA外,还需要TracrRNA的帮助才能结合底物;
2.CRISPR-Cpf1 识别的PAM和CRISPR-Cas9不同;
3.CRISPR-Cpf1剪切目的DNA是粘性末端剪切,而CRISPR-Cas9是平末端剪切;
4.CRISPR-Cpf1本身还是一个RNase,这也是目前为止发现的唯一一个具有序列特异性的集DNase和RNase于一身的核酸酶。
总之,黄志伟团队的研究成果为成功改造Cpf1系统,使之成为特异的、高效的全新基因编辑系统提供了结构基础,一旦该系统得以转化应用,就可对癌症和艾滋病等疾病的基因进行“编辑”,而“编辑”过的基因可以遗传到下一代,从而有望彻底消灭这些疾病。
另外,对于CRISPR-Cpf1在艾滋病治疗方面的研究,黄志伟教授表示,希望能有研究组和他们一起合作将Cpf1用于对包括艾滋病病毒以及其他病毒的基因治疗。
参考文献:The crystal structure of Cpf1 in complex with CRISPR RNA




