Dynavax的乙肝病毒(Hep B vaccine)疫苗HEPLISAV-B距最终获得FDA批准上市又进了一步。2017年7月28日,在疫苗相关生物制品咨询委员会(Vaccines and Related Biological Products Advisory Committee (VRBPAC))的专家投票中以12:1 (3人弃权)获得建议批准HEPLISAV-B乙肝疫苗生物许可证的结果。

乙肝
乙肝是一种具有很高致病率和致死率的传染性疾病,具FDA数据显示,美国4.3%至5.6%的人口感染乙肝,80万至220万人受慢性乙肝影响,每年约5000人因乙肝引起的慢性肝病而死亡。
乙肝疫苗发展历程
首款重组乙肝病毒疫苗获批于1980年,是默沙东的Recombivax®和葛兰素史克的Engerix-B。首款血源性乙肝疫苗获批于1981年,是默沙东的Heptavax-B®。以上疫苗就属于重组乙肝表面抗原(HBsAg),使用明矾(aluminum salt)为佐剂,分3次,6个月内完成注射。1991年,FDA又增批适用人群至婴儿以及青春期儿童。
在乙肝疫苗成功上市的二十多年间,乙肝在美国的感染率明显下降,数据显示1990年至2007年,乙肝在美感染率下降了82%。尽管如此,FDA统计在美国乙肝患者依然以每年21,900人的速度增加,其中95%的新增患者是因为没有及时注射疫苗,最新数据显示,2014年至2015年乙肝感染率增加了20.7%。
乙肝疫苗目前面临的3大挑战
①潜在受感染人群必须经过职业背景调查以及行为风险性调查才能确认。
②整个疫苗接种过程需要经历6个月3次注射才可完成,而且< 50%的成人在注射2次之后会获得血清保护。
③疫苗需被高度血清保护,致使血清下降的人群效果很差,例如糖尿病人,男性,老年人,肥胖者,吸烟者。
Dynavax——HEPLISAV-B
Dynavax在2012年4月26向FDA递交了HEPLISAV-B的生物许可证申请(BLA),内容包括对照实验,以HEPLISAV-B (4425例)对比已上市疫苗Engerix-B® (1420例)。VRBPAC于2012年11月15给出结论,认为HEPLISAV-B相对于Engerix-B®可以有效提高血清保护率,并以13:1的票数给予HEPLISAV-B有效性评价。但在安全性问题上委员会以8:5的票数(1人弃权)认定当时的临床数据不足以在疫苗安全性问题上支持其上市,但是其有效性是毋庸置疑的,结合其进行的HBV-10/16/23临床试验项目,可以看出与对比试剂Engerix-B®相比, HEPLISAV-B存在优势。
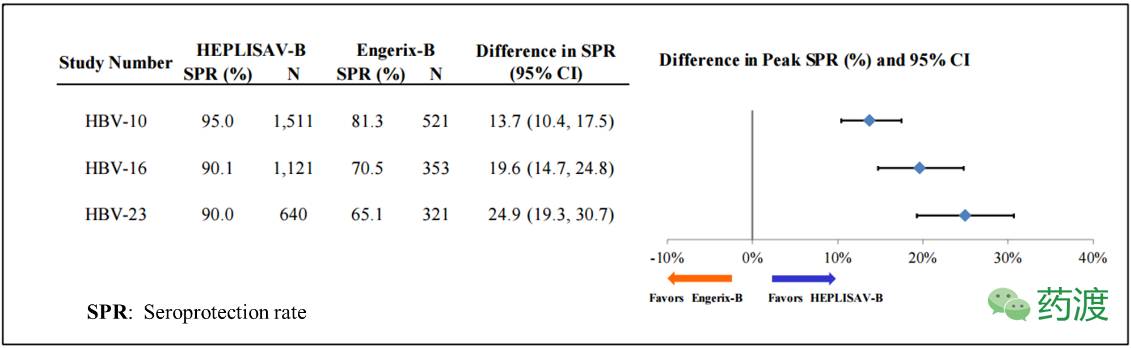
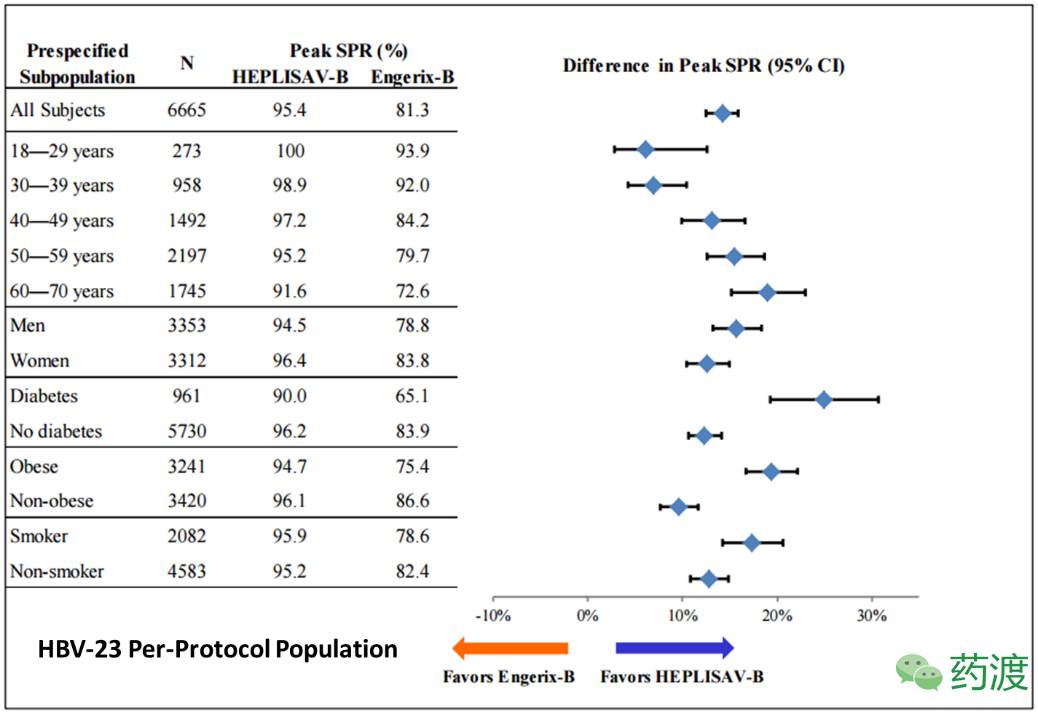
在为期24周的观察实验((HBV-23)中,HEPLISAV-B™证明了其在不同人类亚群当中的SPR的有效性,其中包括不同年龄,性别,体重指数和是否吸烟。
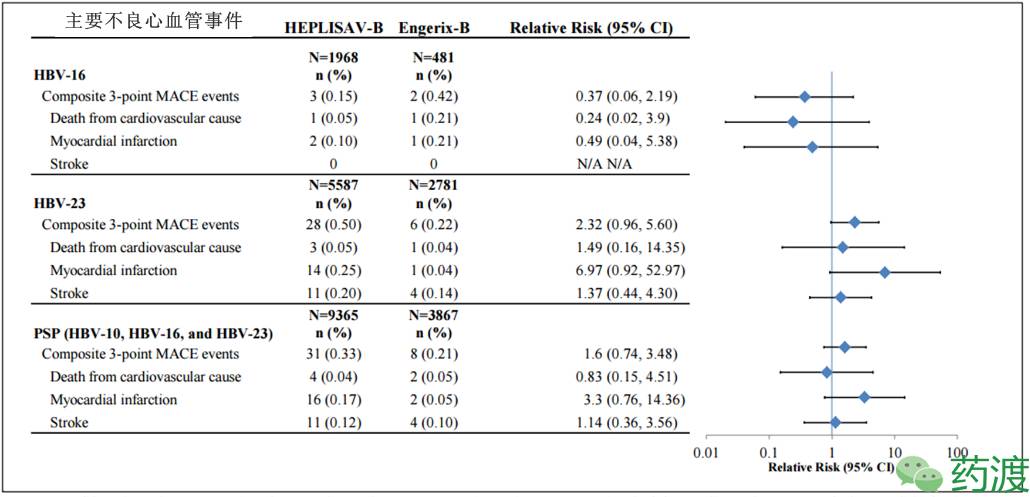
对于FDA专家之前特别关注HEPLISAV-B在心血管方面的副作用和安全问题,其中最为关注的是HBV-23s实验组中心肌梗死(myocardial infarction )的发生率,虽然Dynavax已经设计了整套上市后的监察方案,以及在Kaiser Permanente进行涉及到40,000人的预先指定免疫介导的活动监察测试,但是委员会提出这样的设计方案将高危病人排除在外,不利于更准确地收集安全性信息。即使方案最终实施完成,并取得了相关信息,委员会依然担心未来医生在开具处方时可能会对患者区分对待。
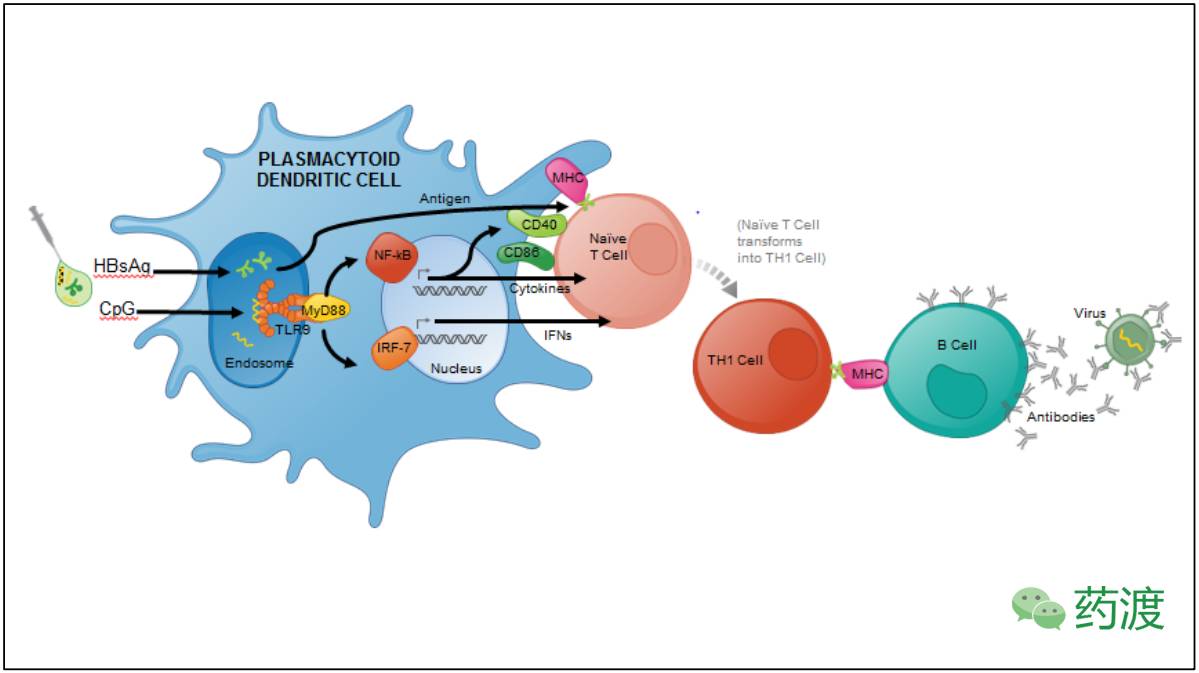
HBsAg-1018 (HEPLISAV-B™)是一种针对成年人的乙肝病毒疫苗,是重组乙肝表面抗原与1018的组合,Heplisav可针对已知所有亚型的乙肝病毒种类,为多形汉森酵母分离的20mcg乙肝表面抗原(HBsAg),3MG寡核苷酸佐剂Toll样受体9 (TLR9)激动剂(1018),溶于0.5ML水溶液中。肌肉注射2次,0至1月内完成。
1018主要通过激活细胞受体TLR9,TLR9是一种的跨膜受体,抗原呈递细胞所表达的TLR9受制于浆细胞样树突状细胞(PDC)和记忆B细胞。在小鼠体内,TLR9刺激树突状细胞,并且在人类体内应该也有相同的作用。1018刺激浆细胞样树突状细胞之后会产生快速和短暂的1型IFNs,其次是成熟有效的抗原提呈细胞浆的生产,CD40、CD86、MHC-I和MHC-II类分子表达增加,以及细胞因子的产生,特别是IL-12,进而诱导T细胞分化。
HEPLISAV-B缩短了接种的时间,方便乙肝疫苗的接种,也有利于推广,此外,对于血清下降患者也适用,扩大了患者的使用范围。而目前委员会唯一担心的是其安全性问题,特别是在心血管方面。
参考文章
1. FDA Advisory Committee Briefing Document [Hepatitis B Vaccine (Recombinant), Adjuvanted] Vaccines and Related Biological Products Advisory Committee. Meeting Date: July28, 2017.
2. Dynavax Announces FDA Advisory Committee Vote in Favor of HEPLISAV-B (TM)