作者 | 南山南
编辑 | Unica
单克隆抗体是治疗性蛋白质中数量最大且发展最快的一组。目前已有70多种抗体药物获得临床用药上市批准,2017年抗体药物的市场规模突破了千亿美元 。目前有500多种治疗性抗体及其衍生物正在临床试验中,重点放在癌症治疗和自身免疫性疾病上。
第一个被批准的治疗性抗体是通过小鼠杂交瘤技术获得的。然而,鼠抗体因其对人体来说具有具有异源性,因此引起患者强烈的人抗小鼠抗体(human anti-mouse antibody, HAMA)免疫反应。解决这个问题的一个方法是重组DNA技术。使用基因工程技术,将人抗体的序列交换鼠的部分序列,得到“嵌合的”(人抗体恒定区取代的鼠抗体恒定区)或“人源化”的抗体(仅鼠抗原结合区/互补决定区CDR被转移到人可变区框架中)。这些工程化的抗体在治疗性抗体批准的第一个十年中占主导地位,创造了辉煌战绩。
但即使是人源化程度非常高的人源化抗体,其中依然至少含有1% ~ 5%的异源成分。随着人们在全人源化抗体技术方面的进步,全人源抗体正后来居上,占据了新抗体药物研发的主导地位。全人源抗体研究始于20世纪90年代,发展到今天,目前已形成了抗体库技术、转基因动物或转染色体动物这三种制备全人源抗体的代表性技术。转基因动物,通常是小鼠或大鼠,通过实验手段导入人免疫球蛋白基因座,而他们自己的抗体基因被敲除。因此,在免疫之后,他们利用这个序列库从人类种系序列中产生IgG,由此可以通过经典的杂交瘤技术产生单克隆抗体。抗体库技术,例如代表性的噬菌体抗体展示技术,无需免疫,可以在体外产生全人源人抗体。
噬菌体抗体库技术制备全人源抗体通常先分离免疫或未被免疫的B细胞,并采用RT-PCR技术扩增其中全部的抗体VH、VL基因片段;将体外扩增的VH、VL基因片段随机克隆入相应载体,构建成为Fab或ScFv等形式的抗体组合文库;再将抗体基因组合文库插入噬菌体编码的膜蛋白的基因III(g3)或基因VIII(g8)的先导系列的紧邻下游,使外源抗体基因表达的多肽可以以融合蛋白的形式展示在噬菌体外壳蛋白pIII或pVIII的N端。每个噬菌体颗粒编码并呈递不同的抗体(即,“抗体文库”,图1),其含有数十亿个单个克隆。在这些抗体文库中,编码可与抗原结合的那些抗体的基因通过在体外对抗原进行亲和力富集-温和洗脱-噬菌体扩增,再继续重复以上富集筛选过程,直至数个循环后获得特异性好、亲和力强的抗体噬菌体库,最后从中筛选特异性好、亲和力强全人源抗体V区基因(图1)。

△ 图1. 噬菌体抗体文库技术
噬菌体抗体库的分类
目前为止,研究者已经创建了大量的、各式各样的抗体库,大体可以分为四类:天然抗体库、免疫库、半合成抗体库以及人工合成库。天然抗体库来自未经特定抗原免疫的宿主。理论上从天然抗体库中可以筛选获得可特异结合任何抗原的抗体,但由于这些抗体基因缺乏体内重排与突变,因而获得高亲和力的抗体相对不易,所筛选的抗体需要进行进一步的亲和力成熟改造;并且筛选背景高,特定抗原的抗体丰度低。
与天然抗体库不同,通过采用来源于特定抗原有效免疫的之后的宿主B细胞构建的免疫抗体库,含有大量针对该特定抗原的抗体,筛选背景大大降低;并且这些抗体基因经过宿主体内的亲和力成熟过程,往往具有令人满意的亲和力。通常采用一个库容为1x10^6克隆的免疫抗体库,我们就可以获得抗体亲和力常数低于1x10^-9mol/L较高亲和力的抗体。虽然从一个经过良好抗原免疫构建的噬菌体抗体库中很容易获得适宜的全人源抗体,但由于人体不能随便免疫,制备全人源抗体时往往受到限制,这就要求任然需要建立库容量比较大的非免疫库,从中筛选目的全人源抗体。抗体库往往需要达到1 x 10^12克隆才能保证从中筛选到针对特定抗原表位的具有较高亲和力的全人源抗体。
此外基于天然抗体库的框架区以及CDR1和CDR2区,通过随机合成扩增CDR3区的DNA序列,能够获得半合成抗体库。由于CDR3是决定抗体特异性的最重要部位,在B细胞个体发生过程中,结构及序列的多样性变化最大
,所以最常见是在CDR3引入随机突变,同时考虑长度的变化。但引入随机突变的时候,要兼顾CDR3侧翼的相对保守性,保
留某些在抗原接触和结构形成中有重要作用的残基。人工合成库则是通过抗体基因信息设计并合成的纯人工合成库。
噬菌体抗体库技术的优缺点
经典的杂交瘤技术需要耗费大量的时间和精力去获得高亲和力的抗体,而且需要进行后续的人源化改造。噬菌体表面展示技术可以不需要经过免疫和人源化改造步骤,依靠在完全可控的生物化学环境中进行富集筛选,实现短期内筛选到较高亲和力的全人源人类抗体序列。这一点上杂交瘤技术无法比拟。噬菌体展示技术还可以获得一些通过经典免疫难以获得的抗体,如针对非常小或非免疫原或毒性物质的抗体,克服了难以用杂交瘤技术获得人源单克隆抗体的障碍。
但其也有不足之处,如对库容量要求较高。如果库容量较小,难以获得高亲和力的抗体;构建库时费时费力。对库的大量未知及不可调控因素的影响,特别是IgM库中潜在的多样性局限(倾向于V基因家族的单一性表达)和对B细胞供体的免疫史的不可知,都影响着库的容量和质量。
噬菌体抗体库技术的经典筛选策略
经典的筛选方法是用固相或液相化的抗原与抗体库孵育,通过数次的“吸附-洗脱-扩增”,使特异性结合的克隆得以富集,具有简便、快速和高效的特点。下面就经典的筛选方法进行一下简单介绍。
1. 固相化抗原筛选法
将抗原直接包被在固相介质表面,如酶标板、免疫试管、亲和柱上,加入抗体库进行筛选。有些抗原包在固相介质表面后,其表位可能会受到影响,通过针对该抗原其他
表位的抗体捕捉该抗原后在进行筛选(图2)。
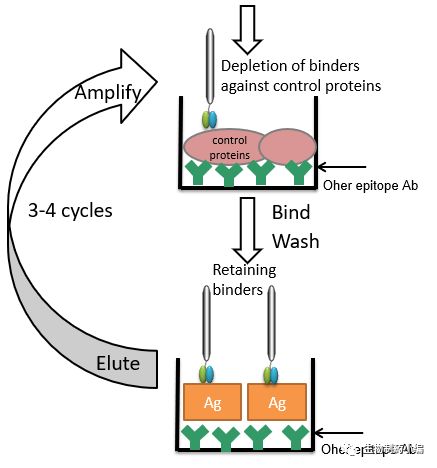
△ 图2. 固相化抗原筛选法
2. 抗原液相筛选法
用抗原标记生物素后,在液相利用亲和素磁珠,借助磁场作用进行噬菌体抗体的筛选是一种新颖的筛选手段(图3)。它同样可以解决固相化抗原表位的破坏问题。
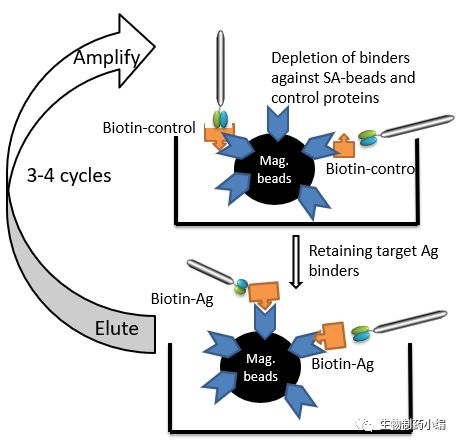
△ 图3. 液相抗原筛选法
结语
到目前为止,通过噬菌体展示产生的六种治疗性抗体被批准用于治疗(图4)。其中有大名鼎鼎的
阿达木单抗
Humira,连续六年荣膺全球“药王”,2017年取得了184.27亿美元的成绩,预计2018销售将突破200亿。噬菌体抗体库技术作为后基因组组时代一个强有力的实验实验技术,具有高效、经济、快捷等优势,但该技术在亲和性、库容量及多样性还有很多方面有待改进。因此研制出超大容量的和高亲和力的抗体库以及优化亲和筛选方法势在必行。
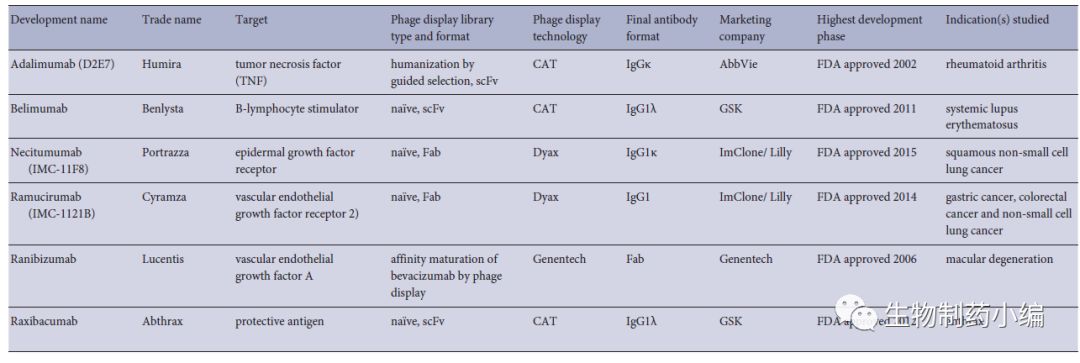
△ 图4.噬菌体抗体展示技术上市抗体药物
参考文献
1. André Frenzel, Jonas Kügler. Designing Human Antibodies by Phage Display. Transfusion Medicine and Hemotherapy, 2017.
2.Mersmann M, Meier D, Mersmann J. Towards proteome scale antibody selections using phage display. New Biotechnol, 2010.
3.Bradbury ARM, Sidhu S, Dubel S. Beyond natural antibodies: the power of in vitro display
technologies. Nat Biotechnol, 2011.
4.Hust M, Meyer T, Voedisch B, Rulker T, A human scFv antibody generation pipeline for proteome research. J Biotechnol, 2011.
欢迎加入小编团队成为小编一员
请加 小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。