论文DOI:10.1038/s41929-019-0357-9
全文速览
龚磊课题组报道了可见光/廉价金属协同催化苄基、烯丙基类化合物、环烷烃、链烷烃等烃类分子惰性 C(sp
3
)–H 键的区域和立体选择性官能团化反应。该反应具有良好到优秀的产率(up to 97 % yield)、区域选择性(up to 50:1 r.r.)和对映选择性(up to 99.5 % e.e.),并在一些药物及生物活性分子(如 celebrex、skelaxin 等)的后期官能化中也具有一定的适用性。反应产物能通过简单的方法转化为手性 α-氨基酸衍生物、β-氨基醇等重要分子,并保持光学纯度。此外,催化体系也展现了通过改变催化剂金属中心获得手性反转产物的独特现象,为立体发散性合成提供了极为简便的策略。
背景介绍
C(sp
3
)–H 键的直接官能团化具有原子、步骤经济、原料来源丰富等特点,备受合成化学家的青睐。然而,这些化学键的高键能、低极性等特征使其反应性差,相近能量化学键的存在也使反应的选择性难以控制。特别是对于未活化的烷烃而言,其选择性直接官能团化难度更是呈指数级的增加。
目前现有的选择性碳氢官能团化方法大多需要在反应原料中预置导向基或者 C–H 键邻位有官能团或杂原子的活化作用。对于未活化的烷烃,在我们工作发表之前仅有 Huw M. L. Davies 教授课题组的双铑催化体系能够实现其区域和立体选择性的 C(sp
3
)–H 官能团化。Davies 课题组发展的双铑催化剂可分别实现未活化烷烃一级,二级、三级 C(sp
3
)–H 键的选择性官能化,相关工作分别发表在国际顶尖学术期刊上:
Nat. Chem.
10
, 1048–1055 (2018);
Nature
533
, 230–234 (2016);
Nature
551
, 609–613 (2017)。
研究出发点
2018 年, 我们课题组利用手性噁唑啉-铜 (II) 配合物作为催化剂,在蓝光 LED 照射、极为温和的条件下实现了亚胺的不对称自由基烷基化反应。但是该反应的原子经济性不高,且自由基前体是三氟硼酸钾盐,一般要两步合成。本文研究利用手性配合物与商业化醌类可见光氢转移催化剂共催化的策略,在光反应条件下,烷烃作为自由基前体被活化产生烷基自由基,进而实现烷烃高效、100 % 原子经济性地向高附加值手性化合物的选择性转化。
图文解析
1. 推测的反应机理
醌类氢转移催化剂
PT
被可见光激发后产生双自由基中间体
I
,
中间体
I
攫取烷烃 C(sp
3
)–H 键的氢原子,生成一个半醌型自由基
II
和烷基自由基
III
;亚胺类自由基接受体与手性金属催化剂螯合形成中间体
IV
,之后
IV
被
II
单电子还原,产生被金属稳定的碳自由基
V
;烷基自由基
III
与
V
发生自由基偶联反应生成中间体
VI
,最后
VI
与游离底物进行配体交换并质子化得到手性产物。其中,反应产物的区域选择性推测是由氢转移催化剂
PT
和手性金属催化剂共同控制的。
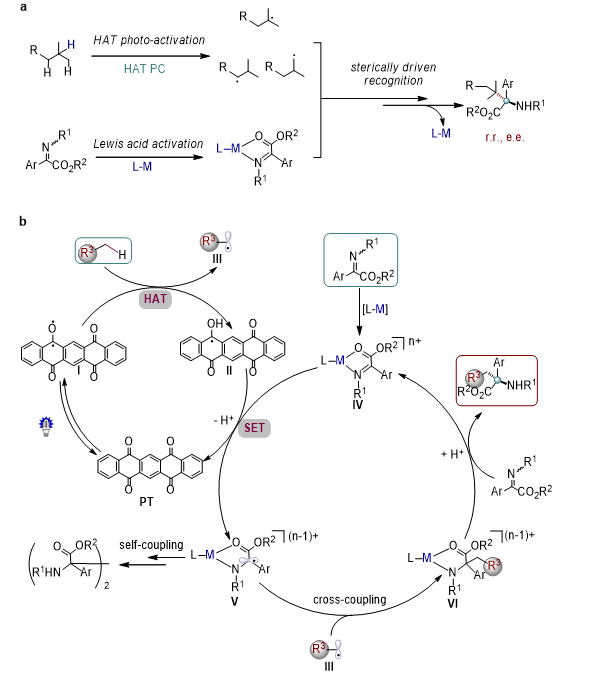
▲图 1. Initial design and mechanistic hypothesis. a
,
Our strategy involving a HAT organophotocatalyst and a chiral Lewis acid catalyst to functionalize C(sp
3
)–H bonds of unactivated alkanes with regio- and stereoselectivity.
b
, Mechanistic hypothesis.
2.
条件优化
基于以上推测,我们对底物、光敏剂、温度、甲苯的当量和配体进行了详细地筛选,最终确定了最佳条件。值得一提的是,即使只用一个当量的甲苯反应也可以得到优秀的产率,且 e.e. 值没有大的影响。
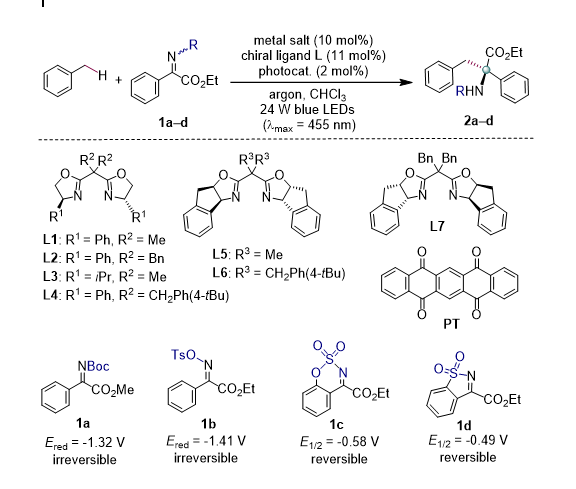
|
entry
a
|
l
i
gand
|
imine
|
T (
°C
)
|
t (h)
|
conv.
(
%
)
b
|
e.e.
(%)
c
|
|
1
|
L1
|
1a
|
25
|
10
|
0
|
n.a.
|
|
2
|
L1
|
1
b
|
25
|
10
|
0
|
n.a.
|
|
3
d
|
L1
|
1
c
|
25
|
10
|
Quant.
|
45
|
|
4
|
L1
|
1
d
|
25
|
10
|
Quant.
|
63
|
|
5
|
L
2
|
1
d
|
25
|
10
|
Quant.
|
73
|
|
6
|
L
3
|
1
d
|
25
|
10
|
Quant.
|
48
|
|
7
|
L4
|
1
d
|
25
|
10
|
Quant.
|
80
|
|
8
|
L5
|
1
d
|
25
|
10
|
Quant.
|
91
|
|
9
|
L6
|
1
d
|
25
|
10
|
Quant.
|
41
|
|
10
|
L
7
|
1
d
|
25
|
10
|
Quant.
|
-84
|
|
11
|
L5
|
1
d
|
-20
|
24
|
Quant.
|
93
|
|
12
e
|
L5
|
1
d
|
-20
|
28
|
86
|
93
|
a
Reaction conditions: toluene (1.0 mmol),
1
a
–
1
d
(0.10 mmol), metal salt (10 mol%), ligand (11 mol%), photocatalyst (2 mol%), CHCl
3
(2.0 mL), indicated temperature, 24 W blue LEDs lamp (λ
max
= 455 nm), under argon, see more details in Supplementary Information for the screening of solvent.
b
Conversion determined by
1
H-NMR.
c
E.e. value determined by chiral HPLC.
d
The reaction of toluene and
1
c
could be further improved by using Co(acac)
2
(10 mol%) as the salt and
L1
(11 mol%) as the chiral ligand, affording product
2
c
in 95% yield and -93% e.e. (see more details in Supplementary Information).
e
Reaction performed in a substrate ratio of 1:1 (toluene:
1
d
). n.a. = not applicable.
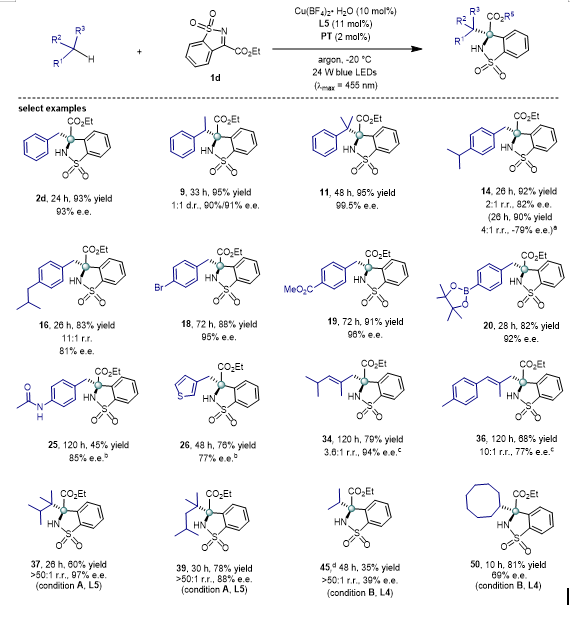
3.底物扩展
随后我们对底物进行了拓展,对于一级、二级、三级苄基烷烃都能以优秀的对映选择性得到产物,苯环上带有不同取代基,包括烷基、酯基、卤素、酰胺以及 Bpin 等,都能以优秀的对映选择性得到产物。对于含不同取代基的苯环底物和噻吩环底物也能以很好的结果得到产物。值得注意的是,对于对异丙基甲苯、和对异丁甲基苯等底物反应表现出中等到优秀的区域选择性。之后也对几种烯丙基的底物进行了考察,我们发现也能以良好到优秀的区域选择性得到产物。最后对未活化的烷烃底物进行了拓展,对于同时含有一级、二级、三级 C(sp
3
)–H 键的底物例如 2,3-二甲基丁烷和 2,4-二甲基戊烷,都能获得非常高的区域选择性(反应位点是三级 C(sp
3
)–H 键, 50:1 r.r.)和良好到优秀的 e.e. 值( 71–96 % e.e.)。有意思的是,反应也能应用于丙烷等小分子的活化。对于二级的环烷烃,我们可以获得中等到良好的对映选择性。