摘要
综述目的 目前,血液资源日趋紧张,加之异体输血可能给患者带来的免疫抑制及血源传播性疾病的风险,合理用血越来越得到临床医师的重视。只有在术前对围术期失血量及输血风险有比较准确的预测,才能更加有针对性的使用各种血液保护技术,以减少医疗资源的浪费及最大限度避免这些技术给患者带来的潜在危害,做到“有的放矢”。
综述方法 对近期与围术期失血与输血相关的文献进行检索与回顾,总结围术期失血与输血的危险因素及预测模型。
最新进展 众多研究总结了预测围术期大量失血与输血的危险因素,并构建了头颈外科、骨科、产科、心脏外科和急诊外科等类型手术围术期失血与输血风险的预测模型。临床医师可以利用这些模型预测围术期失血量与输血风险,提前制定并实施围术期血液保护方案。
总结 尽管这些围术期失血量与输血风险的预测模型对临床有一定指导意义,但仍需进一步研究以扩展可预测的手术类型,并提高预测模型的准确性。
引言
在世界范围内,每年输注红细胞量达8500万单位[1]。而在我国,随着手术量的增加,输血的需求也与日俱增。以北京为例,从1998年到2008年间,年输血量从26.8万单位(200 mL每单位)增长到70万单位,增长了161%,而其中70%的输血都用于手术患者[2]。尽管围术期输血为外科手术患者提供了安全保障,但同时也会带来安全隐患,如输血传播性疾病、输血导致的免疫抑制、输血相关性急性肺损伤、循环超负荷等。加之近年来血液资源短缺问题日益严重,围术期合理用血的问题日益受到关注。
为保护患者的血液,尽可能减少围术期异体输血,多种血液保护技术日益发展并得到广泛实施,包括术前自体血储备、术前纠正贫血[包括促红细胞生成素(erythropoietin,EPO)的使用]、急性等容血液稀释、术中抗纤维溶解药物的使用、术中/术后自体血回收等。尽管这些方法在降低异体输血需求方面有一定效果,但也并非毫无风险,例如:细菌污染、全身炎症反应加重、输血核对错误等。此外,这些技术的应用也加大了医疗成本。因此,不加选择地使用这些血液保护技术也是不当的,如何选择合适的血液保护技术,在具有输血高风险的患者中应用这些技术,为临床医师提出了新的课题[3]。
由此可见,术前对术中失血量与输血风险的预测将会有助于为外科医师、麻醉医师和输血人员提供警示信号,并使有限的血液资源和血液保护技术得到更具针对性的使用,达到成本效益最大化。本文对关于围术期失血量和输血风险的影响因素及预测的研究进展情况进行综述,以便外科医师和麻醉医师更好地完成术前准备,更恰当使用血液资源和血液保护技术,进而减少异体输血给患者带来的风险及相关资源的浪费。
增加围术期输血风险的危险因素
众多研究对不同类型手术的围术期输血风险进行了大量临床研究,发现影响输血风险的因素是非常复杂的,不仅与术中预计失血量相关,还与患者的生理状态、耐受能力以及疾病情况相关。下面就不同类别的手术分别进行总结。
头颈外科手术
就头颈外科手术而言,在输血的保驾下,使得外科医师安全地将肿瘤切除及再造的能力进一步增强。为了降低异体输血的风险,临床医师开展了术中血液保护技术,制定了更严格的输血指南以及采用术前自体血储备(preoperative autologous blood donation,PABD)等技术。PABD的风险之一是由于术中出血量较少而导致预先采集的血液未被使用,发生浪费。所以该技术的应用使得对术中输血风险进行预测显得尤为重要[3]。
文献报告,头颈部肿瘤手术的输血发生率为14%~81%[3-5]。Weber[3]在一项纳入436例头颈肿瘤患者的前瞻性研究中发现,影响输血风险的因素包括:年龄、肿瘤原发部位、病变部位、术前血红蛋白水平、术前是否接受化学治疗、术式、是否需要皮瓣重建等。其中高输血风险最重要的三个术前预测指标分别为:原发肿瘤为T3或T4期,术前血红蛋白低于正常和需要皮瓣重建。Shah等[4]的一项回顾性研究对行头颈部游离皮瓣重建的病例进行了研究,结果表明与术中输血风险显著相关的5个因素包括:性别、体质指数(BMI)、肿瘤期别、术前血红蛋白水平及游离瓣使用类型。
骨科手术
骨科手术中以脊柱手术出血量最为显著,因而本文主要探讨脊柱手术围术期影响输血风险的因素。而在脊柱手术中,脊柱侧弯手术和成人腰椎手术差异较大,影响输血风险的因素也不尽相同,因而以下将分别进行阐述。
脊柱侧弯手术 脊柱侧弯手术导致的失血量往往较大,最高可达4.5 L[6-8]。下面就文献报告的几个影响术中失血量的因素分别介绍。
① 融合节段数:一般认为,融合节段数越多,需要暴露的骨和软组织越多,失血量就越多。因此,融合节段数与术中失血及输血需求相关。近来Yu等[6]进行了一项回顾性研究,发现如果脊柱侧弯矫正手术中融合节段数≥6,则术中大失血(指术中失血量大于30%估计血容量)的风险增加3.7倍,说明融合节段数可能是脊柱侧弯手术术中大失血一个较好的预测指标。
② 截骨术:因为截骨术使骨组织暴露增多,且止血困难,失血随之增多[7,9]。文献报告[6]截骨术使术中大失血发生的风险增加4.64倍。
③ 术前Cobb角:Cobb角及侧弯曲率越大,手术难度也越大,为达到理想的矫正效果,可能会需要实施更多节段的融合和截骨术,导致更多的失血。文献报告[10],较大的Cobb角与脊柱侧弯患者术中失血增多相关,而另一项研究[6]发现,如果术前Cobb角>50度,则围术期大失血风险增高2.47倍。
④ 其他因素:身材矮小的患者发生围术期大失血的情况较多[6],但因其与术前Cobb角呈负相关,因而尚不能认为该因素是围术期大失血的独立危险因素。另外,伴有神经肌肉源性疾病的患者术中失血和输血的风险会增高[7,10-12],原因可能包括:患者需要融合的范围更广;需要前后路联合术式的可能性更大;患者往往更年轻,体重也更小;营养情况不佳;而且服用癫痫药物,可能会影响凝血功能。不过,目前认为脊柱侧弯的种类不是围术期大失血的独立危险因素。围术期大失血风险主要取决于手术类别和畸形严重程度,而非脊柱侧弯的病因[6]。
成人腰椎手术 ① 融合节段数:Nuttal等[13]回顾了行成人腰椎手术患者的情况,这些患者的平均融合节段数超过4个,研究发现导致异体输血风险增高的因素之一为后路融合节段数增加。其他一些学者也得出了相似的结果[14,15]。
② 术前血红蛋白水平:研究发现,术前低血红蛋白是导致异体输血风险增高的因素之一[13]。此外,Zheng等[14]的研究发现,腰椎融合修补术患者的术中失血量与术前血红蛋白水平呈负相关。
③ 其他因素:除上述影响因素外,文献报告的影响术中失血和输血的危险因素还包括肿瘤手术、肺部疾病史、高BMI、男性、年龄等[13-16]。但各项研究之间结果并不十分一致,仍需进行进一步探讨。
肝脏手术
肝脏手术的相关研究主要集中在肝移植手术。由于患者预先往往存在凝血功能异常、门脉高压、门静脉血栓、腹部手术史或巨脾等因素,肝移植术中失血和输血很常见。因而做好术中大失血和异体输血的预测是非常必要的。总体而言,预测术中大失血或输血的危险因素主要包括以下几个方面。
肝脏病变严重程度 肝脏病变严重程度可采用Child-Pugh分级、联合器官共享网络(UNOS)分级或终末期肝病模型(model for end-stage liver disease,MELD)评分来衡量。其中Child分级对肝病严重程度的评判是通过评估腹水情况、肝性脑病、血清白蛋白、胆红素等来实现。而MELD则是依据未来几个月患者对肝移植需求的紧迫性进行评分[17]。在一项对526例肝移植的多元线性回归分析中,Mangus等[18]发现术中失血量的预测指标为年龄、MELD评分、基础血红蛋白水平、基础纤维蛋白原水平、基础中心静脉压,以及总的麻醉时间;而输血的预测指标包括年龄、MELD评分、基础血红蛋白水平、基础纤维蛋白原水平,以及总的麻醉时间。在另一项对510例肝移植术病例的研究中发现,通过术前指标未能准确识别术中出血的高风险患者[19]。同样的,一些研究发现,MELD评分、上腹部手术史、术前凝血功能异常、血红蛋白水平等均不是术中大出血或输血的危险因素,该研究的结论是对肝移植术中出血和输血进行预测的临床意义不大,术前应该常规准备血液制品[20]。
术前凝血功能 Massicotte等[21]在一项纳入206例肝移植病例的回顾性研究中发现,与红细胞输注量相关的最重要的三个变量分别为术前基础国际标准化比值(international normalized ratio,INR)、基础血小板计数以及手术时长,且血浆输注并不会降低红细胞输注量。另一项纳入300例成人肝移植患者的研究发现,血尿素氮水平和血小板计数与输血具有独立相关性[22]。Ramos等[23]发现,术前凝血参数与术中输血需求之间无显著相关性;然而,年龄、Child分级、术前诊断、血红蛋白水平和术中门腔静脉分流效果等因素与输血量之间的相关性接近有统计学意义的范围。因此认为术前将血红蛋白水平纠正到统一标准以及术中行门腔静脉分流术可降低肝移植术中的红细胞输注量。
其他影响因素 包括胆汁淤积、巨脾、术前血细胞比容、Piggyback术式的使用以及手术时间等[17]。此外,既往有上腹部手术史的患者伤口处会有新生的血管分布,可能会导致肝脏切开时的出血[17]。门静脉发育不全、供者肝脏尺寸过小、外科医师面临技术层面的挑战也是大量失血的预测因素。伴有慢性活动性肝炎的患者与原发性胆汁性肝硬化的患者相比术中需要更多的血液制品[24]。接受移植的患者体重比不足、移植物保存不良、冷却血时间的延长也与术中出血倾向增加相关[24]。
由于对肝移植手术术中大出血的预测受各中心手术操作技术及常规的影响较大,一些学者[25]建议各中心各自评估其预测值,以便识别本中心的围术期大出血及输血高危患者。
心脏手术
心脏手术常伴有大量血液丢失并需要输注大量红细胞,而过多的血液流失与死亡率息息相关。许多医疗机构术前常规为择期冠状动脉旁路移植术(coronary artery bypass graft,CABG)交叉配血4单位红细胞,但患者的自身状况和危险因素会影响实际的输血需求[26]。红细胞输注在不同医疗中心的差异巨大,与各中心的输血习惯、患者相关指标(如术前贫血)和手术相关指标(如手术复杂性)相关[27,28]。
总结现有研究结果发现,术前贫血及低体重与围术期输血需求相关[29];女性较男性输血风险高,但考虑到女性患者的术前血细胞比容通常较男性患者低,或许性别本身并非是影响输血的独立危险因素[30-32]。此外,左心室射血分数(LVEF)、术前肌酐水平、年龄、体外循环时间、术中血红蛋白浓度最低点,以及手术者本身均与围术期输血风险具有相关性[26,27]。
严重创伤手术
对于伴有出血性休克的严重创伤患者来说,快速的外科手术干预以及大量血液制品的输注是非常关键的。如果持续出血导致了血流动力学的不稳定,表明需要及早地在急救室给患者输注红细胞。因此,血制品必须以最快的速度输送至休克患者[32]。及时启动大量输血策略不仅与提高生存率相关,还与降低输血量相关。因此,这对医师如何预测患者输血需求提出了更高的要求[33],但早期识别输血高危群体却较为困难[34]。
Clarke等[35]在一项回顾性研究中提到,与大量输血显著相关的四个因素包括心率、收缩压、碱缺失程度和血红蛋白水平。与对腹部和四肢损伤严重程度进行评估相比,研究者强调用更为客观的生理参数来预测大量输血的风险。此外,腹部超声下游离液体情况、骨盆环骨折情况、年龄、是否为交通事故以及摔落的高度等也可用于预测输血需求[36]。Clarke等[35]提出了更为简单的预测方法,即血细胞比容低于30%、失血超过500 mL并需要行急诊手术,但血细胞比容、凝血酶原时间等指标在创伤复苏的初始阶段常常不易获得。
不同类型手术的
输血风险预测模型的建立
在识别输血危险因素的基础上,国内外众多学者建立了不同类别手术的输血风险预测模型,以下将分别进行介绍。
头颈外科手术
输血预测和风险评估模型 Weber等[3]用逻辑回归的方法得出输血预测和风险评估(transfusion prediction and risk assessment,TPRA)模型,输血的可能性(probability,P)=eu/(1+eu),其中u=-3.909+2.120×皮瓣重建+1.710×术前血红蛋白水平+0.775×肿瘤期别。取值规则如下:皮瓣重建:0=否,1=是;术前血红蛋白水平:0=大于等于正常,1=小于正常;肿瘤期别:0=不是T3或T4,1=T3或 T4。之后,Krupp等[5]对TPRA模型进行了验证,结果显示TPRA模型可以识别高异体输血风险的患者,为有关术前血液保护策略(包括血型测定、交叉配血、术前自体血采集及使用促红细胞生成素)的制定提供依据,使其更符合成本效益原则。
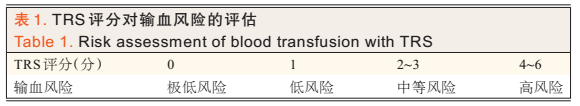
输血风险评分 对于需要行游离瓣重建的头颈外科大手术,Shah等[4]的输血风险评分(transfusion risk score,TRS)可以用来更精确的进行术前风险分层。P= eu/(1+eu),其中u=-2.46387+0.616173×(女性为1,男性为0)+0.626568×(T3或T4期为1,否则为0)+0.738331×(BMI低于正常为1,否则为0)+1.550929×(术前血红蛋白水平低于正常为2,否则为0)+0.694586×(行骨性游离瓣重建为1,否则为0)。为了使其临床应用更简便,进一步得出输血风险评分。其中性别:女性为1分,男性为0分;肿瘤分期:T3或T4期为1分,否则为0分;BMI:低于正常为1分,否则为0分;术前血红蛋白水平:低于正常为2分,否则为0分;重建类型:骨性游离瓣重建为1分,否则为0分。分值相加即为TRS评分,所对应的输血风险见表1。该模型使用简单,可用作临床术前患者咨询和风险分层。
骨科手术
胸腰椎手术脊柱手术输血预测模型 Lenoir等[16]基于患者术前数据创建了脊柱手术输血预测模型(predictive model of transfusion in spine surgery,PMTSS),预测成人脊柱手术患者输注红细胞的可能性。评分计算方法见表2,将各项得分相加,即为PMTSS得分(如果手术需要椎弓根截骨术则直接计为4分)。再由以下公式计算输血可能性:P=1/1+e(B×PMTSS评分+A),其中B=1.61,A=-4.56。此模型已得到前瞻性研究验证,可能会对改善围术期血液合理分配有所帮助,但因其为单中心研究,因此具有一定局限性。