数字PCR(digitalPCR,dPCR)是近年来引起重视并迅速发展 起来的一种突破性的定量分析技术。1992年Sykes等检测复杂背景下低丰度的IgH重链突变基因时,利用样品的有限稀释,让每个孔中只获得单个模板分子,通过计算PCR后的扩增信号,以期准确地确定起始分子的数量,虽然没有明确提出“数字PCR”的概念,但是已经建立了数字PCR基本的实验流程,并且确定了数字PCR检测中一个极其重要的原则——以“终点信号的有或无”作为定量方法。这是数字PCR的雏形。1999年Vogelstein等在检测粪便中进行癌变组织脱离细胞的BRAF特异突变型基因时,因受到体细胞基因的干扰,而碰到检测灵敏度和检测分辨率的瓶颈,而采用了在384孔板中对每个反应孔的样品量进行极限稀释并增加反应孔数进行检测的方式,从而提出了数字式PCR的概念,同时也提出如果采用更多孔板其检测灵敏度会更高,从而指出了数字PCR系统的发展方向。
原理
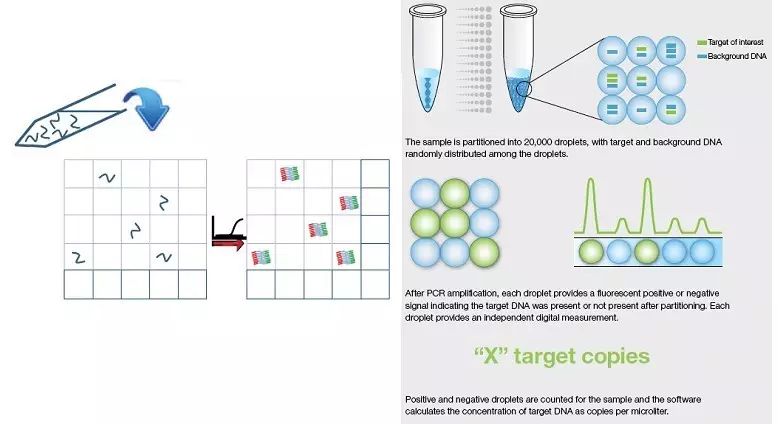
标准PCR反应体系经过微滴发生后,分配到约20000个微滴中,每个微滴包含或不包含一个或多个拷贝的目标分子(DNA模板),实现”单分子模板PCR扩增”,扩增结束后,含有核酸分子模板的微滴会给出荧光信号,没有模板的微滴就没有荧光信号产生。最终根据泊松分布原理以及阳性微滴的比例,分析软件可计算给出待检靶分子的浓度或拷贝数。数字PCR可以直接计算目标序列的拷贝数,因此无需依赖于对照样品和标准曲线就可以进行精确的绝对定量检测;此外,由于数字PCR在进行结果判读时仅判断有/无两种扩增状态,因此也不需要检测荧光信号与设定阈值线的交点,完全不依赖于Ct值的鉴定,因此数字PCR的反应受扩增效率的影响大大降低,对PCR反应抑制物的耐受能力大大提高;数字PCR实验中标准反应体系分配的过程可以极大程度上降低与目标序列有竞争性作用的背景序列浓度。计算给出待检靶分子的浓度或拷贝数。
应用领域
| 领域 | 具体方向 |
| 临床诊断 | 无创产前诊断 |
| 癌症标志物检测 |
| 病毒检测 |
| 拷贝数变异分析 |
| 基因表达分析 | 基因表达分析 |
| 单细胞基因表达分析 |
| 二代测序 | 测序结果验证 |
| 测序文库质控 |
| 转基因成分定量 | 转基因成分分析 |
| 微生物检测 | 水样微生物检测 |
| 病原微生物检测 |
临床应用领域:
肿瘤早期筛查
微滴式数字PCR技术作为迄今为止最灵敏的检测肿瘤细胞突变DNA的手段,可有效应用于肿瘤的早期筛查。微滴式数字PCR技术可以通过检测患者外周血样对进入外周血循环的肿瘤组织核酸进行分析,相对于传统的PCR检测方法,有更高的灵敏度,可以更好的胜任稀有变异检测的工作,实验数据证实微滴式数字PCR可以实现0.001%的突变频率筛查。
肿瘤病理学辅助诊断
微滴式数字PCR的一个主要优势是所需样本量很低,这对于临床来说特别有意义,尤其是当病理样本太少时,DDPCR可以帮助检测突变,来辅助诊断对药物的敏感性。另外在肿瘤均质细胞内检测单一突变相对简单,但是如果在异质细胞内,在仅存有少量携带突变肿瘤细胞的情况下,突变的特定等位基因是否可以被准确检测到,直接影响到靶向治疗是否有效。微滴式数字PCR 在进行突变/稀有变异检测中发挥着重要的作用,是临床肿瘤样本靶向药物分子检测的不二之选。
肿瘤负荷的实时监控
微滴式数字PCR技术由于可以检测外周血循环细胞中微量肿瘤细胞突变DNA,成为进行肿瘤负荷实时监控的有效手段,判断患者体内肿瘤细胞负荷更加科学、可靠、及时。
药物耐药突变外周血监控
目前,许多肿瘤常规化疗效果差,预后不良是困扰临床的重要难题,而肿瘤多药耐药性则是肿瘤化疗失败的关键因素。经治疗后,残存的肿瘤干细胞耐药性形成,常导致对某些药物治疗敏感性降低,并引起肿瘤复发甚至转移,因此,对药物耐药突变的筛选和监控成为当今医学界研究的热点。
技术优势
通过把样本稀释成许多部分,然后在一个反应发生的时候对其进行计数。其灵敏度高达0.001%,显著高于扩增阻滞突变系统(0.1%)和Sanger法测序(10%)。同时能克服核酸降解的不利影响,非常适合一些稀有样本中核酸的精确检测。
1.高灵敏度、高特异性检测复杂背景下的靶标序列
灵敏度可达0.001%,样本珍贵或者样本核酸存在降解时的最佳选择。在穿刺样本、胸腹水、外周血中即可完成靶标序列的检测。
2.所需样本量少
200ul血浆或1ml全血/ 2-3片白片/ 纳克级活检组织。
3.实验数据分析便捷
每个微滴的检测结果以阴性、阳性判读,数据分析自动化。
4.可统计突变率
真正意义上的绝对定量,通过统计分析可得出靶点的突变率。
(来源:邦菲生物 http://www.bangfeibio.com/ddpcr/)
基于ctDNA检测的液体活检在肿瘤治疗中的价值正逐渐为人们所接受,它以相对无创的取样方式,实现靶向治疗前药物靶点的筛选和治疗过程中相关耐药突变的检测。随着分子生物学技术的发展,已经出现了多种ctDNA检测技术,如ARMS PCR、数字PCR、BEAMing及高通量测序等。其中微滴式数字PCR (即ddPCR) 能够以简便的检测流程对ctDNA特定位点突变进行快速、定量、高灵敏度的检测,从而表现出巨大的临床应用价值。

ddPCR原理简介
微滴式数字PCR(ddPCR)在传统的PCR扩增前对样品进行微滴化处理,将含有核酸分子的反应体系分成成千上万个纳升级的微滴,其中每个微滴或不含待检核酸靶分子,或者含有一个至数个待检核酸靶分子。经PCR扩增后,逐个对每个微滴进行检测,有荧光信号的微滴判读为1,没有荧光信号的微滴判读为0,根据泊松分布原理及阳性微滴的个数与比例即可得出靶分子的起始拷贝数或浓度。
适合于拷贝数变异研究、复杂来源样品中含量极低核酸分子的检测、NGS数据验证、NGS测序文库的鉴定、miRNA等差异微小的基因表达研究。
优异转化体的创制是作物转基因育种过程中的关键环节。由于组培转化过程导致了T-DNA区的随机性插入和可能的细胞质变异,因此优异的转化体需要满足以下条件:T-DNA单拷贝插入基因组非功能区;外源基因正常表达、目标性状表现良好;片段整合、基因表达、性状表现共分离且稳定遗传;无非预期效应(除目标性状外,其他农艺性状无变化)。优异转化体通常的创制方法是获得一定规模的独立转化苗,再逐项淘汰不符合条件的转化体,最终得到最优的事件进入下一阶段的安全评价和育种流程。由于初始的转化苗数量庞大(可能有几百上千株),检测的指标又多(拷贝数、插入位点、基因表达、目标性状表现、其他农艺性状),因此在综合考虑目标、成本、效率等诸因素的基础上制定一套合理的优异转化体筛选流程将至关重要。
近几年,定量PCR(quantitativepolymerase chain reaction, qPCR)技术获得了突破性的发展,不仅结果更准确而且成本急剧下降。其相对与传统Southern杂交技术极低的成本、极短的试验周期以及较高的淘汰率(至少50%的转化苗为阴性或多拷贝),使得应用qPCR检测拷贝数成为了转化出苗后排在首位的检测项目。经过qPCR的筛选,后期基因表达、性状鉴定、田间调查的任务量将大大缩减。然而,由于qPCR检测拷贝数的结果不像Southern杂交那样绝对准确,它只能满足“低拷贝”的检测要求,至于“低拷贝”具体是一个还是两个拷贝,qPCR将很难给出确定的结果,因此仍然需要后期Southern杂交技术的辅助验证。
微滴式数字PCR(droplet digital PCR, ddPCR)技术的最大优势是能够确定核酸分子的绝对数目,因此它可能成为解决qPCR技术痛点的最好替代。该方法的应用将会使得拷贝数的筛选结果更加精准,从而导致整体筛选效率的大幅提升。最近,美国农业部的科研人员以水稻、柑橘、马铃薯、玉米、番茄、小麦这六个转基因技术广泛应用的主要作物为对象,分别建立了适用的ddPCR检测外源基因拷贝数体系。这将为这些作物优异转化体的创制工作带来极大的便利,同时为ddPCR技术推广到其他作物上提供参考。
Collier R, Dasgupta K, Xing Y, et al. Accurate measurement of transgene copy number in crop plants using droplet digital PCR[J]. Plant Journal, 2017. http://onlinelibrary.wiley.com/doi/10.1111/tpj.13517/pdf
(来源:莱肯生物 2017-02-28 )














