健康君说
端端酱是我们的读者已经很熟悉的作者,就在“HPV9价疫苗8天火速上市”的几天前,她写作了一系列关于HPV(人乳头瘤病毒)疫苗的文章,不同于一般的科普,端端酱希望大众能通过这支疫苗看到当下中国社会的一些困境、问题和迷思。
我们对系列文章稍作添改,将在近期陆续分享给大家。
作者简介
袁端端,暨南大学毕业,南方周末记者,专注深度医疗健康报道。从媒体人的视角剖析健康热点,科普背后的科学,唤起社会对健康相关问题的重视。

早在五年前,
端端酱就开始关注这一疫苗,从和所有人一样期盼尽早上市。但在时间演变中,HPV疫苗成为了一个观察中国医药行业与社会互动中的窗口。
第一支HPV疫苗在中国内地被批准的两年来,经历了任何一种新药都没有的曲折
,民众、企业、政府在法规变革和经济上涨、对外开放多方推动下形成了一种扭曲的合力。这一力量,让一些人盲目追捧、让一些人半信半疑、还让一些人对政府愤怒、对企业无奈,最终发展成典型的舍本逐末,真正有需要和适龄者并没有受益的怪现状。
科学家发现,全世界各地99.7%确诊的宫颈癌患者可以检测到人类乳头状瘤病毒,可以看出HPV病毒和宫颈癌之间密不可分的关系。而这其中,70%的宫颈癌切片中都发现了HPV16和18型病毒。
这一重大发现使科学家最终能够研发出保护人们不受高风险HPV16和18型病毒感染的疫苗
——
人乳头瘤病毒疫苗
(HPV疫苗)
,该疫苗的保护率超过了95%。2008年,诺贝尔医学奖就授予了揭示HPV和宫颈癌之间的关系的德国学者豪森
(Hausen)
,其实中国学者周健是最早的HPV疫苗研究者,只可惜英年早逝。
1991年,澳大利亚昆士兰大学免疫和代谢研究所的伊恩·弗雷泽和中国科学家周健合作,利用重组DNA技术制造出一种外形与HPV极为相似的“HPV病毒样颗粒”,并证实其内部不含导致疾病的DNA,却能刺激身体产生针对HPV的免疫反应。
严格来说,HPV疫苗不能等同于宫颈癌疫苗,但也确实是唯一一种把预防癌症写进说明书里的疫苗,为了方便公众理解,在这一系列文章中两者意义等同。
如今,这一疫苗在超过130多个国家和地区已获批上市,包括中国香港和澳门特别行政区、中国台湾,以及亚太地区的澳大利亚和日本等。国际上的主要卫生机构,包括世界卫生组织、美国疾控中心、加拿大卫生部、欧洲医药管理局,以及澳大利亚治疗产品管理局等均推荐使用,HPV疫苗也成为预防HPV感染的一级预防。
关于HPV疫苗在中国的前传和审批波折,有兴趣的读者可以参阅端端酱在2014年发表的文章
《160国家已上市,FDA、WHO力挺 宫颈癌疫苗:国内为何独缺席》
,这篇文章不再赘述。
(注:两篇文章中产生冲突的部分,以日期新的为准,毕竟知识在更新,认识在完善,有不准确的也希望专业认识留言指出:)
8天上市的9价疫苗与被质疑的审批程序
2018年4月20日,默沙东在中国提交的9价人乳头瘤病毒疫苗
(HPV疫苗)
的上市申请获得国家药品审评审批中心
(CDE)
承办受理。
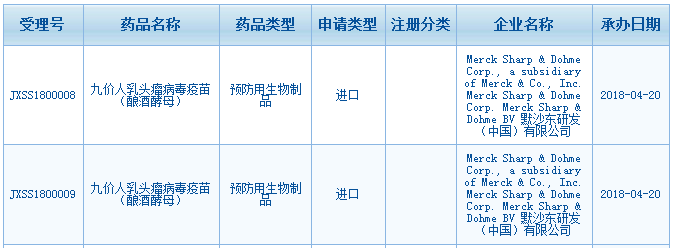
(CDE网站截图)
从注册受理进度上看,这一疫苗从2015年11月开始申请国内临床,到2017年11月拿到临床批件,再到2018年4月递交上市申请,申请临床用了两年,而从临床到上市只有五个月,
推测应该是豁免了国内临床试验,采用境外已上市数据审评。
按照进度,最快2018年内就会上市。
没想到,
距离默沙东提交申请日4月20日,只过去了8天——
4月28日,国家药品监督管理局有条件批准用于预防宫颈癌的九价人乳头状瘤病毒疫苗上市。网络上舆论沸腾,称“史无前例的火速过审”。
不过,国家药审中心一位专家也告诉端端酱,“此次获批的9价疫苗为国外已经上市的产品,药审中心接受了境外临床实验数据,但也明确要求企业制定风险管控计划,按要求开展上市后研究工作。”
上一次舆论热议这一疫苗不过是十天前,4月11日总理到访上海复旦大学附属华山医院。当地负责人向其汇报了HPV宫颈癌疫苗供应使用情况,指出
“
二价疫苗供应基本可以保障,四价疫苗供应需提前预约,而九价疫苗内地尚未上市,需求者必须数次往返香港等境外地区和国家才能接种
”。
总理热切关心群众,指示有关部门一定要加快审批,保障供应,让有意愿的群众尽早就近用上最新HPV等防癌疫苗。

总理在华山医院。
尽管这一次,大众媒体和普通人对这一消息的反馈都很积极正面,但回想起第一支HPV疫苗在中国获批时的状况,仍令人反思。
2016年,7月18日,葛兰素史克
(GSK)
宣布其预防女性宫颈癌的疫苗Cervarix希瑞适@获原国家食药监总局
(CFDA)
的上市许可,成为我国首个获批的预防宫颈癌HPV疫苗。就在当天,我随即写了文章,
“
盼了十年,宫颈癌疫苗终上市
”
。这里的十年,指的是从该疫苗初次在国内申请的2006年到获批的2016年。
但很快,自媒体上的文章标题变成了
《迟了十年,宫颈癌疫苗才上市》
。一个
“迟
”
字,掀起了公共舆论场上的讨伐。一些悲情故事开始用身患宫颈癌的病人为例,悉数没有这一疫苗所带来的悲痛后果
(事实上,如果按时筛查,宫颈癌完全可以避免,后面会提到)
。

真的是迟了十年吗?
我们知道,全球第一个HPV疫苗是默沙东公司
(MSD)
在2006年上市的4价疫苗
(针对HPV16、18、6、11型病毒感染
)
,后两种病毒可导致生殖器疣。随后,2007年英国葛兰素史克公司
(GSK)
生产的2价疫苗
(针对HPV16、18型)
也在全球许多国家获准上市。而九价疫苗则是在2014年12月14日才首次经美国食品药品监督管理局
(FDA)
批准上市。
批评中国HPV疫苗审批慢,首先得明白,
一个新药(疫苗)从研发到上市最重要、也是消耗资金、人力、物力最大的环节是临床试验
(借今日话题的图为例说明)
。
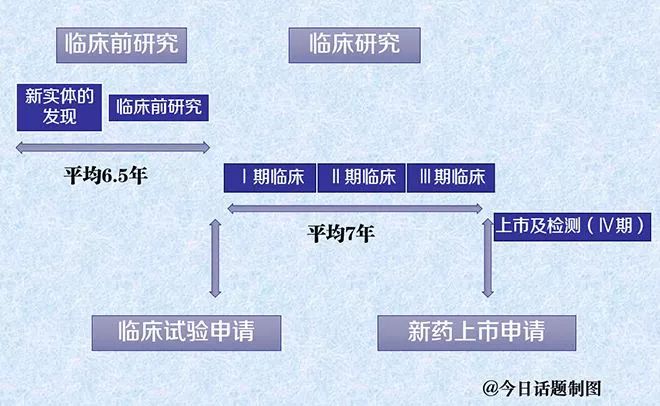
查阅数据库发现,默沙东这款疫苗的首次临床试验是从1997年开始的,而GSK则是1999年,都在美国。即便两家都通过快速通道审批上市,试验时间长达8年。可见FDA第一次批准针对癌症预防的疫苗,也是慎之又慎。
当时,中国对进口药的审批流程是,在国外已上市但中国未上市的新药必须到中国再做一个Ⅲ期临床试验
(临床试验一般分为I、II、III期)
,这让众多外企极为不满
(拖延上市时间、投入巨大成本)
,却不得不做。
需要明确:这不是针对HPV疫苗的特殊政策,按照当时药品注册管理法规定,进口药企在中国申请新药注册,应当进行符合技术要求的中国本土人群临床试验
。
FDA、欧盟、日本等国家和地区也都没有完全互相认可对方的新药。而疫苗审批在所有国家的药品审批体系都是最严格的,这点我们和全世界一样。
两家药企几乎都是一拿到FDA的批准就开始中国的注册之路。
根据端端酱此前采访,GSK在还未获得FDA批准之时,就已开始在中国招募志愿者,为进入中国市场做准备。2008年起,江苏省疾控中心朱凤才等承担GSK的HPV疫苗的临床试验,试验在徐州市、淮安市涟水县展开。徐州疾控中心于2008年10月以免费接种的名义招募1600名志愿者,之后1623妇女免费接种了HPV疫苗,加入临床试验。
一般来说,从女孩或青春期女性中采集宫颈标本既不现实,也不符合伦理规范,因此参加试验的主要是年轻你女性。一些免疫桥联研究将HPV疫苗在 9~14 岁女性和15~26 岁女性中使用后的免疫原性作了比较,从中推测疫苗在年龄较小的女孩中使用的临床效力。
而默沙东则在2009年2月起,在浙江大学医学院附属妇产科医院等医院进行为期3年的HPV疫苗
Ⅲ
期临床试验。
彼时,中国的临床试验体系、机制、人员都十分缺乏,从招募试验对象到选择合适的临床医院到分析结果,每一步都漫长而复杂。
到了2012年,按理说两家的三期试验都已做完,应该可以申请上市了。
然而,2013年,CDE对GSK和默沙东的这两种HPV疫苗在审评注册上市资料之后的结论却是不批准,需要继续补充试验和数据。
2014年,参与这一疫苗试验的浙江大学医学院附属妇产科医院程晓东主任医师告诉端端酱,他们正在做补充性临床试验。默沙东当时也承认,扩展性试验将于2015年完成。
为什么要延长做试验的时间?我一开始也没有懂,医生只是告诉我说,审批部门说数据不够,必须继续追踪结果。
后来端端酱才知道,在中国大陆,默沙东的临床试验人群为3000人,葛兰素史克为6000人,按现有标准,两家企业样本量、重度感染的指标都绝对不够。通俗的说是,试验结果没有达到初始设定的目标。无论是哪国的药品监管部门,都不可能看到不合格的数据就批准的。
更直白的说,让整个审批时间拖延的最大原因
(注意不是全部原因)
,不是人们诟病的药监部门的审批制度,而是没有足够多的试验人群和数据,导致没有达到试验的初始设定目标。
这可能是很多批判者未曾想到的,也是企业选择没有告诉你们的。
“美国FDA的临床试验有4万人,现在(我们的)癌前病变的人数还不到十个,还一直在等。
”
中山大学肿瘤防治中心宫颈癌诊治单病种管理首席专家刘继红在2014年时告诉端端酱,至少要有17个才具有统计学意义。
数据不足也得到了其他专家的确认。查询FDA数据发现,MSD的项目包括30,000名妇女进行四次大的研究,平均随访三到五年,葛兰素史克公司的研究相类似。
因此,到了2014年,社会舆论在并不了解其中真正原因的情况下就开始猛烈批判监管部门为何不批这一疫苗。HPV疫苗也成了多年至今批评药监部门审批缓慢进而造成“药滞”的典型案例。
责难药监固守标准,不愿采纳WHO建议
在此起彼伏的批评声中,学者、机构甚至企业都会告诉大众,不达标的原因是——
“当时中国药监部门采用了不顾大众健康且更为苛刻的评价标准
”
。
且不说这是否有错,我们先来分析一下,是不是用了更苛刻的指标。
(下面会有些专业,不过端端酱相信你们能看懂:)
无论是做任何临床试验,试验前都会设定一个
终点指标
(End Point)
,这个指标是试验设计者知道会达成的,如果没有,则试验不成功。一般还会分为主要终点和次要终点
(Primary、Secondary
end
point)
。
2014年之前,科学界公认HPV疫苗的有效性评价终点是发生癌或者出现宫颈上皮内2级以上瘤变
(癌前病变)
。
具体来说,指在试验人群中,一半人打疫苗,一半人打安慰剂,而注射了安慰剂的对照组,必须出现有足够统计学差异数量的癌或癌前病变,才算有结果。出于伦理学等考虑
(等出现癌变太不人道)
,默沙东和GSK疫苗在做大规模试验时,都选择了以2级以上的癌前病变和HPV持续感染为复合终点,和当时在FDA申请批准时一样。

大家可以看一下上面
↑↑↑
的截图是WHO在2009年的立场文件,CIN指宫颈上皮内瘤变,是癌前病变,分为1、2、3级。
不过,问题在于,由于FDA在全球药品审评体系中的顶尖地位,很多国家一旦看到FDA通过了某种新药,在进口时便不需要重复试验,或在本国试验时降低标准,以缩短时间,尽快引入新药。

传说中的FDA
在HPV疫苗上,这一问题更加明显。
据中国医学科学院、北京协和医学院肿瘤研究所的乔友林教授对端端酱介绍,
中国、印度和日本都是需要进口药在本土重做临床试验的国家
,但在HPV疫苗试验上,印度和日本均采用了更为宽泛的标准作为临床终点,缩短了临床试验时间,疫苗很快上市。中国则不然。
这就不得不说到,2014年4月1日,WHO发布了
《预防HPV疫苗试验的主要终点专家小组报告》















