

摘 要:脓毒症是临床危重病患者死亡的常见原因。中药黄芪由于具有补气升阳、托毒排脓的功效,近年来,临床上使用黄芪及其制剂用于脓毒症治疗的报道越来越多,同时黄芪及其活性成分对脓毒症模型动物的干预效果及其机制研究也成为热点。主要从调节免疫功能、改善炎症反应和微循环障碍、改善多器官损伤等角度,综述了黄芪药材及其活性成分在脓毒症的临床治疗和作用机制研究中的研究进展。

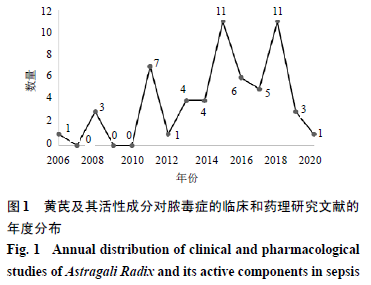
脓毒症是重症医学面临的重要临床问题,其发病率不断上升,每年全球新增数百万脓毒症患者,其中超过1/4的患者死亡[1]。中西医联合治疗脓毒症的有效性、安全性已被证实,可明显增强疗效、缓解病情、提高生存质量[2]。黄芪作为补气诸药之最,通过扶正固本的治法在临床上广泛应用于脓毒症及其并发症的治疗。本文以中国知网数据库、Pubmed数据库和Web ofScience数据库为资料来源,检索2020年2月之前发表的有关黄芪及其活性成分对脓毒症的临床和药理研究文献,经过研读后共获得57篇文献。自2006年首篇文章发表以来的年度发文趋势见图1。本文全面综述了黄芪药材、活性成分及其制剂对脓毒症的干预效果及可能药效靶点与作用机制,其中通过调节免疫功能治疗脓毒症文献有18篇,占比31.6%;通过调节微循环障碍和炎症反应治疗脓毒症文献有8篇,占比14.0%;涉及治疗脓毒症并发症的文献有26篇,占比45.6%;涉及多种机制治疗的文献5篇,占比8.8%。
1 黄芪和脓毒症的概述
1.1 黄芪的活性成分及其药效作用
黄芪是来源于豆科植物的蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus(Bge.) Hsiao或膜荚黄芪A. membranaceus (Fisch.) Bge.的干燥根,其主要活性成分是黄酮类、三萜皂苷类、多糖类。临床研究显示,黄芪具有调节免疫、抑制炎症反应、抗氧化、抗肿瘤、抗感染以及对心脑血管、肝脏、平滑肌的作用[3-4]。多通路调节作用是中医药改善脓毒症免疫功能的极大优势[5]。近年来,临床上使用黄芪及其制剂(黄芪注射液)用于脓毒症治疗的报道越来越多,同时黄芪及其活性成分黄芪甲苷(astragaloside Ⅳ,AS-Ⅳ)、黄芪多糖(astragaluspolysaccharides,APS)对脓毒症动物的干预效果及其机制研究也成为热点。从现有文献来看,黄芪及其有效成分可以在细胞免疫、体液免疫、非特异性免疫等多方面改善免疫系统失衡和改善微循环障碍,同时积极治疗脓毒症带来的并发症[6]。
1.2 脓毒症及其动物模型
脓毒症是由感染引起的全身炎症反应综合征,全球每年脓毒症的病例数仍在增加,如不及时治疗或治疗失败可能导致休克或多器官功能障碍综合征[7]。随着研究的深入,发现脓毒症的发病机制极其复杂,目前的研究包括炎症反应、免疫功能、信号转导机制、凝血功能障碍等一系列问题,与机体多系统、多器官的生理病理情况密切联系。
实验室模拟人类脓毒症情况,建立不同动物模型。综合文献分析[8-10],常用的脓毒症模型主要分为3种:(1)细菌感染,如腹腔污染和感染模型;(2)毒血症模型,如脂多糖注射;(3)屏障破坏性模型,如盲肠结扎穿孔。脂多糖给药和腹腔污染和感染模型相似,炎症反应更强、更快速,血清促炎细胞因子水平迅速升高,器官有氧化应激早期迹象,各器官有明显的免疫细胞浸润,是静电的脓毒症和脓毒症休克的微循环障碍的适用模型;盲肠结扎穿孔诱导的炎症反应相对较少,但炎症反应更为持久,适用于模拟给药导致脓毒症迟发性发展的模型。
2 黄芪及其活性成分对脓毒症的药效作用及其可能作用机制
2.1 调节免疫功能
脓毒症的主要发病机制包括免疫功能抑制,尽管免疫治疗可在一定程度上降低患者的病死率,但是临床仍缺乏较为理想的提高脓毒症患者的生存率的干预方法[11]。各种实验证明,黄芪具有有效调节脓毒症免疫功能失衡的作用。
吴胜喜[12]和陈扬波等[13-16]观察治疗前后脓毒症患者的免疫功能、炎症细胞以及临床疗效的变化,发现相比于对照组,黄芪注射液通过改善非特异性炎症反应和促进特异性免疫系统恢复,从而实现改善脓毒症患者的病情。沈丽娟等[17]研究发现服用不同剂量的黄芪颗粒均能改善免疫功能失衡,通过调节血小板活化因子(platelet sctivating gactor,PAF)实现,作用随剂量升高而增加。Huang等[18]和袁保红等[19]分别对脂多糖诱导的小鼠脓毒症前期的腹膜炎和盲肠结扎穿孔致脓毒症模型小鼠进行干预,发现AS-Ⅳ能增加中性粒细胞抗菌作用和降低小鼠各器官中细菌负荷量,从而实现免疫保护。于大猛[20]研究发现黄芪注射液对盲肠结扎穿孔引发的脓毒症有调节免疫失衡作用。张小凡[21]研究认为,APS可能主要在脓毒症后期免疫抑制中发挥作用,通过对树突状细胞(dendritic cell,DC)干预进行保护。闫智杰等[22]通过研究黄芪多糖对脓毒症大鼠细胞因子和免疫功能的影响,发现APS可以双向调节盲肠结扎穿孔致脓毒症模型大鼠的严重免疫紊乱,且可抑制炎症反应。涂丹娜等[23]研究表明黄芪注射液可影响盲肠结扎穿孔致脓毒症模型大鼠辅助性T细胞功能,抑制大鼠的炎性反应,从而改善免疫失衡情况。研究[24-26]表明AS-Ⅳ可以通过激活高迁移率族蛋白1抑制免疫功能,能够治疗高迁移率族蛋白1介导的炎症。Hou等[27]采用高、中、低剂量APS检测其对脓毒症小鼠T细胞功能状态和表型的影响,不同浓度的APS对脓毒症的免疫抑制和器官损伤影响不一。侯静静等[28]比较药物干预前后脓毒症患者的免疫细胞和细胞因子水平变化,发现黄芪注射液联合用药更能有效调整患者免疫功能失衡。朱美飞等[29]研究黄芪注射液对盲肠结扎穿孔致脓毒症模型大鼠胸腺细胞凋亡情况的情况。Liu等[30]认为APS可能通过抑制与T细胞(Tregs)结合的Toll样受体4(Toll-likereceptor 4,TLR4)而抑制CD4+CD25+T细胞的活性,一定程度上可能通过激活烧伤感染小鼠的CD4+T细胞来触发Th2向Th1的转移。黄芪通过调节免疫功能防治脓毒症的机制见表1。

2.2 改善炎症反应和微循环障碍
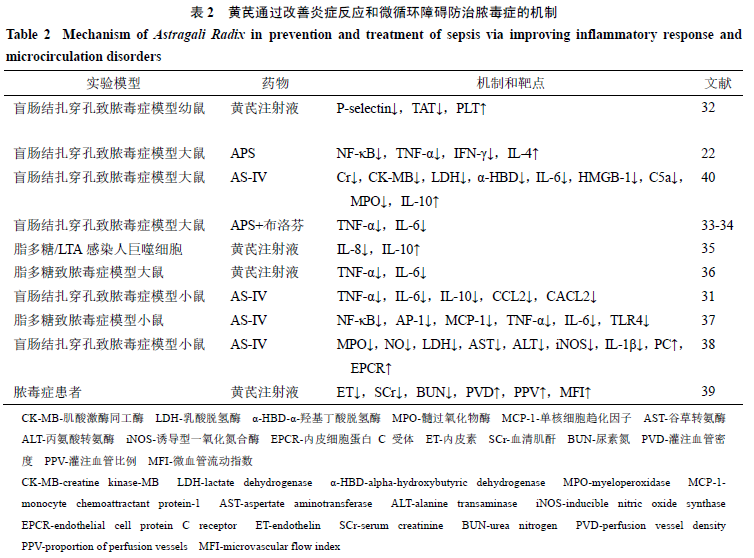
炎性反应和微循环障碍是脓毒症治疗研究的热点和难点,黄芪在治疗脓毒症过程中能清除体内氧自由基、改善体内微循环、调控炎症因子水平等。刘赟等[32]研究发现,黄芪注射液的早期干预,能调节脓毒症幼鼠的P-选择素(P-selectin)、凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)、血小板(platelet,PLT)的水平,改善微循环障碍。Liu等[33-34]研究APS和布洛芬联合使用对盲肠结扎穿孔致脓毒症模型大鼠的抗炎效果更好。徐奇奇等[35]研究发现黄芪注射液可抑制革兰阳性菌和革兰阴性菌脓毒症炎症反应中促炎因子的基因和蛋白的表达,以及促进抗炎因子的基因和蛋白的表达。杨淼等[36]研究发现,黄芪可能通过降低血浆内炎性因子实现抗脓毒性休克的作用。Liu等[31]发现AS-Ⅳ通过抑制炎症反应和抑制淋巴细胞的凋亡来保护小鼠抵抗脓毒症,存活率显著提高。Zhang等[37]研究显示AS-Ⅳ能调节NF-κB和核转录因子激活蛋白-1(activator protein-1,AP-1)信号通路,在心脏、主动脉、肾脏和肝脏都有观察到变化,从而有效预防或治疗脓毒症的炎症性疾病。莫菁莲[38]发现AS-Ⅳ对盲肠结扎穿孔致脓毒症模型小鼠的抗炎作用与调节蛋白C系统有关。孙良等[39]研究发现丹红注射液和黄芪注射液可改善重症脓毒症患者肾功能及微循环状态,二者在一定程度上有很好的效果,但不能改善患者预后。黄芪通过改善炎症反应和微循环障碍防治脓毒症的机制见表2。
2.3 在脓毒症并发的器官损伤中的研究
2.3.1 改善心脏功能 脓毒症可导致心脏收缩和舒张功能障碍,心脏功能障碍是一种可逆的常见的脓毒症并发症,其发生增加了脓毒症患者的死亡率[41]。黄芪有稳定血流动力学及改善心肌功能的作用,还能改善血液循环、增加心肌收缩力等,能降低患者的死亡率。
刘海峰等[42]研究发现脂多糖致脓毒症模型小鼠的心肌纤维细胞IL-1β蛋白表达能被黄芪多糖抑制,从而改善脓毒症引起的心功能障碍。王艳等[43]通过RT-PCR技术和Westernblotting技术分别检测出AS-Ⅳ可减少盲肠结扎穿孔致脓毒症模型大鼠心肌中Beclinl、p62、LC3的蛋白及mRNA的表达。薛其骏[44]和黄美红等[45]发现黄芪注射液在常规的治疗和护理基础上,可显著减轻脓毒症并发的心肌损伤,改善心功能。黄鑫等[40]研究发现,黄芪甲苷可以改善和保护脓毒症炎症影响的脏器功能,尤其减轻心、肺、肾组织损伤。邵萍[46]发现黄芪注射液可抑制蛋白质酪氨酸激酶/转导与转录激活因子信号通路转导活化,下调促炎因子和上调抗炎因子的释放,改善心肌细胞失衡和损伤。李梦非[47]研究发现AS-Ⅳ具有保护脂多糖诱导的脓毒症心肌病的作用,保护机制可能与NF-κB/过氧化物酶体增殖物激活受体α(peroxisome proliferator- activatedreceptor alpha,PPARα)信号通路有关。Wang等[48]对心肌细胞H9C2进行脂多糖处理,发现AS-Ⅳ可通过增加抗氧化酶活性、抑制脂质过氧化以及下调参与炎症反应的炎症介质来预防脂多糖诱导的心肌细胞损伤。Zhao等[49]认为AS-Ⅳ通过激活磷脂酰肌醇-3激酶/蛋白激酶信号通路和抑制NF-κB,显著减轻脂多糖诱导的心功能障碍和降低炎症介质的产生。程燕等[50]研究表明APS能够改善脓毒症大鼠左心室的收缩和舒张情况,抑制大鼠心室肌中TNF-α、IL-Iβ、IL-6的表达,减轻心脏损害。
2.3.2 改善胰腺功能 重症急性胰腺炎(severe acute pancreatitis,SAP)患者死亡重要原因主要是脓毒症和多器官功能障碍综合征。目前研究表明,SAP继发腹腔感染是其后期死亡的独立危险因素,因此有效预防腹腔感染所致的脓毒症,是减少SAP引起的死亡的重要方式[51]。王艳等[52]还发现AS-Ⅳ能减少盲肠结扎穿孔致脓毒症模型大鼠胰腺中Beclinl、p62、LC3的蛋白和基因的表达,从而减少胰腺自噬小体的形成。李宝贵等[53-54]考察APS对2型糖尿病合并脓毒症大鼠的胰腺线粒体氧化应激损伤情况,发现APS能减轻其氧化应激损伤。
2.3.3 减轻肝、肺、肾损伤 脓毒症最常见和最严重的并发症包括急性肝损伤[55]、肺损伤[56]和肾损伤[57]。赖敏等[58-59]研究发现AS-IV能够通过降低炎症反应,提高转录因子E2相关因子2(transcription factor E2 associated factor 2,Nrf2)和提高血红素氧化酶-1(heme oxidase-1,HO-1)的表达以及保护线粒体来减轻脓毒症肝损伤。罗成等[60]研究发现APS能通过升高丙二醛(malondialdehyde,MDA)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)水平以及促进半胱氨酸天冬氨酸蛋白酶-3(cysteine asparticacid protease 3,
















