表一
:抗体的主要应用
|
应用
|
详情
|
缩写
|
|
免疫印迹法
|
凝胶类型: 还原的, 天然的
裂解产物类型: 细胞裂解产物, 组织裂解产物, 免疫原过表达裂解产物
|
WB
|
|
单细胞免疫印迹法(single cell Western)
|
scWB
|
|
免疫组织化学
|
固定: 丙酮, 乙醇, 福尔马林/甲醛/多聚甲醛, 甲醇, 微波, 加热
包埋: 丙烯酸/塑料, 见如下
|
IH
|
|
包埋: 石蜡
|
IHC-P
|
|
包埋: 冰冻
|
IHC-F
|
|
自由漂浮切片法
|
IHC-Free
|
|
免疫细胞化学
|
|
IC
|
|
邻位连接技术
|
PLA
|
|
in-cell Western
|
ICW
|
|
流式细胞术
|
|
FC
|
|
细胞分选
|
FACS
|
|
免疫沉淀
|
|
IP
|
|
染色质免疫沉淀
|
ChIP
|
|
染色质免疫沉淀序列测定
|
ChIP-Seq
|
|
RNA免疫沉淀
|
RIP
|
|
交联免疫沉淀
|
CLIP
|
|
免疫测定
|
|
|
|
ELISA
|
ELISA
|
|
放射性免疫测定
|
RIA
|
|
酶联免疫测定
|
EIA
|
|
免疫-PCR
|
I-PCR
|
|
功能测定
|
|
|
|
激活
|
A
|
|
封闭/中和
|
Neut
|
|
电泳迁移实验
|
|
EMSA
|
|
|
|
|
质谱
|
|
MS
|
|
抗肽抗体稳定同位素标准和捕获
|
SISCAPA
|
|
免疫-MRM
|
I-MRM
|
|
免疫-MALDI
|
iMALDI
|
|
封闭/中和
|
Neut
|
|
质谱免疫分析
|
MSIA
|
抗体
即是B淋巴细胞抗原受体的可溶性形式,专门由成熟的B淋巴细胞产生。
抗体免疫球蛋白分子由2条重链和2条轻链构成,根据其结构不同,可以把小鼠和人体内的抗体分为五类亚型。抗体分子的各个链之间以二硫键相连,从而使整个分子具有一定的灵活性。分子中没有轻链的部分称为可变区或Fc段(可结晶部分);此区域是由一组固定的基因所决定,同一个种属中的所有同亚型抗体此区域是一致的。分子中既有重链又有轻链的部分称为恒定区或Fab段(抗原结合区); 此区域的极端包含识别并结合靶抗原表位的高可变位点。Fab段也是由一组固定的基因决定,但需要进一步的体细胞突变产生独特的和高特异的可变位点(图1)。
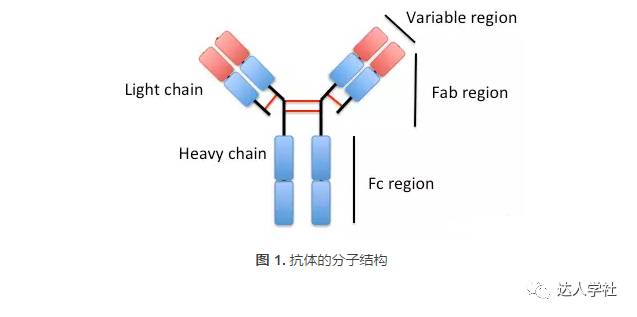
图 1.
抗体的分子结构
免疫沉淀
免疫沉淀(IP),亦称为“pull-down”实验,即抗体在细胞裂解液, 生物体液, 或其它溶液中标记和沉淀(“pull-down”)分离出相应的目标抗原。通过在抗体的Fc段结合不同类别微珠(例如磁性珠,琼脂糖,琼脂糖凝胶),再用离心或其他机械方法把抗体抗原复合物从总蛋白中分离出来(图2)。
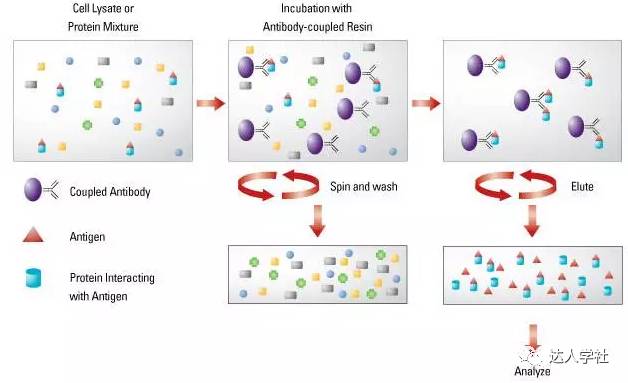
图 2.
标准免疫沉淀法的流程示意图。
IP检测在许多细胞和分子生物学研究很受欢迎。根据其最基本的原理,IP常用来纯化目标抗原以进行后续研究。IP也常用于研究稳态细胞或经过特定处理的细胞中的各种蛋白质之间的相互作用。在通过IP研究蛋白质相互作用时,其中一个已知蛋白的抗体将用于免疫沉淀步骤,随后再可通过如免疫印迹法(见下文)来确定与这个已知蛋白结合并共同沉淀分离出来的另一种蛋白分子。
免疫吸附实验
酶联免疫吸附试验(ELISA)用来对一个特定的可溶性蛋白分子进行定性和定量分析,如血清, 或液体的样品,如生物体液和细胞培养物上清液中的特异性抗体或蛋白质的有无及浓度。此方法是利用了聚苯乙烯检测板吸附蛋白质或抗体的能力及抗体特异性结合靶抗原的能力。一般来说,此方法可通过检测实验样品在一定波长下的吸光度,再结合已知的抗原或抗体浓度标准曲线,计算出检测样品中此抗原或抗体的浓度。有3种常用的ELISA检测方法。
直接ELISA法
直接酶联试验使用不同量化的单克隆抗体来确定溶液中的某种特定抗原的浓度。
例如,直接ELISA可通过测量细胞培养上清中的细胞因子含量从而确定此群细胞(经刺激或抑制处理)分泌细胞因子的水平。
直接ELISA法常以“三明治”法进行,即两种单克隆抗体通过不同的抗原表位结合在同一个靶抗原上,把靶抗原夹在中间。首先把“捕获”抗体包被在测定板上。然后在洗涤和封闭后,将待测溶液加入到测定孔中,让“捕获”抗体去捕获溶液中存在的靶抗原。洗去样品中其余的蛋白分子,在测定孔中加入偶联生物素“检测”抗体。再加入链霉抗生物素蛋白复合酶,以结合偶联生物素的检测抗体。最后,在测定孔中加入酶的显色底物。可以根据测定测定孔中的特定颜色变化进行相对定量: 颜色变化的越多,样品中的抗原浓度越高。可以通过已知靶抗原浓度的样品测定孔制作标准曲线,从而对未知浓度的样品测定孔进行绝对定量。这个检测过程不需要“捕获抗体”也可以进行;换句话说,抗原可直接包被到检测孔进行后续检测。但是,通过双抗体夹心法检测靶抗原其特异性更高(图3)。
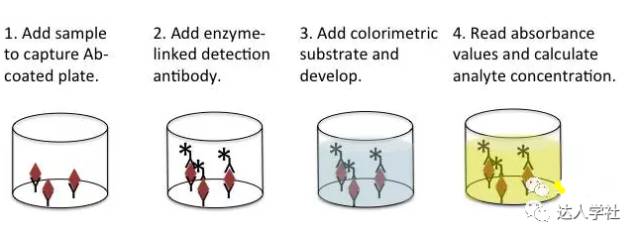
图 3.
标准直接夹心ELISA法的流程示意图。
间接ELISA法
间接酶联试验是用来检测溶液中的抗原特异性抗体的含量。
在此项检测中,某种特定的抗原会直接包被到检测板的样品孔中。可能含有此种抗原特异性抗体的待检样品(如血清,杂交瘤细胞培养基)被加入到检测孔,特异性抗体抗原会相互结合。接下来,在检测孔加入可以结合抗体Fc段的酶联第二抗体,让它与已经结合在特异性抗原上的抗体相结合。最后,再加入比色底物,底物被第二抗体上偶联的酶酶解,通过吸光度的测定值反映所要检测抗体的含量。
竞争性ELISA法
竞争性酶联试验通常用来检测小抗原分子。
在此类检测中,把未知浓度的靶抗原样本加入到已包被了已知浓度的相同靶抗原的检测孔中。然后加入检测靶抗原的标记抗体。然后洗去可溶性的抗原抗体复合物,结合在检测孔中抗原上的抗体含量最后被检测到。竞争性ELISA法最后检测到的信号强度一般与其他ELISA方法相反。
具体说来,样品中游离的抗原浓度越高,就会结合越多的抗体,因此结合到检测板上固定抗原的抗体就会减少,因此最后检测到的信号就会越弱(图4)。
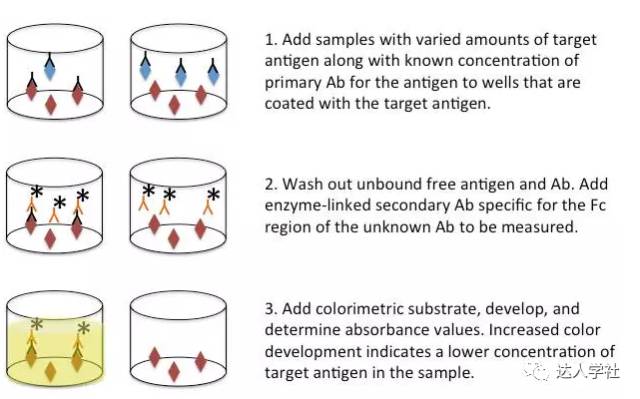
图 4.
竞争性ELISA法的流程示意图。
酶联免疫斑点法
酶联斑点类似于夹心ELISA法检测细胞因子或其他可溶性因子,是通过结合在检测板上的单克隆抗体来捕获把抗原,以及可以用于进行比色测定的酶联第二单克隆抗体检测捕获的靶抗原。但是不同的是,在酶联免疫斑点检测中,产细胞因子的细胞可直接培养在预先包被了捕获抗体和封闭过的检测板中,此检测可以从一个斑点中捕获单个细胞所分泌的细胞因子。培养特定的一段后,弃去检测板中的细胞。其余后续的检测步骤同普通ELISA法非常类似。只是最后一步不是通过检测某波长下的吸光度来分析,而在显微镜直接进行视觉观察或使用专门的读板器。成功检测产细胞因子细胞的ELISPOT法在每个检测孔中会出现很多颜色深浅不一的斑点,每个斑点对应一个单细胞。ELISPOT法特别适用于检测细胞数量非常少的细胞群, 比如检测免疫小鼠的抗原特异性T细胞,此类数量非常少的细胞群用其他的方法一般很难检测到(图5)。
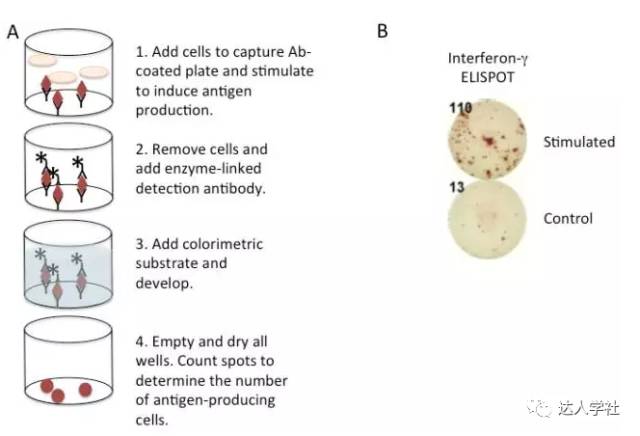
图 5.
酶联免疫斑点法。
A, 流程示意图。 B, 酶联免疫斑点法检测的代表性结果图。
免疫吸附技术可与微阵列技术结合使用,从而实现高通量功能蛋白质组学测定。在此类检测中,预先在玻璃或聚苯乙烯载玻片上包被捕获抗体或样品(如细胞裂解产物)。前者(包被捕获抗体)类似的经典的夹心ELISA、ELISPOT,因为靶抗原结合在固定抗体和游离抗体之间,后者(直接包被样品)类似于直接ELISA法,因为靶抗原直接结合在载玻片上。这两种实验方法中的检测抗体都是针对于各种已知抗原的荧光标记抗体。该技术可快速筛选出表达或活化发生变化的蛋白质。
免疫PCR
免疫PCR(I-PCR)结合了PCR核酸扩增的灵敏度,和基于抗体测定法的特异性,因此这项技术增加了检测灵敏度。通常情况下,可以在不同的应用中获得比ELISA方法的检测极限100-10000倍扩增。 Ⅰ-PCR最先在1992年由佐野等人所述。尽管该技术有潜力,几年来在诊断和生物医学应用中I-PCR方法的用途被一些问题所限制,包括测试的持续时间,由此导致的错误率的增加。另外,主要的缺点之一是抗体难以与寡核苷酸结合。几种解决方案已经提出,如快速,高效的结合方法(如Innova Biosciences公司的Thunder-Link®抗体-寡核苷酸结合系统)。此外,多重和高通量技术的引入大大改善了I-PCR方法,这目前已用作一些细菌和病毒病原体的常规诊断测试,并用于检测肿瘤标志物和食品污染。定量PCR与I-PCR相结合(QI-PCR),可以定量复杂生物样品中的低丰度生物标记物,这难以通过传统的免疫方法定量。
免疫印迹法
蛋白质印迹是一种通过凝胶电泳分离蛋白质并通过电转移把蛋白质转移到吸附膜上。一经蛋白印迹后,即可通过特异性的标记抗体检测到相应蛋白质。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)可用以检测已被SDS化学变性的蛋白。然而,某些特定的抗体不会再一个变性的蛋白质分子上识别其抗原表位,因此需要进行不含SDS的聚丙烯酰胺凝胶电泳。
蛋白印迹可以通过湿法, 半干法, 或干法进行。在湿法,凝胶夹在印迹膜和各种过滤装置中间,然后把整个装置埋进一个装满三甘氨酸转移缓冲的电极槽中。在半干法,夹在中间的凝胶周围只有少量的缓冲,然后封闭在电极板之间。最后,在干式系统中不需要缓冲液,使用带有电极,缓冲液和膜的预组装即用的装置。 虽然干法转膜较快,但需要很好地拟合各部分的夹层配件,而湿法转膜很少会出现问题,可以尽量保持重复实验结果的一致性。此外,如果半干法转膜时间过长,较小分子量的蛋白质可能会从膜上转过。
转膜后,需对膜进行封闭,以减少非特异性蛋白结合,然后进行用一抗孵育膜,以研究感兴趣的目标蛋白。单克隆抗体通常具有更高的特异性;然而许多单克隆抗体产生于某个特定肽段而不是一个天然蛋白质,因此可能无法检测到PAGE所分离的天然蛋白。也可使用多克隆抗体,但易形成较高的背景值。因一抗通常无标记,所以需要一个可以结合在一抗Fc段的标记的二抗,以用于最后的检测。通常会用酶来标记二抗。酶标记后的印迹可通过化学发光酶底物及放射自显影技术成像。被抗体检测和标记到的蛋白质会出现在图像的暗区。
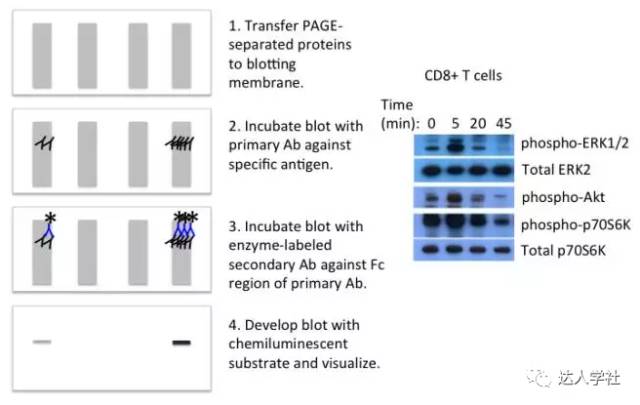
图 6.
免疫印迹法。
A, 流程示意图。 B, 代表性结果图。
斑点印迹法
点印迹类似于免疫印迹法,在膜上检测目标蛋白;但是斑点印迹法中检测的蛋白质不用电泳进行分离。取而代之的是,含有目标蛋白的样品被直接“点”到膜上。这不是一种定量的方法,但它可以直接检测某种特定蛋白的有无; 例如,斑点印迹法可用于检测蔗糖梯度分离的细胞裂解产物中的某些蛋白质定位。
染色质免疫沉淀
染色质免疫沉淀(CHIP)最初是在20世纪80年代研究RNA聚合酶II与靶基因相互作用的过程中发展起来的。在此过程中,细胞被固定在甲醛或类似的固定剂中以使细胞DNA和相关蛋白分子发生交联。固定的细胞随后经超声处理,使细胞中的DNA-蛋白质复合物断裂为100-300 bp的片段,然后用结合在DNA上的特异性蛋白(如组蛋白和转录因子)的抗体,按照标准方法免疫沉淀相关的DNA片段。最后,通过去交联分离DNA-蛋白复合物,再行PCR分析结合在蛋白上的DNA片段。同时,蛋白质与DNA一起共沉淀,可以通过质谱法为基础的方法来识别。理想情况下,标准的CHIP法是用来验证某个蛋白和某个假定的靶基因之间的相互作用,因为要根据假定的靶基因序列设计特异性PCR引物(图7)。
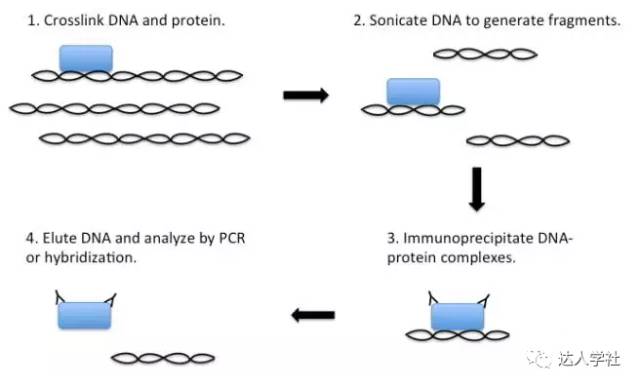
图 7.
染色质免疫沉淀的流程示意图。
CHIP法有个局限性,即交联步骤可能会破坏蛋白分子结构,从而阻碍抗体与其结合,影响后续的免疫沉淀。此时,可以尝试无交联步骤的CHIP法;此过程称为N-ChIP的免疫沉淀法。尽管去交联提高抗原识别能力,但是一般只适用于目标蛋白强烈地结合在DNA上这种情况。
ChIP-on-Chip
最近,芯片被改良以用于高通量分析。例如,ChIP-on-Chip结合了CHIP法和微阵列技术,适用于荧光标记序列的全基因组筛选。在这些检测中,用不同的荧光染料标记沉淀组DNA和对照组DNA(通常不经沉淀的总输入),然后用各组DNA与DNA微阵列芯片甚至整个基因组小寡核苷酸进行杂交。通过标准化分析技术,可以从芯片获得CHIP样品相对于DNA对照组的DNA结合位点的详细信息。
染色质免疫共沉淀测序
将染色质沉淀技术与现代高通量测序技术相结合,从而有利于鉴定前所未知的靶基因序列。由于高通量测序可以鉴定和提供大量的基因组信息,因此染色质免疫共沉淀测序适用于整个基因组的染色质免疫沉淀检测。这个方法是一个非常强大的工具,可以鉴定全基因组DNA与蛋白质如转录因子的结合位点,从而揭示生物过程和基因调控。近日,一个以质谱为基础的称为内源性蛋白快速免疫质谱的方法(RIME)被提议与Chip-seq相结合。这种组合方法提供了目标蛋白的顺反组和相互作用组两种信息。
交联免疫沉淀
交联免疫沉淀(CLIP)是首先由邮乐等人在2003年开发的方法。他们研究剪接因子NOVA和神经元特异性RNA结合蛋白(RBP)之间的相互作用。类似于染色质免疫沉淀技术用来分析DNA-蛋白质的相互作用,交联免疫沉淀技术可用于分析RNA-蛋白质的相互作用。染色质免疫共沉淀测序的方法的类似于染色质免疫沉淀;然而,因为目标核酸不同,因此也存在几个明显的差异。在染色质免疫共沉淀测序中,推荐使用的交联剂是紫外线照射。由于转录组RNA一般较短,所以不需要经过超声处理,细胞可以在标准缓冲液中裂解。但是必须在所有的裂解产物中添加RNase抑制剂以防止目标RNA的降解。CLIP可以分析RNA-蛋白质相互作用,绘制全基因组规模的RNA结合位点。 尤其是HITS-CLIP已广泛用于绘制几个剪接因子,如PTB,FOX2,以及Argonaute蛋白质-RNA相互作用位点。然而,HITS-CLIP显现了与交联效率和RBP结合位点的精确测定相关的一些缺点。为了克服这些问题,在2010年哈夫纳等人开发了光活化 - 核糖核苷增强交联和免疫沉淀(PAR-CLIP),在2011年柯尼希等提出了个别核苷酸方案CLIP(iCLIP),提供了RBP结合位点在单核苷酸水平的 解决方案。
RNA免疫沉淀
RNA免疫沉淀(RIP)是类似ChiP的方法,定性蛋白质和特定的RNA序列之间的相互作用。主要步骤包括:i)在活细胞加入甲醛形成可逆的蛋白质-RNA交联; ⅱ)通过使用特异性抗体免疫沉淀目标蛋白质; ⅲ)交联的逆转; ⅳ)回收和用RT-PCR分析相关的RNA。
电泳迁移实验
电泳迁移率实验(EMSAs)是用来研究DNA结合蛋白对特定DNA位点的亲和力。在经典的EMSAs中,含有结合位点的放射性标记的DNA片段与目标蛋白共同孵育。结合的亲和力是根据凝胶电泳中DNA向上迁移的速度来确定,由于结合了蛋白质的DNA,分子量发生了增加,从而导致在凝胶电泳中的迁移变缓慢。为了提高检测的特异性,可以在反应体系中加入目标蛋白的特异性抗体;如果抗体和目标蛋白结合,进一步减慢DNA-蛋白质复合物在凝胶电泳中的迁移速度,超级电泳迁移实验。
原位检测技术
免疫组织化学(IHC)和免疫细胞化学(ICC)是常用来在原位检测组织和细胞内蛋白表达和定位的两种方法。两种方法主要在样品制备上有所不同;IHC是在固定的整个组织切片上进行,而ICC是在从基质中分离出来的细胞中进行(例如,血液细胞可通过细胞离心涂片法,培养的细胞可在玻片上的长成单细胞层)(图8)。
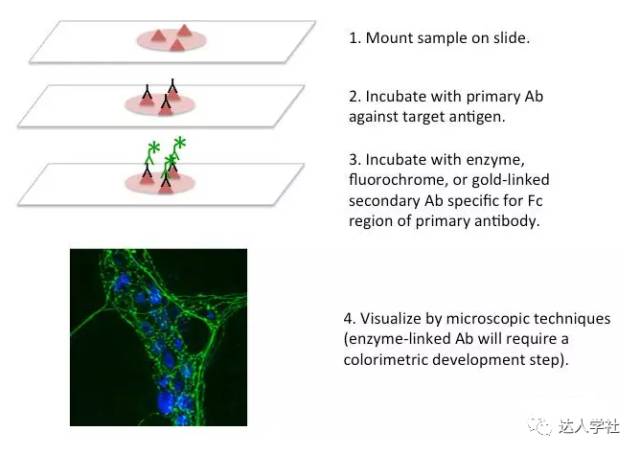
图 8.
免疫组织化学技术的流程示意图及代表性结果图。用抗体标记小鼠肌间神经节,并通过激光共聚焦显微镜成像。绿色,酪氨酸羟化酶标记。蓝色,自发荧光。
固定方法
用于IHC或ICC技术的有几种常见的组织或细胞固定方法,固定方法的选择取决于检测分析的类型。用免疫组织化学检测的完整组织样本固定通常用甲醛,这是一种半可逆交联剂,来源于多聚甲醛,也可进一步稀释为福尔马林。虽有研究指出,在甲醛中过分固定会对样品产生负面影响,但其他也有报道称,并无负面影响,反而强调没有充分的固定时间将影响甲醛交联细胞蛋白质。用甲醛固定组织样本甚至是整个动物样本,是将其完全浸没至体积比为4%的工作浓度的甲醛溶液中去。
醇类,特别是甲醇和乙醇,经常用于免疫细胞化学技术中的细胞固定,因为它们不会损伤细胞中的DNA。醇类一般不推荐用于固体组织标本,因为不能像甲醛那样可以保留组织形态。此外,用醇类固定可导致组织发生收缩。丙酮不是常用的固定剂,一般只是用于快速冷冻组织的固定,因为它改善表位的检测,也因此用于甲醇固定后的第二步固定。但是丙酮固定也能导致组织收缩。最后需要指出,在所有的固定方法中蛋白抗原性的保存必不可少,组织标本可以保存在液态氮冷却过的异戊烷中,并存储在80ºC直到后续处理。
表三
:免疫组织化学固定方法。
|
方法
|
使用范围
|
利与弊
|
|
甲醛类
|
完整组织
|
-
简单且经济
-
改善了标本的持久性
-
可能会破坏一些抗原表位 (见表位回复部分)
|
|
醇类
|
细胞(免疫细胞化学)
|
-
在样品中不会交联DNA
-
不推荐用于组织标本的固定,因为不能保持粗组织形态
-
可能会引起组织收缩
|
|
丙酮
|
冰冻组织或甲醇固定后的再固定
|
|
|
快速冷冻
|
需要保存抗原表位
|
|
包埋方法
组织在切片和染色前,必须先包埋到某种基质中。石蜡是常用来包埋组织的。由于石蜡是疏水的,所以组织必须在一系列浓度梯度增高的乙醇中浸泡进行脱水。在灌注石蜡前的倒数第二步是把组织标本浸泡在二甲苯中使其完全脱水。在组织灌注石蜡后的短时间后,把它们放入(通常在一个小塑料盒内)65%石蜡浴,然后再放入一个模具中,最后凝固成小块,可经切片机切片。石蜡包埋法因其简单、成本低、样品保存持久、可行性高,因此很受欢迎。但石蜡包埋法也有缺点,即无法切的很薄(小于5微米)。为了能在高分辨率的光学显微镜和电子显微镜下观察切片,选择塑料包埋更好,因为可以切出很薄的组织切片,而且有助于保留组织形态。此外,塑料还可以成功包埋非常坚硬的组织(如骨)并切片。然而塑料包埋并不常用,因其比石蜡更昂贵,且会干扰组织染色。先前已冰冻的组织可以用最佳切片温度复合物(OCT)包埋,这是一种水溶性聚乙二醇树脂溶液。用OCT包埋残留少,从而背景信号低,所以是冷冻组织免疫组化染色的理想选择。OCT包埋的一个明显缺点就是在冰冻时变得不透明,在冰冻组织切片时定位较难。
表四
:免疫组织化学中的组织包埋方法。
|
方法
|
适用范围
|
利与弊
|
|
石蜡
|
甲醛固定组织
|
-
简易、可行性高
-
组织可以长期保存
-
质地较软,切片难以很薄
-
需要固定,可能会破坏表位
|
|
塑料
|
较硬的固定组织或需要切的很薄的组织样本(如样本需要电子显微镜观察时)
|
|
|
最佳切片温度介质(OCT)
|


















