问题:
怎样才能让我的工作学习更有效率呢??
答案:
只需要点击图片上边蓝字
一药一世界
即可!



国务院办公厅关于进一步改革完善药品生产流通使用政策的若干意见:
对生物等效性试验实行备案制管理,允许具备条件的医疗机构、高等院校、科研机构和其他社会办检验检测机构等依法开展一致性评价生物等效性试验,实施办法另行制定。
但文前是有小标题:
(二)加快推进
已上市
仿制药质量和疗效一致性评价
,从两小标题看是区分了上市审批和已上市仿制药,就是说备案制管理是局限于已上市仿制药的一致性评价?
也就是说
仿制药质量和疗效一致性评价
的(强制)对象是:“已上市
”,包括化学药品新注册分类实施前批准上市的仿制药,不仅限于289,289只是多了时限。而意味着首次上市审批的仿制药应该还并不包含在列?



化学药品注册分类改革工作方案的公告(2016年第51号)
对化学药新注册分类3.4类的表述并不是
仿制药质量和疗效一致性评价,
但审评上都是强调质量和疗效一致,那么化学药品新注册分类实施后要批准上市的仿制药
,
应该是按106号公告所提的自行组织一致性评价的范畴?


仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)
四、根据《国务院办公厅关于进一步改革完善药品生产流通使用政策的若干意见》(国办发〔2017〕13号),对生物等效性试验机构实行备案制管理。一致性评价中的生物等效性试验可以在现有经认定的临床试验机构进行,
表述中的生物等效性的放限是有
一致性评价的
前缀,根据的是国办发〔2017〕13号,那么就也是已上市仿制药的BE放开?而新注册分类之后的仿制药上市审批的BE、已有品种,申请更换工艺、辅料探索等需要补充申请的BE,还是应该在有资质的临床试验机构开展?
生物等效性试验毕竟289及已上市仿制药首次做BE上市审批的仿制药
安全性风险相对
更小。
也可以在其他具备条件的机构进行。
又是什么内涵?只说机构,具备条件的非医疗机构也可以,暗示商业化机构也可以?这是打谜?
生物等效性试验发起方可以聘请具备评估能力的第三方按《药物临床试验质量管理规范》(GCP)要求对开展生物等效性试验的机构进行评估。
可以聘请,而不是必须,自行评估也可以吧?谁是具备评估能力的第三方只需发起方认为具备即可?
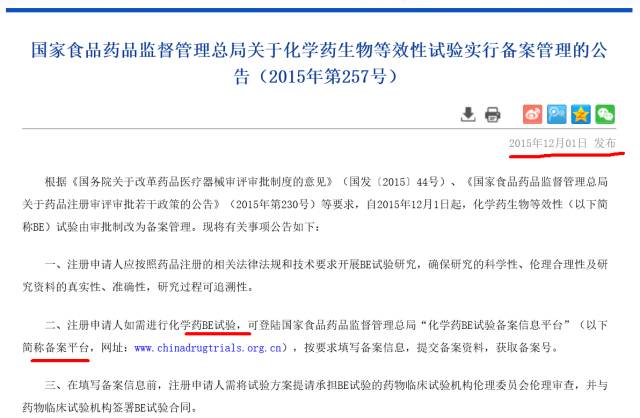
关于BE资质,备案制你是否也还是云里雾里?国内未上市仿制药首次BE要在有资质的中心开展?
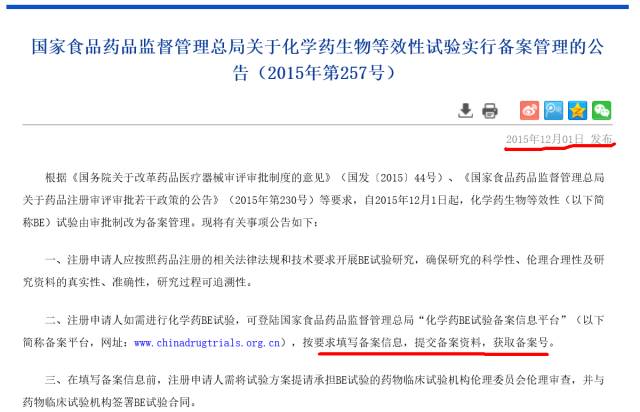
那也许就对了,也许106公告是BE试验项目的备案,至于具体机构备案制尚未出台。
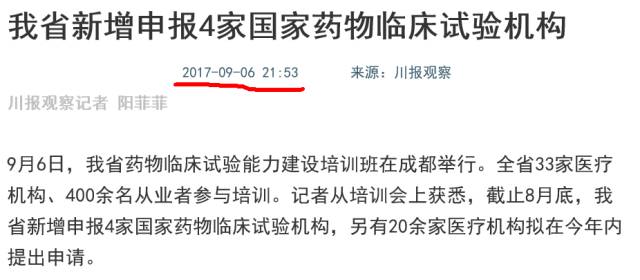
前阵子一张关于药物临床试验机构备案管理办法PPT流出... ...
在最终落地之前,机构认证:谁搭上了末班车?