
“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度,解读一周数据,提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为超过100个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
1
月
15
日,医渡科技有限公司正式在港股
IPO
上市。开盘价为
26.30
港元,开盘股价大涨超
140%
,当日市值达到
574
亿港元。
医渡云是医疗人工智能技术公司,通过自主研发数据智能基础设施YiduCore,向医疗行业的主要参与者包括医院、不同行政级别的监管机构及政策制定者提供基于大数据和人工智能技术的医疗健康解决方案。其股东包括中国投资有限责任公司、腾讯等。

1
月
13
日,江苏浩欧博生物医药股份有限公司在科创板成功上市。发行价格
35.26
元
/
股,开盘半小内最高涨至
75.88
元
/
股。
浩欧博主要从事体外诊断试剂的研发、生产和销售,专注于过敏性疾病和自身免疫性疾病的体外检测业务。截至目前,公司已获得131项产品注册证书和41项专利,并有52项产品已取得欧盟CE认证。
1
月
14
日,北京术锐宣布获得近
3
亿元
B
轮融资,本轮融资由国投招商领投,辰德资本、以及老股东顺为资本、天峰资本和汇鼎投资继续跟投。
北京术锐瞄准第三代单多孔通用型的微创腔镜手术机器人系统,致力于完全自主的研发、生产和销售,打造核心自主知识产权和全链条关键技术。2020年12月4日,术锐手术机器人成功进入“创新医疗器械特别审查程序”,成为中国首个进入特别审查程序的单孔腔镜手术机器人。
1
月
11
日,阅尔基因宣布完成超额认购总值
4,200
万美元的
A
轮融资。本轮融资由博远资本与涌铧资本领投资,泰福资本、磐霖资本、聚明投资、拓邦资本跟投。此外,阅尔基因此前的投资者红杉资本中国、若沐资本以及思嘉建信资本在本轮中也共同参与。
阅尔基因专注从事超高灵敏肿瘤测序Panel检测和不孕不育遗传检测的基因组学与分子诊断业务。本次融资或将推动NGS产品革新,降低检测成本,并加强市场渗透。
1
月
11
日,新元一期基金以及
Kymab
的所有其他投资者与赛诺菲达成协议,出售其于临床阶段生物制药公司
Kymab
之权益予赛诺菲。作为代价,赛诺菲将支付
11
亿美元首期付款及在达成某些里程碑后支付额外最多
3.5
亿美元予退出
Kymab
的投资者。该交易预计于
2021
年上半年完成。
Kymab是一家临床阶段的英国生物制药公司,利用其专有的集成平台IntelliSelect®,开发全人源化单克隆抗体药物,并专注于免疫介导的疾病和免疫肿瘤学。Kymab的IntelliSelect Transgenic平台覆盖各种人源化抗体,使其成为最全面的抗体平台。
1
月
7
日,珀金埃尔默宣布,将以每股
22
美元,总价约
5.91
亿美元的价格收购
Oxford Immunotec
的流通股。预计交易将于
2021
年上半年完成。交易完成后,
Oxford Immunotec
将成为一家私人控股公司。本次收购公司企业价值溢价
99.2%
。通过此次收购,
PerkinElmer
将扩大其先进的传染病检测解决方案组合,包括结核病检测,以更好地服务于世界各地的客户。
Oxford Immunotec是公认的全球领先的潜伏性结核病专用检测试剂盒研发生产商,它的干扰素-γ释放试验(IGRA)可以识别出结核感染者。

强生公布其新冠疫苗I/IIa期临床中期数据
1月13日,强生公司在 《the New England Journal of Medicine》上发表了其COVID-19候选疫苗的I/IIa期中期数据。数据显示,单剂量COVID-19候选疫苗可产生至少71天的免疫应答。时间的长短与年龄在18至55岁之间的参与者的中期数据点相关。强生公司期望本月晚些时候公布其更大规模的III期试验的主要数据。强生的疫苗是基于杨森公司的腺病毒载体技术平台AdVac开发的。该平台还用于开发了在欧洲获得批准的扬森的埃博拉疫苗,以及开发其Zika,RSV和HIV候选疫苗。与辉瑞/BioNTech、Moderna和阿斯利康/牛津的疫苗相比,强生公司的疫苗单剂量注射就有效。此外,强生疫苗也不需要超低温存储,辉瑞/BioNTech的疫苗需要低至- 94华氏度,强生产品能以稳定的形式在冰箱中存放数月。
信息来源:
医麦客

FDA发布首个医疗AI行动计划
1月12日,FDA正式发布了第一个人工智能/机器学习的SaMD(Software as a Medical Device)行动计划。该行动计划总结了FDA下一步对基于AI/ML的医疗设备软件进一步监督的步骤,概述了一个基于整个产品生命周期监督的整体方法,从而进一步提高这些技术在改善患者护理方面的巨大潜力,同时提供安全和有效的软件功能,提高患者的护理质量。
信息来源:
医健AI掘金志
1. 治疗特定胃癌患者,阿斯利康/第一三共抗体偶联药物获FDA批准
2. 15款1类新药获批临床,来自强生、安进、益方生物、艾力斯医药等公司
3. 国内首个CAR-T疗法,复星凯特「益基利仑赛注射液」即将获批上市
4. 多项医疗器械产品获NMPA批准或拟获批上市,创新医疗器械快速审批通道已有100个创新医疗器械获批上市

治疗特定胃癌患者,阿斯利康/第一三共抗体偶联药物获FDA批准
1
月
16
日,
FDA
官网显示,已批准阿斯利康和第一三共公司联合开发的抗体偶联药物
Enhertu
扩展适用范围,用于治疗
HER2
阳性局部晚期或转移性胃癌和胃食管结合部腺癌患者。
这些患者曾经接受过基于
trastuzumab
疗法的治疗。
这是
Enhertu
在
2019
年获批治疗
HER2
阳性乳腺癌后斩获的第二项适应症。
这一批准是基于随机2期临床试验DESTINY-Gastric01的结果。该试验结果显示,接受Enhertu治疗的患者与接受化疗的患者相比,客观缓解率和总生存期获得具有统计学显著性和临床意义的改善。Enhertu治疗组达到51.3%的客观缓解率,化疗组为14.3%。在预先指定的中期分析中,接受Enhertu治疗的患者与接受化疗的患者相比,死亡风险降低了41%。Enhertu组的中位总生存期为12.5个月,而化疗组为8.4个月。
信息来源:
药明康德
15款1类新药获批临床,来自强生、安进、益方生物、艾力斯医药等公司
截止1月15日,中国国家药监局药品审评中心数据显示,共计有3,561项临床试验申请通过“默示许可”。本周新增45项临床试验默示许可,其中有18项1类创新药申请(不含补充申请),涉及15款药物。其中包括:益方生物,D-1553片,一款KRAS抑制剂,用于携带KRAS G12C突变的晚期或转移性实体瘤;艾力斯医药,甲磺酸伏美替尼片,一款第三代表皮生长因子受体酪氨酸激酶抑制剂,用于EGFR突变阳性II-IIIA 期非小细胞肺癌。
信息来源:药明康德
国内首个CAR-T疗法,复星凯特「益基利仑赛注射液」即将获批上市
1月12日,复星凯特的CD19 CAR-T疗法益基利仑赛注射液(拟定)的上市申请处于“在审批”阶段,预计近期会获批准上市,成为国内首个上市的CAR-T疗法。该药物从申报上市到即将获批,仅用不到一年时间。复星凯特2017年初从美国Kite Pharma引进Yescarta,项目名称FKC876,获得全部技术授权,并拥有其在中国包括香港、澳门的商业化权利,该产品将被开发用于治疗两线或以上系统性治疗后复发或难治性大B细胞淋巴瘤,包括:弥漫性大B细胞淋巴瘤非特指型、原发性纵隔B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。
信息来源:药融圈
多项医疗器械产品获NMPA批准或拟获批上市,创新医疗器械快速审批通道已有100个创新医疗器械获批上市
包括湖南埃普特医疗器械的锚定球囊扩张导管、赛诺医疗的新一代 Supreme HT药物洗脱支架系统、先健科技的髂动脉分叉支架系统均已获批上市,其中先健科技的髂动脉分叉支架系统为获批上市的第100个创新医疗器械。
另外,上海艾普强粒子设备的“质子治疗系统”、杭州唯强医疗科技的“模块内嵌主动脉弓覆膜支架系统”,以及先健科技的“主动脉覆膜支架系统”3项产品通过创新医疗器械特别审查申请,拟同意进入特别审查程序。
信息来源:
医疗器械创新网,medworld器械世界

BioMarin公布A型血友病基因疗法3期试验的一年随访数据
1月12日,BioMarin公司公布了valoctocogene roxaparvovec(以下简称: valrox)正在进行的全球3期临床研究GENEr8-1中,取得了积极顶线结果。valrox是一种使用AAV5病毒载体递送表达FVIII的转基因的基因疗法。它的优势在于患者可能只需要接受一次治疗,肝细胞就可以持续表达FVIII,从而不再需要长期接受预防性凝血因子注射。valrox已经获得美国FDA授予的突破性疗法称号,以及FDA和EMA的孤儿药指定,用于治疗严重A型血友病。在年化出血率的初步分析中,单剂量valrox治疗后,患者的ABR较预期降低了84%,在非介入基线观察研究中基线ABR为4.8/年,研究分析中ABR为0.8/年。接受valrox治疗后的第5周,80%的受试者无出血。valrox还显著降低了患者外源性因子VIII(FVIII)的年度使用量,从基线135.9/年降低到2.0/年。安全性方面:在3期研究中,接受单次valrox(剂量为6e13 vg/kg)的134名参与者对valrox耐受性良好,没有参与者出现需要FVIII抑制剂或血栓栓塞事件。一名参与者失访。输液相关的反应可以通过控制输液速率有效减轻。
信息来源:
医麦客

1.
和黄医药与创响生物宣布达成战略合作共同开发及商业化免疫性疾病候选药物
3.
再鼎医药与
Turning Point Therapeutics
达成
3.61
亿美元合作交易

和黄医药与创响生物宣布达成战略合作共同开发及商业化免疫性疾病候选药物
1
月
13
日,和黄医药与创响生物宣布达成战略合作,以进一步开发由和黄医药发现
的四款用于治疗多种免疫性疾病的候选药物。
由创响生物投入资金,两家公
司将携手合作,推进
IND
申请。
如果成功,创响生物将负责继续推进候选药物的全球临床开发。
根据协议条款,和黄医药将授予创响生物四款候选药物用于免疫性疾病治疗的独家选择权。
若行使该选择权,创响生物将拥有在全球进一步开发、生产和商业化该候选药物的权利,而和黄医药将保留在中国大陆共同商业化的优先权。
对于每款候选药物,和黄医药有权收取最高可达
9,500
万美元的开发里程碑费用和最高可达
1.35
亿美元的商业销售里程碑费用,以及商业化后最高可达双位数的年净销售额分成。
信息来源:
药学进展
百济神州与诺华达成替雷利珠单抗授权合作协议
1
月
12
日,百济神州宣布与诺华达成一项合作与授权协议,后者获得替雷利珠单抗在美国、加拿大、墨西哥、欧盟成员国、英国、挪威、瑞士、冰岛、列支敦士登、俄罗斯和日本等多个国家的开发、生产和商业化权利。
双方将在上述国家对替雷利珠单抗进行共同开发,其中诺华将在过渡期后负责注册申请,并在获得批准后开展商业化活动。
此外,双方均可在全球范围内开展临床试验以评估替雷利珠单抗联合其他抗肿瘤疗法的潜在用药组合;
百济神州可在北美地区共同进行产品销售,其中部分运营资金将由诺华提供。
根据协议,百济神州将获得
6.5
亿美元的预付款,并有资格在达到注册里程碑事件后获得至多
13
亿美元的付款、在达到销售里程碑事
件后获得
2.5
亿美元的付款,另有资格获得替雷利珠单抗在授权地区未来销售的特许使用费。
根据协议,百济神州将负责为正在开展的替雷利珠单抗临床试验提供资金,诺华将在授权地区为新开展的注册性、桥接或药品上市后的研究提供资金,每一方将负责为各自用于评估替雷利珠单抗联合公司或第三方药物开展的临床试验提供资金。
双方将保留其自主开发产品联合替雷利珠单抗用药组合的全球商业化权利。
信息来源:
医药魔方
再鼎医药与Turning Point Therapeutics达成3.61亿美元合作交易
1
月
11
日,再鼎医药与
Turning Point Therapeutics
公司宣布,双方将进一
步深化战略合作。
根据协议条款,再鼎医药将获得
MET/SRC/CSF1R
抑制剂
TPX-0022
在大中华区独家
开发和商业化权利。
Turning Point
将获得
2500
万美元的现金预付款,并有资格获得最高至
3.36
亿美元的潜在开发、注册和销售的里程碑付款。
再鼎医药将根据
TPX-0022
在大中华区的年度净销售额向
Turning Point
支付特许权使用费。
本次协议在双方于
2020
年
7
月签署的独家授权许可基础上进一步深化了两家公司的战略合作伙伴关系。
信息来源:
药时代
近期交易概况
(2021年01月11日-01月15日)

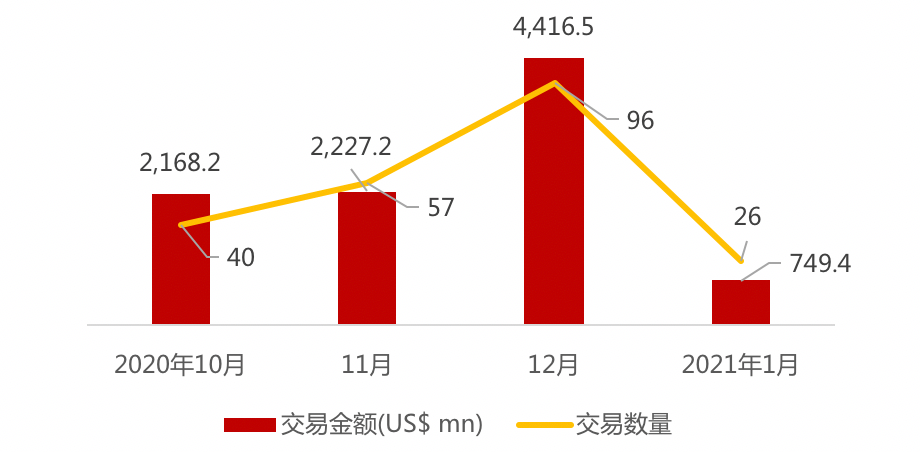
注:
该二级市场融资仅指IPO融资,未考虑上市后增发融资等情况
。
上市公司市值及估值倍数一览
(2021年01月15日)市值单位:百万美元

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >


















