君实生物于
5
月
22
日发布公告称,为满足公司经营发展的资金需求,实现公司可持续发展,提升公司国际化水平,公司拟申请在香港联交所主板上市。未来将有越来越多的国内优秀生物制药企业赴港IPO,海通医药在此特别带来君实生物的H股上市前瞻。
投资要点
本土生物制药企业新秀,全
球化平台推动源头创新。
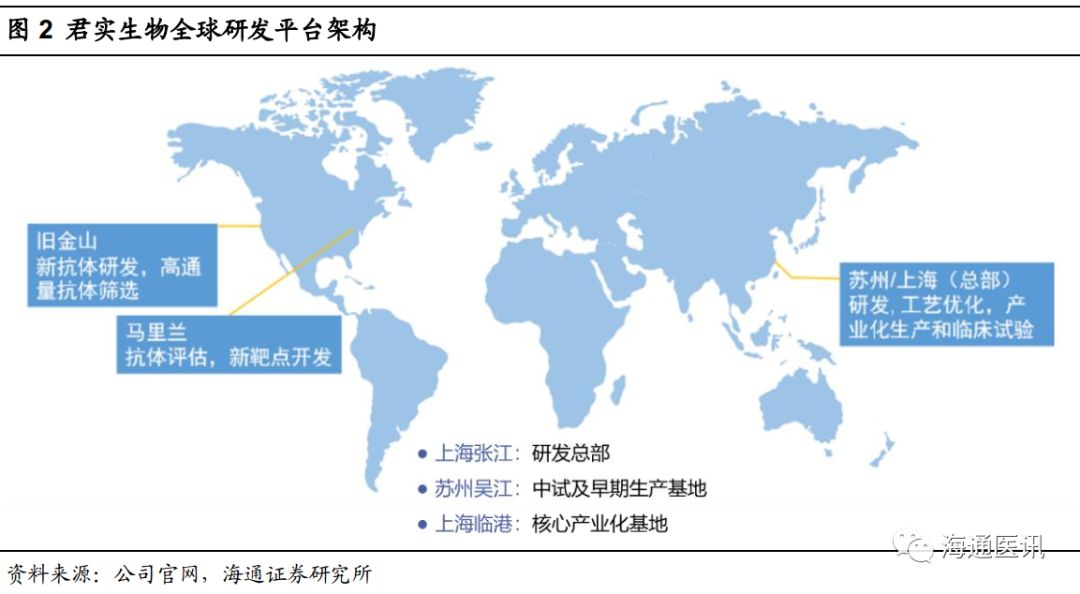
君实生物是一家专注于开发单抗药物的研发型生物制药企业,由多名拥有丰富的科技成果转化及产业化经验的海归科学家创办。公司在马里兰、旧金山、上海设有三个全球研发中心,分别负责新靶点开发、新抗体筛选、工艺优化及产业化,完整研发链条联动,从源头推动药物创新。
单抗管线领跑国内,
PD-1
打响第一枪。
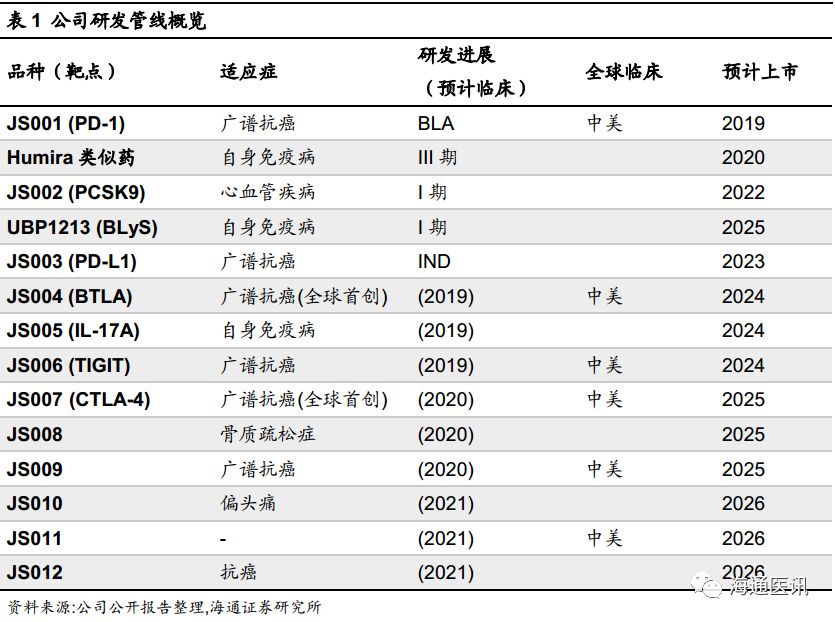
公司在研单抗药物
14
种,其中
PD-1
、
PCSK-9
等热门靶点创新药以及
Humira
仿制药的研发进度均处于国内领先水平。其中特瑞普利单抗是国内第一批报产的
PD-1
,多个癌症临床的表现均达到或优于
Opdivo
、
Keytruda
,有望成为全球最好的
PD-1
之一。
Humira
仿制药预计
2020
年上市,
PCSK-9
单抗预计
2022
年上市。
临港基地即将落成,产能满足全球市场需求。
公司的上海临港核心产业基地将于
2018-2020
年分两期实现“
2000
升
*12+5000
升
*9
”的单抗发酵生产规模,产值超过
100
亿元,届时产能将能满足公司全球市场的单抗药物生产需求。
风险提示。
PD-1
等单抗药物
临床试验进展不达预期,
PD-1
等
审评进度不达预期
。
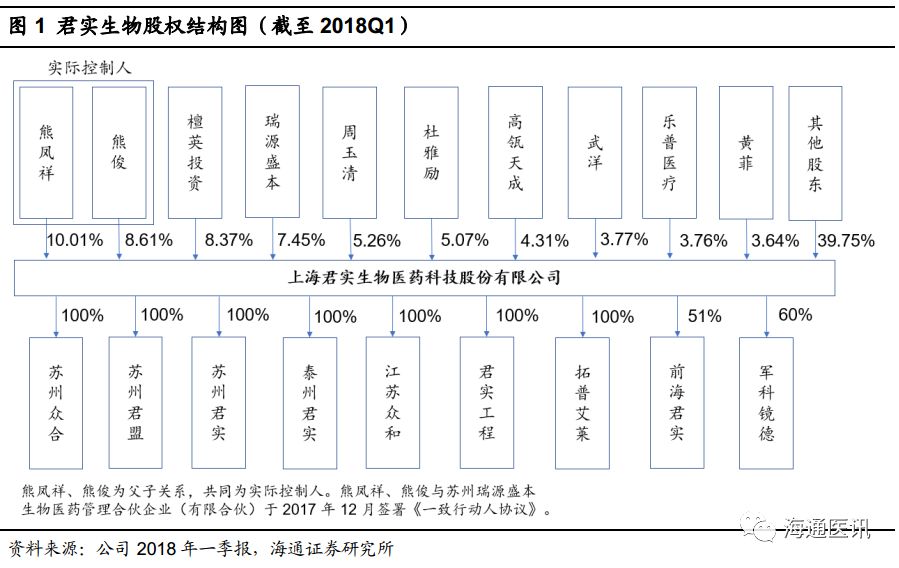
君实生物医药科技股份有限公司成立于
2012
年
12
月,由多名拥有丰富的生物药研发经验的海归科学家创办,是一家专注于开发单抗药物的研发型生物制药企业。
2015
年
5
月公司改制为股份公司,同年
8
月在新三板挂牌上市。公司挂牌后共完成六次股票发行,累计融资
16.18
亿元。
2018
年
2
月,公司完成
2018
年第一期双创可转换公司债券的非公开发行,发行规模为
2
亿元。截至
5
月
31
日,君实生物报收
21.41
元
/
股,自挂牌起累计涨幅近
4
倍。
公司现任董事长熊俊,拥有丰富的资本运作经验,自
2007
年至今同时任上海宝盈资产管理有限公司董事长。董事会其他成员,陈博,冯辉、张卓兵、武海、姚盛等,此前均为阿斯利康、礼来、安进等跨国巨头的资深研发科学家,生物药研发实力雄厚。
2012
年成立之初,君实生物就瞄准了全球单抗药物的市场前沿,一步步搭建了国内顶尖的人源化抗体药物研发平台。公司已经在马里兰、旧金山、上海设有三个全球研发中心,分别负责新靶点开发、新抗体筛选、工艺优化及产业化,形成了从源头创新到生产应用的完整研发链条。此外,国际著名研究机构的强强合作,使公司在抗体筛选、培养、纯化等单抗药物的核心技术方面均已达到国际先进水平。
2.
单抗管线领跑国内,
PD-1
打响第一枪
目前公司的在研产品线中,
PD-1/PD-L1
、
PCSK-9
、
BlyS
等热门靶点的创新药及
Humira
类似药的临床研究进度均处于国内领先水平。公司预计在
2025
年前,将完成管线内全部
14
种药物的上市申请。
其中,特瑞普利单抗是国内第一批申报上市的
PD-1
,有望成为全球最好的
PD-1
之一。此外,高血脂药物
JS002
是国内首家获批临床的
PCSK9
单抗;系统性红斑狼疮药物
UBP1213
是国内唯一获批临床的
BLyS
单抗;
UBP1211
为阿达木单抗的生物类似药,目前处于
III
期临床,预计
2019
年报产。阿达木单抗是近三年全球药物销售冠军,
2017
年销售额超过
180
亿美元,国内尚无仿制药上市,市场潜力巨大。
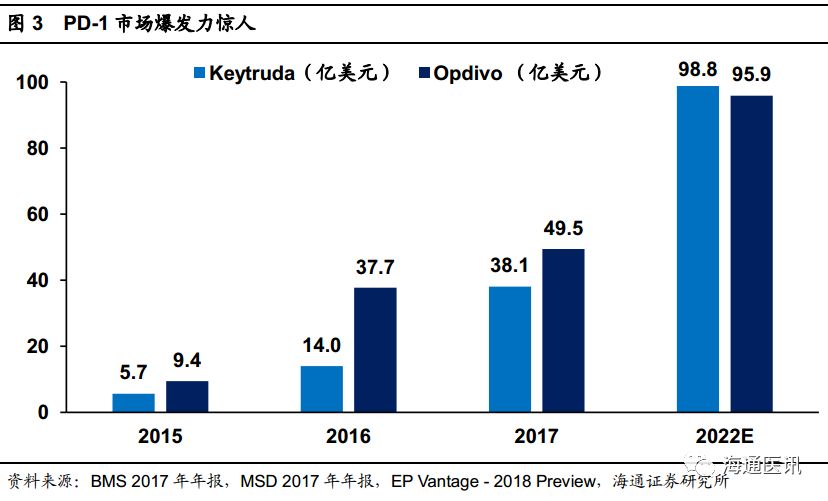
2.1
特瑞普利单抗对标一线
PD-1
,联用前景广阔
在
2017
年过千亿美元的全球抗癌药市场中,靶向药物已经占据半壁江山,而
PD-1/PD-L1
单抗更是其中最耀眼的新星。全球两大
PD-1: Opdivo (BMS)
和
Keytruda (MSD)
自
2014
年被
FDA
批准以来,近三年累计实现了超过
150
亿美元的销售额,显示出惊人的爆发力。根据
Evaluate Pharma
的最新预测,受益于其广阔的联合用药前景,“
O
、
K
双雄”
2022
年合计收入将超过
195
亿美元,以
17%
的年复合增长率高速扩张。
君实生物的
JS001
(特瑞普利单抗)从抗体开发到临床试验都瞄准了国际一线
PD-1
。从早期的体外及动物试验开始,
JS001
就显示出了显著优于已上市
PD-1/PD-L1
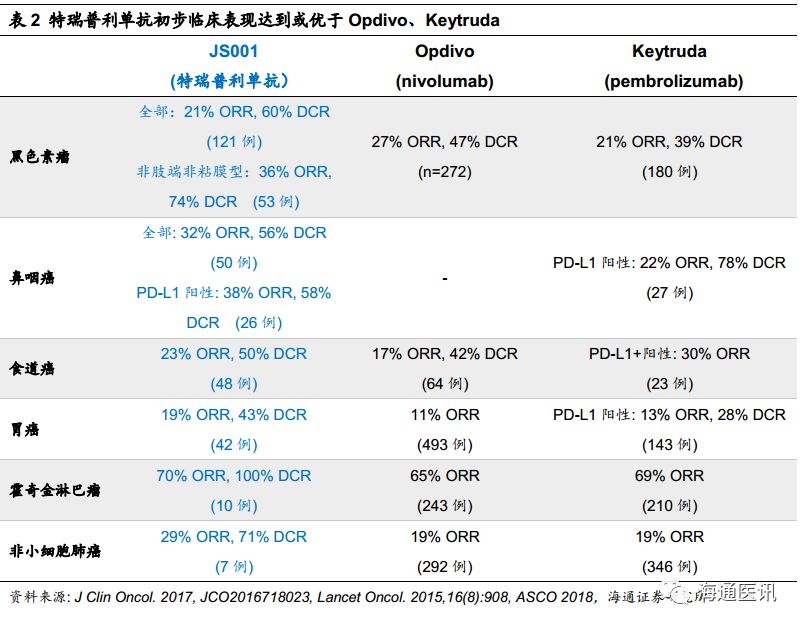
的抗肿瘤活性,在第一个获批临床。在已完成的黑色素瘤、鼻咽癌、胃癌等临床试验中,
JS001
的疗效和安全性均达到或优于“
O
、
K
双雄”,有望成为全球最好的抗
PD-1
单抗药物之一。此外,
JS001
的美国
I
期临床也已经展开,结合国内的用药剂量等临床数据基础,预计美国临床的进展将十分迅速。特瑞普利单抗如果能顺利获得
FDA
的批准,将为君实进军广阔的全球肿瘤药物市场打下坚实的基础。
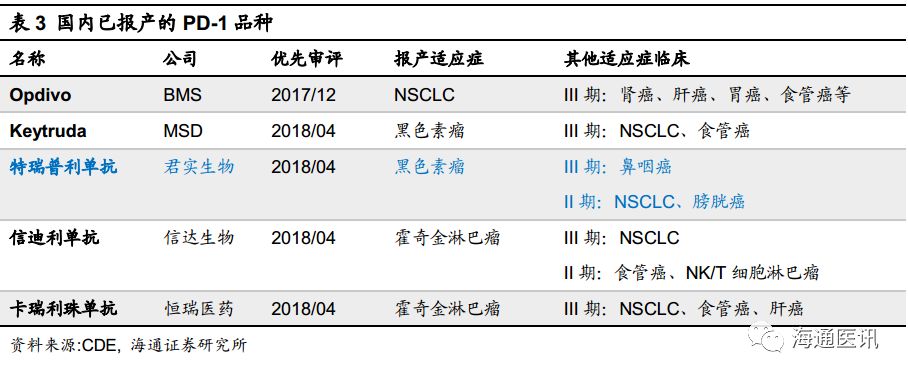
今年也是国内的
PD-1
市场元年,目前已有五个
PD-1
率先进入
CDE
的优先审评。五家
PD-1
申报的适应症各有不同,临床布局也各有侧重。目前君实总共有
16
项
PD-1/PD-L1
临床试验备案,仅次于恒瑞的
19
项,布局上十分完善。
特瑞普利单抗的报产适应症是黑色素瘤二线治疗。其鼻咽癌适应症的
III
期临床经已展开,公标在年内提交鼻咽癌二线治疗注册申请。
2020
年前预计能推广至黑色素瘤、鼻咽癌的一线治疗。
对于非小细胞肺癌(
NSCLC
)、胃癌、膀胱癌、乳腺癌等大适应症,公司将开发重心投入在了市场空间更大的联合用药上。这是由于
PD-1
单药对实体肿瘤的响应率有限,与放疗、化疗及靶向疗法的联用既能减少临床失败的风险,也可以提升其市场渗透率。
2017
年,
Keytruda
联合化疗(培美曲塞
+
卡铂)惊艳的临床数据促使
FDA
加速批准了其用于
NSCLC
一线治疗,目前特瑞普利单抗也采用同样的方案开展了
II
期临床,结果令人期待。
在未来激烈的
PD-1
市场竞争中,君实生物利用其生物药的研发优势,有望实现
PD-1
与在研的
CTLA-4
、
BTLA
、
TIGIT
等免疫检查点单抗的联用,获得更佳的治疗效果。不仅如此,公司也积极从外部寻求与疗效优异的小分子靶向药物联用,与特瑞普利单抗这柄利刃一起歼灭更多、更困难的癌症,攻占更大的抗癌市场。
2.2
国内首家
PCSK9
临床,高血脂市场前景可期
除肿瘤外,高血脂等心血管疾病是人类面临的另一大挑战,近年来发病率随着生活水平的提升持续走高。他汀类小分子药物在降脂药中占据垄断地位,阿托伐他汀、瑞舒伐他汀等代表性药物专利期均已到期,仿制竞争十分激烈。
2015
年新型降脂药
PCSK9
单抗的面市给高血脂市场带了新的机遇。
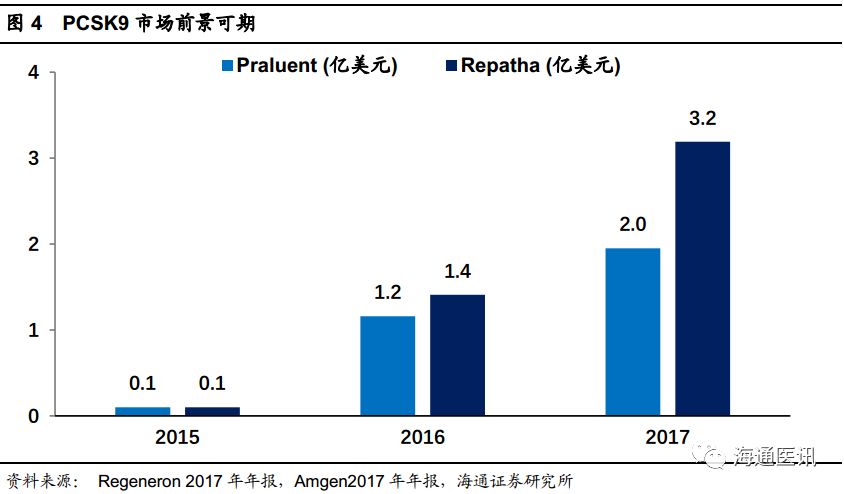
目前全球仅有两款
PCSK9
单抗:
Praluent
(
Sanofi & Regeneron)
和
Repatha
(
Amgen)
在售,
2017
年共实现约
5
亿美元销售额,增长势头强劲。今年,最新的临床结果表明
Praluent
与他汀联用相比他汀单药,使患者的心血管不良事件显著减少,巨大的联用价值是未来
PCSK9
市场拓展的关键。
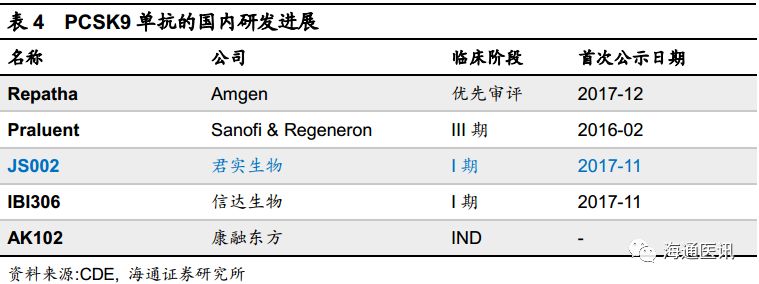
国内进度最快的
PCSK9
是已进入优先审评的
Repatha
,君实的
JS002
则是首家获批临床的国产品种。如果
I
期临床顺利进行,
2019
年有望直接开展
III
期临床,预计
2022
年前后上市。高血脂等心血管病的用药周期较长,
PCSK9
的疗效和心血管获益作用被市场认可尚需时日。价格是另一大制约其快速放量的因素,
Praluent
近期已大幅降价以进入美国商业医保名单。未来几年,随着更多的临床结果公布和药品价格的降低,预计其市场规模可达
150
亿美元。
3.
临港基地即将落成,产能满足全球市场需求















