降阶梯策略在人类表皮生长因子受体2(HER2)–阳性的早期乳腺癌(BC)的应用:西德研究小组辅助动态标记物指导下个体化治疗试验优化对HER2和激素受体阳性早期乳腺癌风险评估和治疗反应预测的II期随机试验的终期分析-12周新辅助曲妥珠单抗-DM1(T-DM1)±内分泌治疗对比曲妥珠单抗+内分泌治疗的有效性,安全性和预测标志物
Nadia Harbeck, Oleg Gluz, Matthias Christgen, Ronald Ernest Kates, Michael Braun, Sherko Kuemmel,¨ Claudia Schumacher, Jochem Potenberg, Stefan Kraemer, Anke Kleine-Tebbe, Doris Augustin, Bahriye Aktas, Helmut Forstbauer, Joke Tio, Raquel von Schumann, Cornelia Liedtke, Eva-Maria Grischke, Johannes Schumacher, Rachel Wuerstlein, Hans Heinrich Kreipe, and Ulrike Anneliese Nitz
本刊负责人:周芳坚 ;审校:陆劲松 ;翻译:何婉
摘 要
目的
:
人类表皮生长因子受体2(
HER2
)阳性
/
激素受体(
HR
)阳性乳腺癌是一个独特的亚群,相较
HER2
阳性
/ HR
阴性乳腺癌,化疗敏感性较低,预后稍好。曲妥珠单抗联合内分泌治疗(
ET
)或强效的抗体偶联细胞毒药物、抗
-HER2
复合物曲妥珠单抗
-DM1
(
T-DM1
)联合或不联合
ET
对这个亚群的疗效鲜为人知。西德研究组发起的
ADAPT
(依托辅助动态标记物指导的早期乳腺癌风险评估和治疗反应预测个体化治疗优化试验)比较
T-DM1
对比曲妥珠单抗联合
ET
在早期
HER2
阳性
/ HR
阳性乳腺癌患者中的病理完全缓解(
pCR
)率。
患者与方法
:
在这项前瞻性、新辅助、II期临床试验中,
375
例
HER2
阳性
/HR
阳性状态的早期乳腺癌患者(筛选人数
n = 463
)被随机分配到
12
周治疗的
T-DM1
联合或不联合
ET
组或曲妥珠单抗联合
ET
组。
pCR
(
ypT0/is/ypN0
)为主要终点。早期评估于治疗后
3
周进行活检评估(增殖指标
Ki-67
减少
≥
30%或细胞反应)。次要终点包括安全性和早期反应对
pCR
的预测影响。辅助治疗遵循国家标准。
结果
:
基线特征在分组之间平衡。超过90%的患者完成了对应的治疗方案。单药
T-DM1
治疗组患者达
pCR
者占
41.0%, T-DM1
和
ET
组占
41.5%
,而曲妥珠单抗和
ET
组占
15.1%
(
P
<0. 001
)。早期反应者
35.7%
(
67%
的患者具有可评价的反应)获得
pCR
,而早期无反应者仅
19.8%
获得
pCR
(风险比,
2.2
;
95% CI
,
1.24
至
4.19
)。
T-DM1
与更高的
1
至
2
级毒性显著相关,特别是血小板减少、恶心和肝酶升高。总体毒性低;共有
17
件治疗相关性严重不良事件(
T-DM1
组对比曲妥珠单抗
+
内分泌治疗组分别为
5.3%
对比
3.1%
)。
结论:
ADAPT HER2阳性
/HR
阳性试验表明,给予仅
12
周的
T-DM1
(联合或不联合内分泌治疗)新辅助治疗,可获得有临床意义的
pCR
率。因此,相当数量的患者可免受全身化疗的不利影响。
简 介
虽然人类表皮生长因子受体2(
HER2
)
-
过度表达的早期乳腺癌(
BC
)本质上具有高度侵袭性,但是采用化疗和
1
年的曲妥珠单抗联合治疗治愈率高,在本世纪早期已成为标准治疗
[1]
。同时,第二代有前途的抗HER2化合物已问世。帕妥珠单抗联合曲妥珠单抗联合多西他赛化疗
[2]
是转移性BC的一线标准治疗方法,最近已被批准用于新辅助治疗。曲妥珠单抗
-DM1
(
T-DM1
),一种曲妥珠单抗偶联细胞毒性化合物
DM1
的抗体药物耦合药物,是有效治疗
HER2
阳性乳腺癌的又一新选择。基于比较
T-DM1
与标准卡培他滨联合拉帕替尼的
III
期
EMILIA
试验,
T-DM1
被批准用于二线治疗转移性
BC
[3]
。在一项比较一线T-DM1与曲妥珠单抗联合多西他赛的小的随机
II
期试验中,
T-DM1
组显示更长的无进展生存和更低的毒性
[4]
。III期
MARIANNE
试验后来证明
T-DM1+
帕妥珠单抗无进展生存期不劣于(但不优于)多西他赛联合曲妥珠单抗治疗转移性
BC
[5]
。T-DM1+帕妥珠单抗没有改善无进展生存期,但
T-DM1
耐受性优于多西他赛联合曲妥珠单抗。
T-DM13
级或以上的不良事件(
AE
)更少,没有发热性中性粒细胞减少发生,神经病变、腹泻、脱发也较少。
T-DM1
组健康相关生活质量的维持时间长。
T-DM1
治疗转移
BC
似乎与紫杉类药物联合曲妥珠单抗同样有效
[4]
。T-DM1引起更少的毒性,特别是不可逆转的毒性如多发性神经病,使它成为早期
BC
新辅助治疗一个可行的候选药。
西部德国研究小组(WSG)
ADAPT
(依托辅助动态标记物指导的早期乳腺癌风险评估和治疗反应预测个体化治疗优化试验)
HER2
阳性
/ HR
阳性研究是一项前瞻性、随机
II
期临床试验,比较
T-DM1
联合或不联合
ET
与曲妥珠单抗联合
ET12
周的新辅助治疗疗效。因靶向联合内分泌治疗被证实有效,可替代系统化疗,故本实验特异性针对内分泌受体阳性且
HER2
阳性的早期乳腺癌患者此设计与
WSG ADAPT
伞式试验的总体策略一致,通过评估早期反应作为预后预测指标识别降阶梯治疗的可能性。在
HER2
阳性
/ HR
阳性乳腺癌患者中,降阶梯策略包括避免使用化疗。在
HER2
阴性
/HR
阳性患者,早期(增殖)反应对预后有较强的提示作用
[7,8]
。在HER2阳性的患者中,类似的预测指标可降低毒性和降低成本。
患者与方法
患者
18岁以上妇女组织学确诊单侧原发性、无远处转移的
BC
,雌激素受体(
ER
)和
/
或孕激素受体阳性(
≥
1%),
HER2
阳性
[9]
,拟接受新辅助化疗的患者符合入组条件。适合入组者还需参考体力评分(东部肿瘤协作组评分
≤
1或卡诺夫斯基指数
≥
80%),正常器官功能和心功能。研究开始前签署知情同意书。
排除标准包括对试验中采用的试剂过敏;之前所患恶性肿瘤无病生存
<
10年(除已根治的皮肤基底细胞癌或宫颈原位癌);不可手术和炎性
BC
;接受过或正在接受细胞毒药物治疗;正在接受其他实验药物的治疗;参与另一个临床试验;已知
2
级或以上的多发性神经病变;可能妨碍参与研究的严重、相关并发症或可能与细胞毒性药物相互作用的治疗。
该方案得到了当地所有相关的伦理委员会的批准。试验在独立的数据安全监督委员会的监督下进行。经费赞助机构不参与研究设计、数据收集、分析、解释或报告。
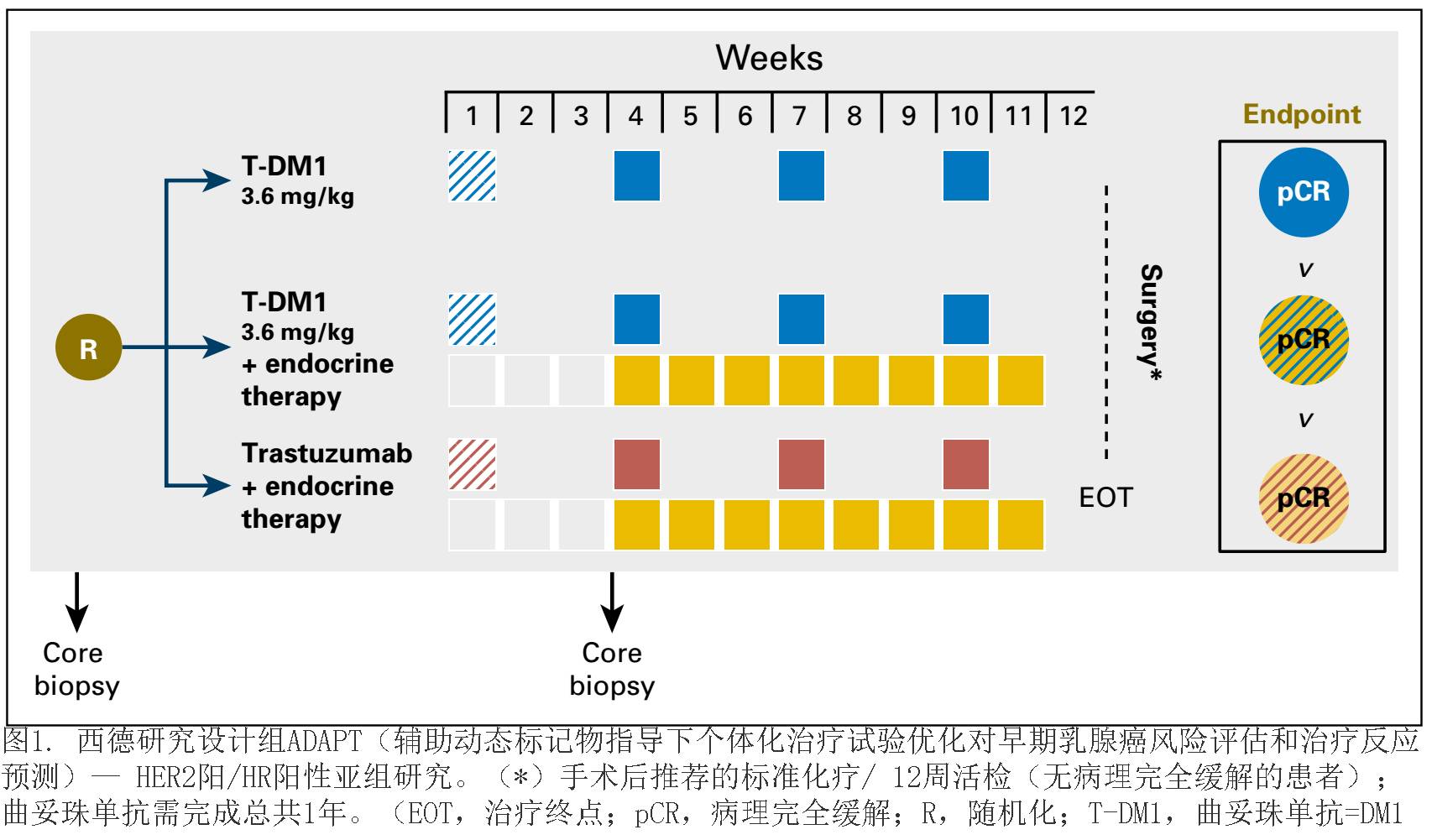
试验设计
在本项前瞻性、多中心、随机II期试验中,符合条件的患者被随机(
1:1
)分配到
T-DM1
组
(
每
3
周
3.6 mg/kg
体重, 4个周期),或
T-DM1
联合
ET
,或曲妥珠单抗(负荷量
8 mg/kg
,随后每三周
6 mg/kg
,3个以上周期)联合
ET
;
ET
药物绝经前妇女推荐他莫昔芬,而绝经后妇女推荐芳香化酶抑制剂。绝经前患者允许使用促性腺激素释放激素类似物。新辅助试验性治疗后,
3
周内必须手术(或用空芯针穿刺活
检组织学证实的非病理性完全缓解)。
pCR
在手术中被定义为乳腺和淋巴结无浸润性肿瘤。临床淋巴结阴性患者前哨淋巴结活检的时间(在治疗前或治疗后)由研究者自行决定。所有临床淋巴结阳性患者完成新辅助治疗后需要腋窝淋巴结清扫术。
所有患者新辅助治疗后,推荐遵循国家标准的四个周期表阿霉素和环磷酰胺化疗(
EC
)、随后
12
周的紫杉醇周疗(曲妥珠单抗和
ET
治疗的患者)、
40
周的曲妥珠单抗和放疗(如果有放疗指征)。新辅助试验治疗
12
周后手术提示
pCR
的患者,由研究者决定是否无需辅助化疗。早期反应由中心病理评估采用
Ki-67
兔单克隆抗体
30-9
(
Ventana Medical Systems
,
Tucson
,
AZ
)比较基线和治疗中(
3
周活检)的
Ki-67
检测进行评估,至少检测
500
个侵袭性肿瘤细胞。治疗
3
周后早期反应被定义为增殖下降
≥
30%
或低细胞密度(
<500
个肿瘤细胞)。
目标
主要目标是比较T-DM1组(组
A
和
B
)和曲妥珠单抗组(
C
组)患者获得
pCR
的比例。次要目标包括早期反应对
pCR
率、无事件生存、总生存和安全性(新辅助治疗期间的毒性反应数据)的影响。
统计分析
假设T-DM1组至少
25% pCR
率(组
A
和
B
),相比曲妥珠单抗组
10% pCR
率(
C
组)
,
两个单侧检验的比例(
A
组比
C
组和
B
组比
C
组)被设定为
0.25
。尤其是,选择样本大小(假设
5%
脱落)分别在每个试验中产生大于
0.8
的效力。我们报道了双侧检验的
P
值(Fisher精确检验)和
pCR
率相对差值近似
95%
的置信区间
(pX
-
pY)
,并在条形图中显示。
为检验早期反应和pCR率之间的关联,比值比(
OR
;
pCR
比早期反应)以精确置信区间(
95%
,超几何分布、平均分配法)和相应的
Levin
归因危险度(人群归因危险分数)计算,即
Rearly response
。基于排除了未行早期评估患者的数据计算得出的OR,在先验假设包含未行早期评估患者的数据可能不依赖
pCR
率而(仅)依赖早期评估的情况下,提供了一个无偏倚的估计。支持这个先验假设的依据来源于一份中期评估:早期反应显示与
pCR
率有关,可降低
pCR
率在删失数据中的重要性。
以Fisher精确检验计算所有
P
值以评估次要终点。依据通用不良事件术语标准3.0版报告毒性反应。在安全性分析中,计算获得超过
200
个
P
值以作标记,但并未经多重检验校正,不能提示两臂间不良反应的差异。表1列出了
P
<0.05
的不良事件;相应的
P
值不是一个对统计意义综合评判的衡量指标。Python 2.7.12用于(
Python
软件基金会,比弗顿,俄勒冈州)进行统计分析。
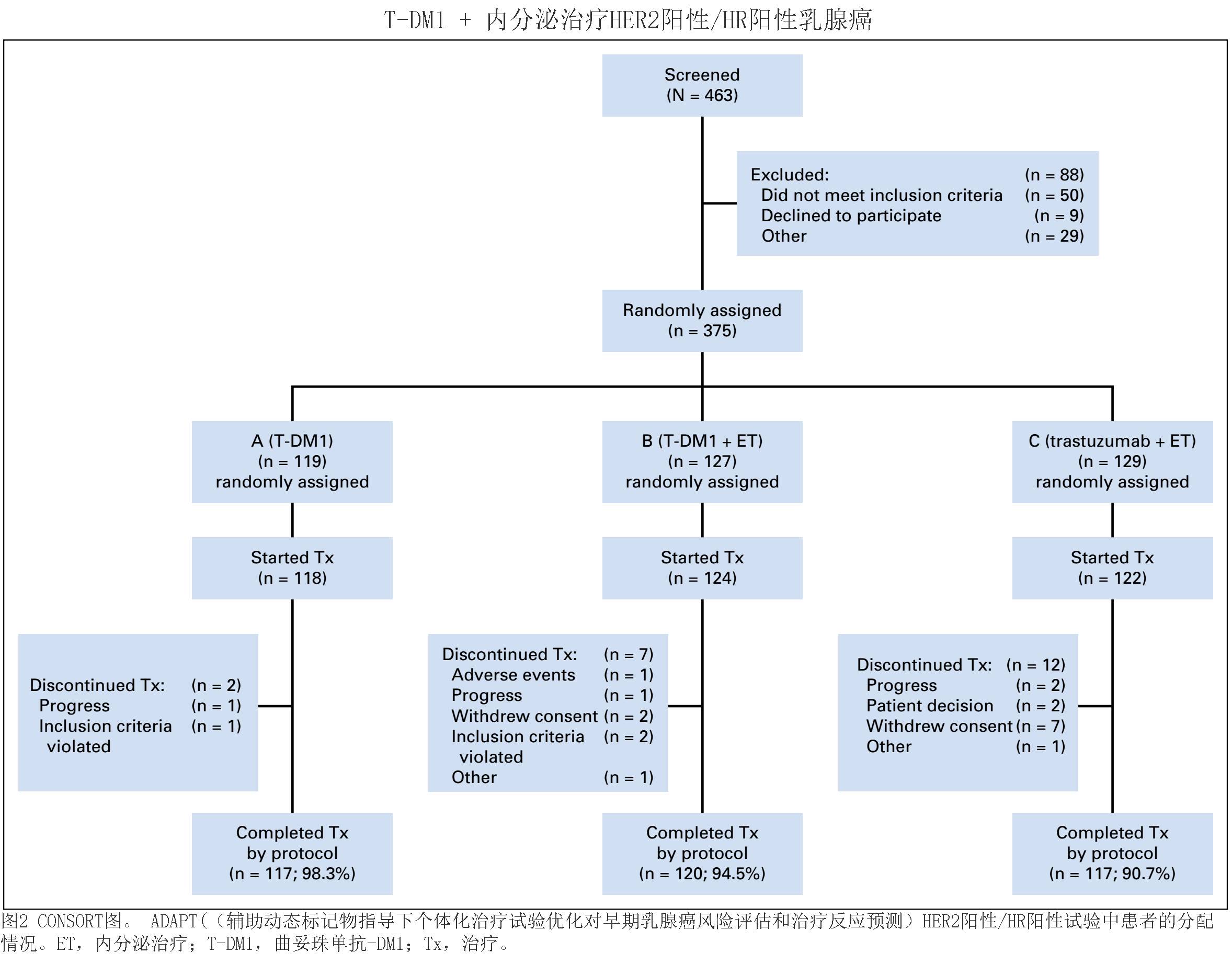
结 果
从2012年
10
月到
2015
年
3
月,共筛选了
463
名患者,从
48
个中心随机分配了
375
名患者。意向治疗集包括
119
例患者随机分到
T-DM1
组,
127
例患者分到
T-DM1+ET
组,和
129
例患者分到曲妥珠单抗
+ET
组。共有
98.3%
的患者完成
T-DM1
治疗;
94.5%
的患者完成
T-DM1+ET
治疗;
90.7%
的患者完成曲妥珠单抗
+ET
治疗。研究流程如
CONSORT
图所示(图
2
)。
患者特征列于表2,三组之间较为平衡(
A
组,
T-DM1
;
B
组,
T-DM1+ET
;
C
组,曲妥珠单抗
+ET
)。三组的中位年龄分别为
50
、
51
和
51.5
岁;三组的
cT1
肿瘤分别为
50.4%
、
48.8%
和
46.5%
;三组的
cN0
肿瘤分别为
71.4%
、
75.6%
和
70.5%
;三组的孕激素受体阴性肿瘤分别为
17.6%
、
15.7%
和
16.3%
。
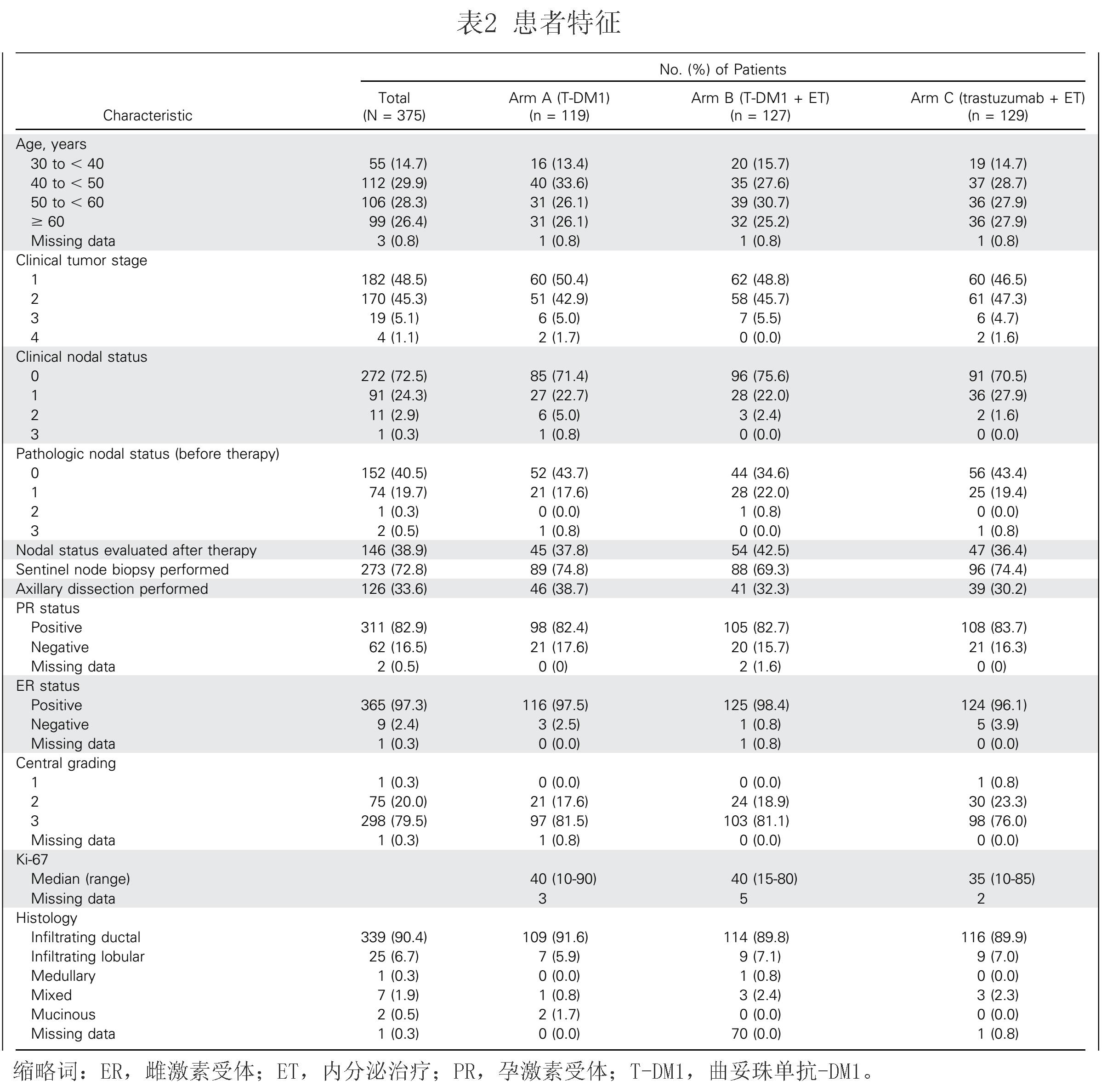
375例患者中
359
例(
95.7%
)行外科手术(或组织学确认未能达到
pCR
)。 接受
T-DM1
的患者
41.0%
获得
pCR
(
ypT0/is/ypN0
),
T-DM1+ET
治疗者
41.5%
,曲妥珠单抗
+ET
治疗者
15.1%
。任何其中一个
T-DM1
组和曲妥珠单抗
+ET
组间差异高度显著(均
P
<0.001
)。
PCR
差异
95%
的置信区间分别为
T-DM1
组
15%
对曲妥珠单抗
+ET
组
37%
;
T-DM1+ET
组
16%
对曲妥珠单抗
+ET
组
37%
,以及
T-DM1+ET
组
12%
对
T-DM1
组
13% (
图3A
).
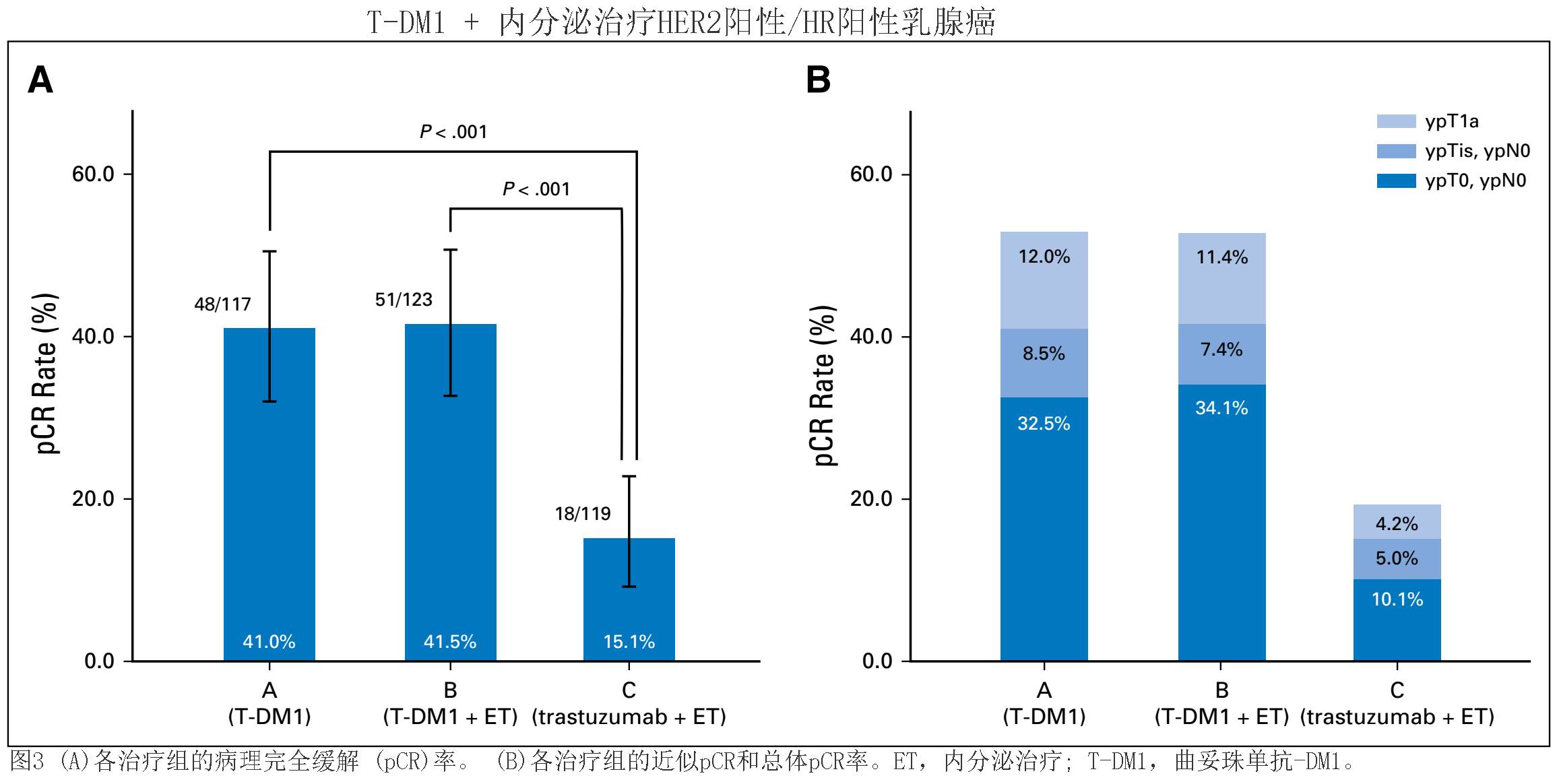
接近
pCR
(ypT1a或
ypT0/is)
的百分率为
A
组
52.9% (62/117
患者
); B
组
52.9% (65/123
患者
);
以及
C
组
19.3% (23/119
患者
)
。总
pCR (ypT0, ypN0)
的百分率为
A
组
32.5% (38/117
患者
);B
组
34.1% (42 /123
患者
) ;
以及
C
组
10.1% (12/119
患者
) (
图3B
). ypT0/is率为
A
组
42.4% (50/118
患者
) , B
组
43.4% (53/122
患者
)
,以及
C
组
19.2%
。
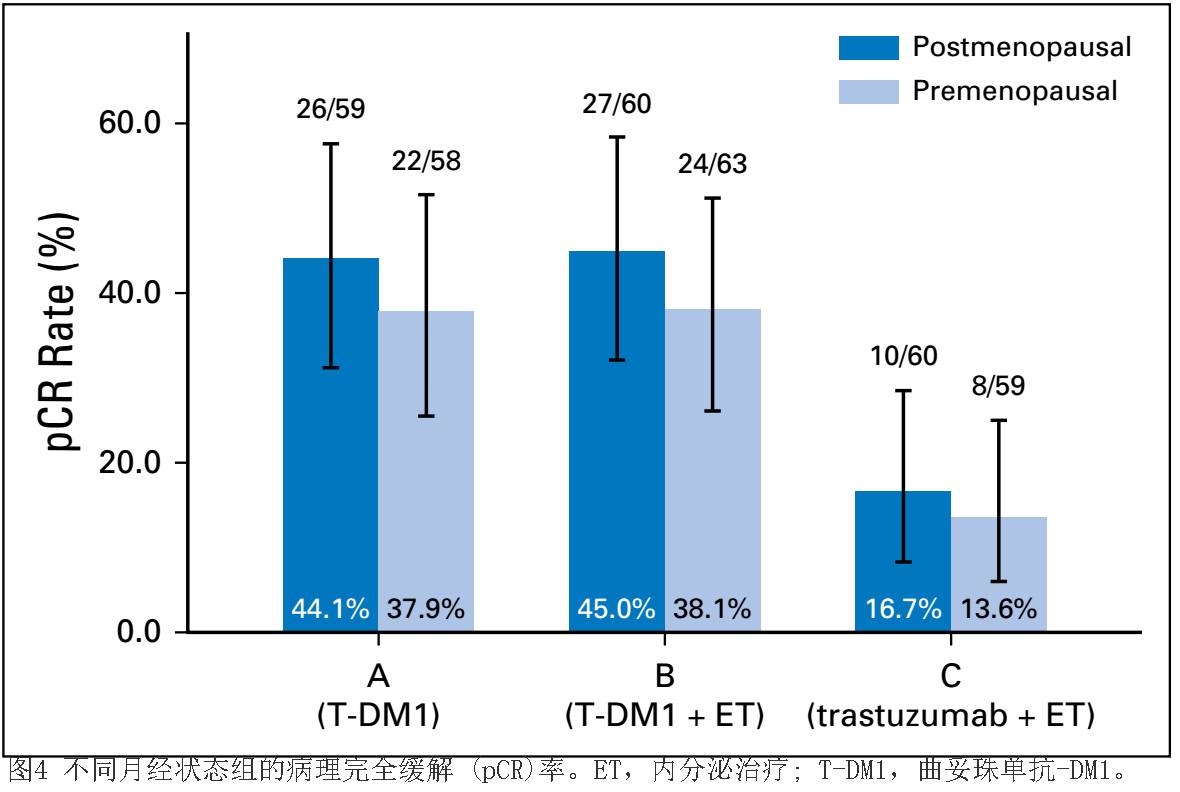
一项针对绝经后对绝经前患者的探索性分析表明PCR率分别为
44.1%
对
37.9%
(
T-DM1
);分别为
45%
对
38.1%
(
T-DM1+ET
);分别为
16.7%
对
13.6%
(曲妥珠单抗
+ET
;图
4
)。虽然在绝经后妇女中
pCR
率较高,但差异在入组患者中无统计学显著性(
P
=0
.
3
),治疗组内亦无显著差异(
A
组:
P
=0
.
57
;
B
组:
P
=0
.
47
;
C
组:
P
=0
.
8
)
。绝经前患者没有接受促性腺激素释放激素类似物和芳香酶抑制剂。
最初假设的早期反应的判断标准——根据预设的中期分析报告的调整——为增殖下降,定义为一个治疗周期后
Ki-67
水平减少≥
30%
。
200
例行两种
Ki-67
测定(
50%
)的患者中有
100
例(
50%
)为假设标准的早期应答者;
375
例患者中余下
175
例(
46.67%
)未能实现测定
Ki-67
,或者因为使超声引导下活检不可能实现的早期反应(和超声显影不佳),或者因为低细胞密度(
<500
个需要用于
Ki-67
评估的侵袭性肿瘤细胞)。低细胞密度(至少)是代表明显的早期反应的一种表现,因此原来的早期反应标准在中期评估后放宽,将低细胞密度包括其中
[10]
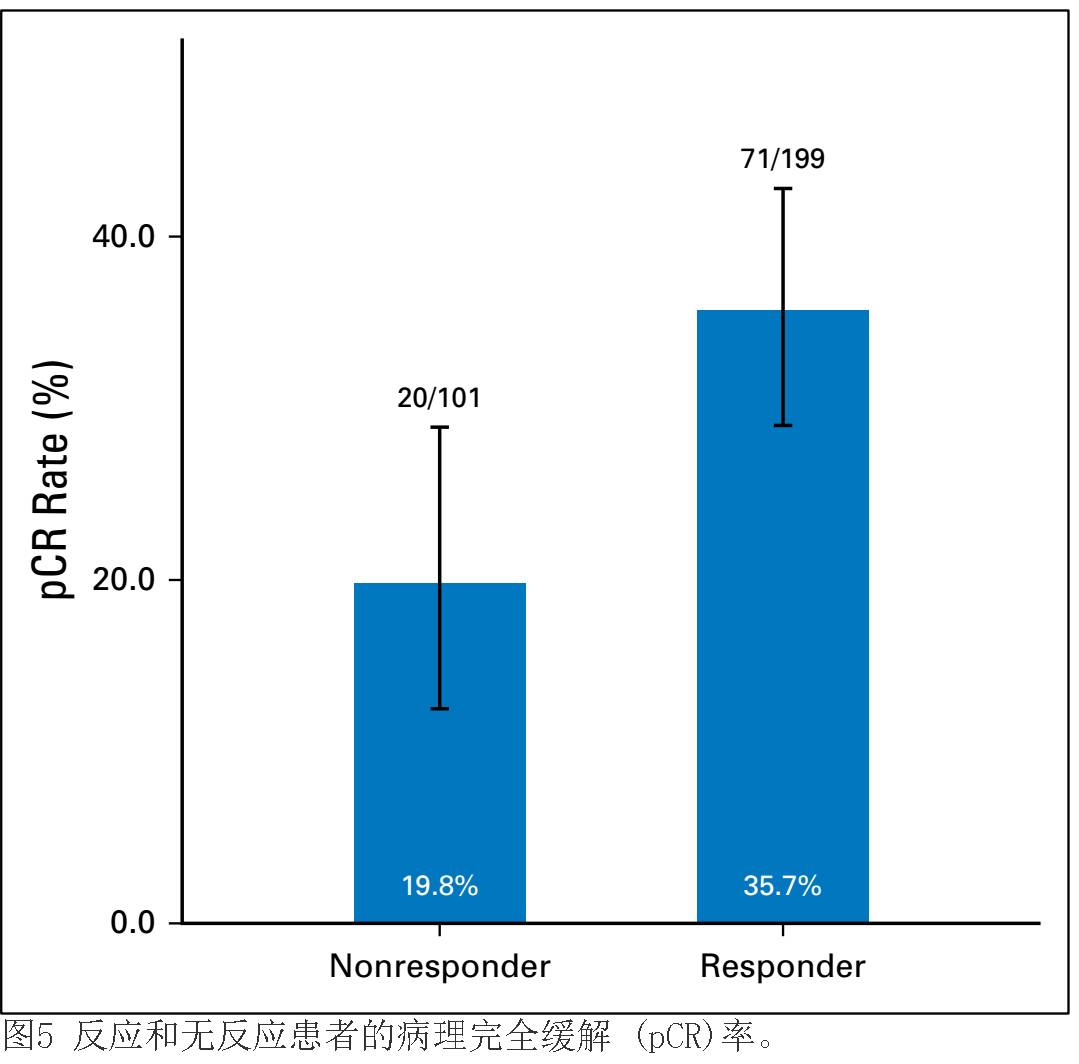
。当两标准相结合后,304/375例患者评估具有早期反应,并且其中
203
例患者(
67.1%
)被归类为早期应答者。
pCR
发生在早期应答者的可能性(
71 [ 35.7% ] /199
例患者;
OR
,
2.2
;
95% CI
,
1.24
至
4.19
)显著高于(
P
=0.005
)无反应者(
20 [ 19.8% ] /101
例患者;
OR
,
1
;精确
CI
,等分配法)。归因危险度
Rer= 0.347
,即患者中整体
pCR
率的
35%
可以归因于早期反应(图
5
)。比较治疗组内反应者与无反应者的
pCR
率(附录图
A1
,仅在线)如下所示:
A
组,分别
39.3%
对
25%
;
B
组,分别
47.4%
对
24%
;
C
组,分别
17.7%
对
12.5%
(
A
组:
P
=0
.
19
;
B
组:
P
=0
.
06
;
C
组:
P
=0.58
)。上述的分析是探索性的,因为
71
例不可评估早期反应,而剩下的
304
例中
4
例
PCR
数据缺失。敏感性分析表明,如果没有考虑到缺失数据,结果可能不可靠。附录表
A1
(仅在线)列出据治疗组合孕激素状态所分的
pCR
和早期反应。
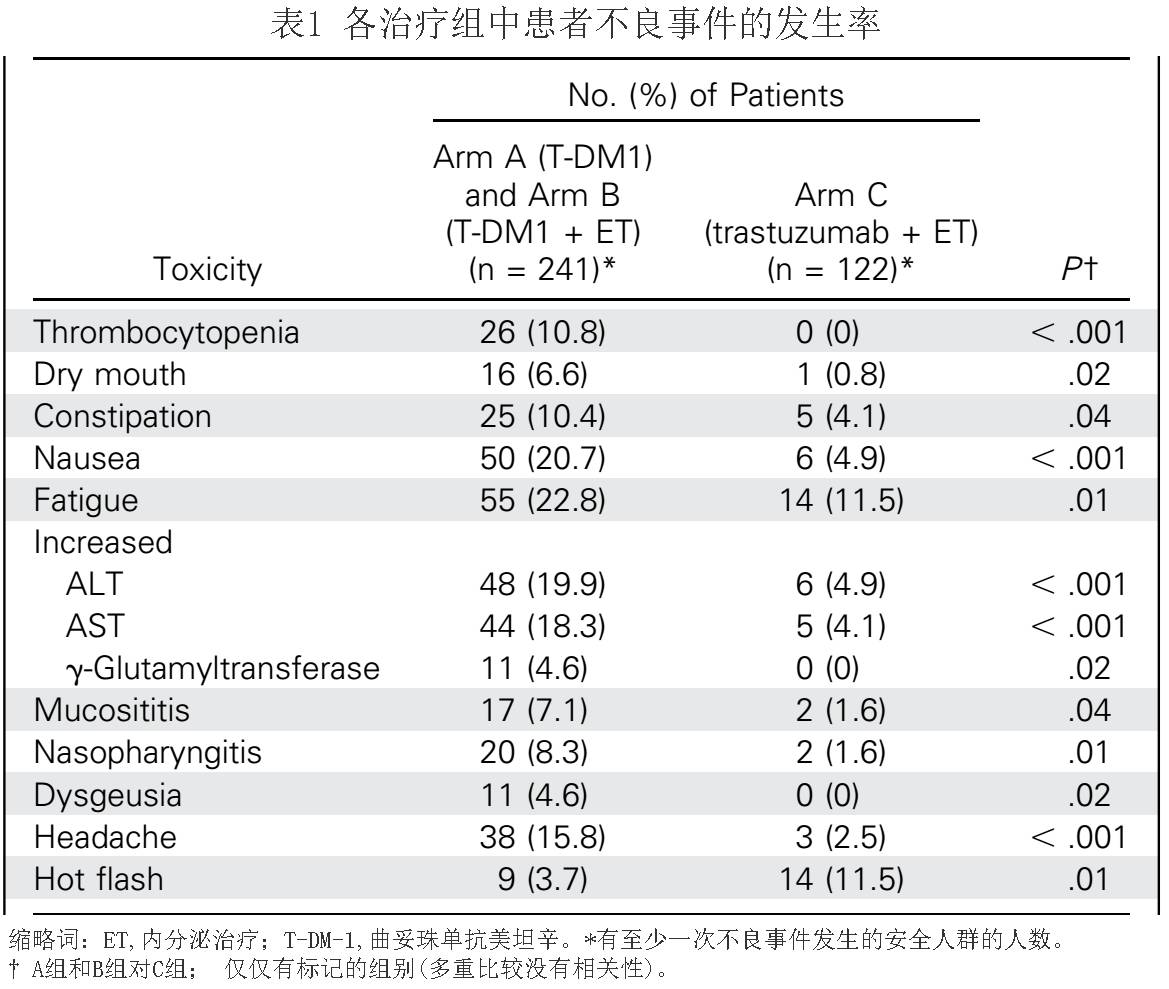
在安全性分析方面,合并T-DM1组中出现至少一个
3
级或以上副反应的患者的数目没有明显增高;
A
组和
B
组中
18/241
(
7.5%
)例患者出现至少一个
3
级或以上副反应,而
C
组的比例为
5/122
例(
4.1%
);
P
=0 .26
。大多数不良反应为转氨酶升高(
ALT
和
AST
;
n = 103/112
例)。
17
例治疗相关的严重不良事件报告(
T-DM1
,
5.3%
;曲妥珠单抗
+ET
,
3.1%
),包括
4
例
3
级或以上的严重不良事件(
T-DM1
,
n = 2
;曲妥珠单抗
+ET
,
n = 2
),其中
1
例
ALT
升高,
1
例角膜囊肿,
1
例高血压危象和
1
例超敏反应;所有患者均恢复且无后遗症。总之,
T-DM1
没有检测到新的安全事件,所有三个治疗组整体毒性是相似的(表
1
)。
A组
9/118
例(
7.6%
)患者出现了剂量减少,
B
组
2/23
例(
1.6%
),
C
组
0/122
例(
0%
)。
A
组、
B
组和
C
组无额外的化疗的比例,分别为
19
例(
40%
)、
24
例(
47%
)和
4
例(
22%
)。
讨 论
正如在转移性乳腺癌试验中所证明的毒性低、疗效高的抗HER2新化合物
T-DM1
为
HER2
过表达的早期
BC
提供了一个新辅助治疗的理想选择。在
WSG ADAPT
伞式概念下设计的
HER2
阳性
/ HR
阳性子实验评估了该化合物
12
周新辅助治疗对手术证实的
pCR
(
ypT0 / ypN0
)的影响(与曲妥珠单抗
+ET
相比)。
pCR
是否作为一种生存率评估的替代指标,已经在美国食物药品监督管理局基于新辅助治疗结果提出的条件性审批流程中被深入讨论
[11]
。根据一项来自11,955例患者的荟萃分析数据,
Cortazar
[11]
等证明严格定义的pCR(
ypT0 /ypN0
或
ypT0/is/ ypN0
)较仅乳腺肿瘤消灭(
ypT0 /
任何
ypN
)与提高生存率更密切相关。三阴乳腺癌患者(无事件生存率、危险比为
0.24
)和接受曲妥珠单抗治疗的
HER2
阳性
/ HR
阴性患者(无事件生存率、危险比为
0.15
)的
pCR
与长期生存之间的相关性最强。在
HER2
阳性
/ HR
阳性患者,
pCR
亦显著与生存相关
[11]
。不同于既往一些研究
[12,13]
,最近一项荟萃分析仅对HER2过表达的患者(
n = 5768
)进行研究,证实了
pCR
和患者结局之间密切关联;未经筛选的
HER2
阳性患者危险比为
0.37
,其中
HR
阴性者为
0.29
,
HR
阳性者为
0.52
。虽然
HER2
阳性
/ HR
阳性患者
pCR
与生存的关联不如阴性
HER2
阳性
/HR
阴性患者密切,但是手术确认的
pCR
是一项对新辅助各种产生假说的抗
HER2
治疗疗效判断的有效指标
[14]
。
在ADAPT试验中
T-DM1
组
pCR
率超过
40%,
支持含
T-DM1
的新辅助治疗用于
HER2
阳性
/ HR
阳性患者,而曲妥珠单抗联合
ET
组相对较低的
pCR
率使这种组合不鼓励作为临床可行的选择。事实上,含
T-DM1
方案的
pCR
率与除本研究外唯一一项采用含
T-DM1
新辅助治疗的
KRISTINE
试验报道结果较一致,该项研究将患者随机分为
6
个周期新辅助多西他赛、卡铂和曲妥珠单抗及帕妥珠单抗或
6
个周期的
T-DM1+
帕妥珠单抗
[15]
。
在关于转移性乳腺癌的MARIANNE研究中,帕妥珠单抗联合
T-DM1
没有增加疗效
[5]
。Gianni等
[16]
报道12周新辅助多西紫杉醇,帕妥珠单抗联合曲妥珠单抗的
pCR
率为
39.3%
和
45.8%
(仅指乳腺病灶),相比之下帕妥珠单抗联合曲妥珠单抗的
pCR
率为
11.2%
和
16.8%
(仅指乳腺病灶);在未经选择的
HER2
阳性的早期
BC
中,多西紫杉醇联合曲妥珠单抗的
pCR
率为
29%
和
21.5%
(仅指乳腺病灶),而多西紫杉醇联合帕妥珠单抗的
pCR
率为
24%
和
17.7%
(仅指乳腺病灶)
[16]
。在HR共同表达的患者,相应的
pCR
率(仅指乳腺病灶)分别为
26%
,
5.6%
,
20%
,和
17.4%
。约三分之一的患者为局部晚期
BC
。有严重不良的患者比例最低的是帕妥珠单抗联合曲妥珠单抗组(
3.6%
),而多西紫杉醇联合帕妥珠单抗和曲妥珠单抗组为
10.3%
,多西紫杉醇联合曲妥珠单抗
16.8%
,与多西紫杉醇联合帕妥珠单抗
17%
。
TRYPHAENA试验评估了双重
HER2
阻断(帕妥珠单抗联合曲妥珠单抗)与不同的化疗方案相结合的疗效,其中约五分之一的患者为局部晚期
BC
。在
HER2
阳性
/ HR
阳性的患者,采用三周期氟尿嘧啶、表阿霉素和环磷酰胺化疗和三周期氟尿嘧啶、表阿霉素和环磷酰胺化疗(无双重
HER2
阻断)序贯三周期多西紫杉醇
+
双重
HER2
阻断可获得的
pCR
率(仅指乳腺病灶,
ypT0/is
)分别为
46.2%
和
48.6%
,而接受六周期辅助多西紫杉醇、卡铂和双重
HER2
阻断的患者获得的
pCR
率为
50%
[17]
。
新辅助GEPARSEPTO试验
[18]
比较了12周白蛋白紫杉醇
125mg/m
2
周疗序贯四周期表柔比星+环磷酰胺对
12
次的紫杉醇周疗序贯四周期表柔比星
+
环磷酰胺的疗效,肿瘤平均大小为
30
毫米。在
HER2
阳性
/ HR
阳性肿瘤中,
pCR
率(
ypT0/ypN0
)在白蛋白紫杉醇和紫杉醇组分别为
56.4%
和
50%
。
3
级到
4
级疲劳出现在大约
5%
的患者中;手足综合征
1%
;外周多发神经病变
6%
;发热性中性粒细胞减少症
4.4%
。
虽然在其他试验中观察到的PCR率稍高,但这项针对
HER2
阳性
/ HR
阳性患者的
ADAPT
试验
40%
的
pCR
率具有重要的临床意义,特别是因为毒性如此低:没有脱发、周围多发神经病变或发热性中性粒细胞减少症被报道。主要毒性反应为
ALT
或
AST
改变、血小板减少和疲劳,未发现新的不良反应。在
47
例获得
pCR
(
40%
)患者中,患者和医生选择不接受额外的化疗,这些患者的生存随访将被记录和报告。
针对HER2阳性
/ HR
阳性患者的
ADAPT
试验的次要目的是评估
ET
加入抗
HER2
治疗的获益。
Rimawi
等
[19]
给予患者(n = 64;肿瘤大小的中位数
6
厘米)
12
周曲妥珠单抗、拉帕替尼与来曲唑加或不加促黄体激素释放激素激动剂(取决于绝经状态);
pCR
(
ypT0/is/ypN0
)总体为
22%
,
ER
阳性为
18%
和
ER
阴性为
28%
。值得注意的是,近
pCR















