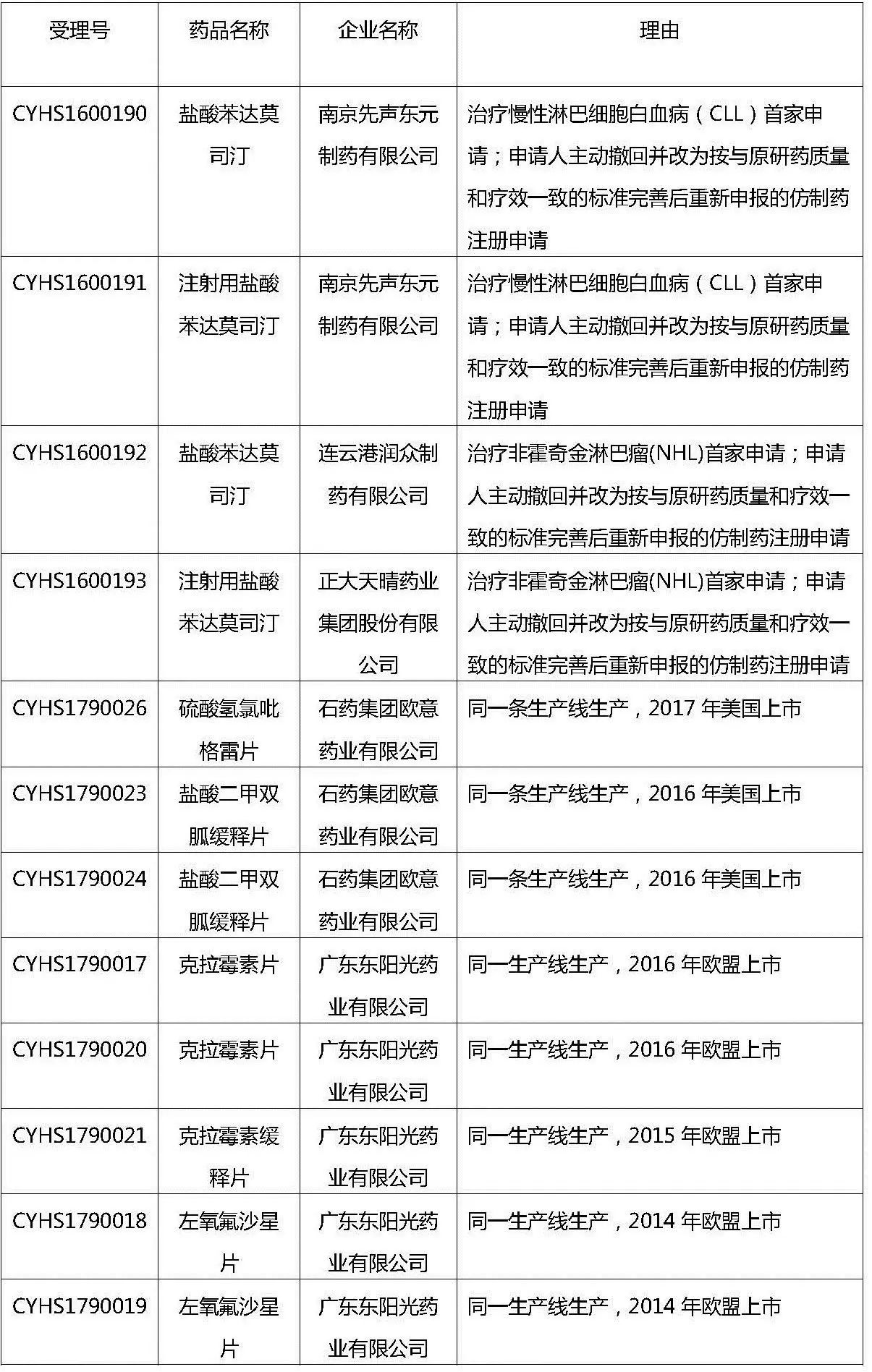
6月1日,CDE公示了第十八批拟纳入优先审评的品种清单,来自先声东元、正大天晴、石药欧意、东阳光这4家企业的12个受理号入选,涉及苯达莫司汀、氯吡格雷、二甲双胍、克拉霉素、左氧氟沙星等5个临床常见大品种。
第十八批拟纳入优先审评程序药品注册申请公示名单
上述品种入选优先审评的理由符合CFDA去年2月26日发布的《总局关于解决药品注册申请积压实行优先审评审批的意见》中关于“
优先审评审批的范围
”政策规定。
-
在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请。
-
列入《关于开展药物临床试验数据自查核查工作的公告》(食品药品监管总局2015年第117号)的自查核查项目,申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请;
其中南京先声东元和正大天晴的注射用苯达莫司汀之前均是按3.1类新药报产,在7.22临床自查中主动撤回后,又重新按照4类仿制药报产,凭借不同适应症的首仿身份获得了优先审批资格。这是继第十批优先审评名单中的“
布洛芬注射液
”之后第2次出现以“临床自查中撤回品种,与原研药一致”的理由获得优先审评。
此批优先审评名单中最让人关注的是3个
国内外同一条生产线生产
的品种,包括石药欧意已经在
美国
上市的
硫酸氢氯吡格雷片
(2017美国上市)、
盐酸二甲双胍缓释片
(2016美国上市),以及东阳光已经在
欧盟
上市的
克拉霉素片
(2016欧盟上市)、
克拉霉素缓释片
(2015欧盟上市)、
左氧氟沙星片
(2014欧盟上市)。
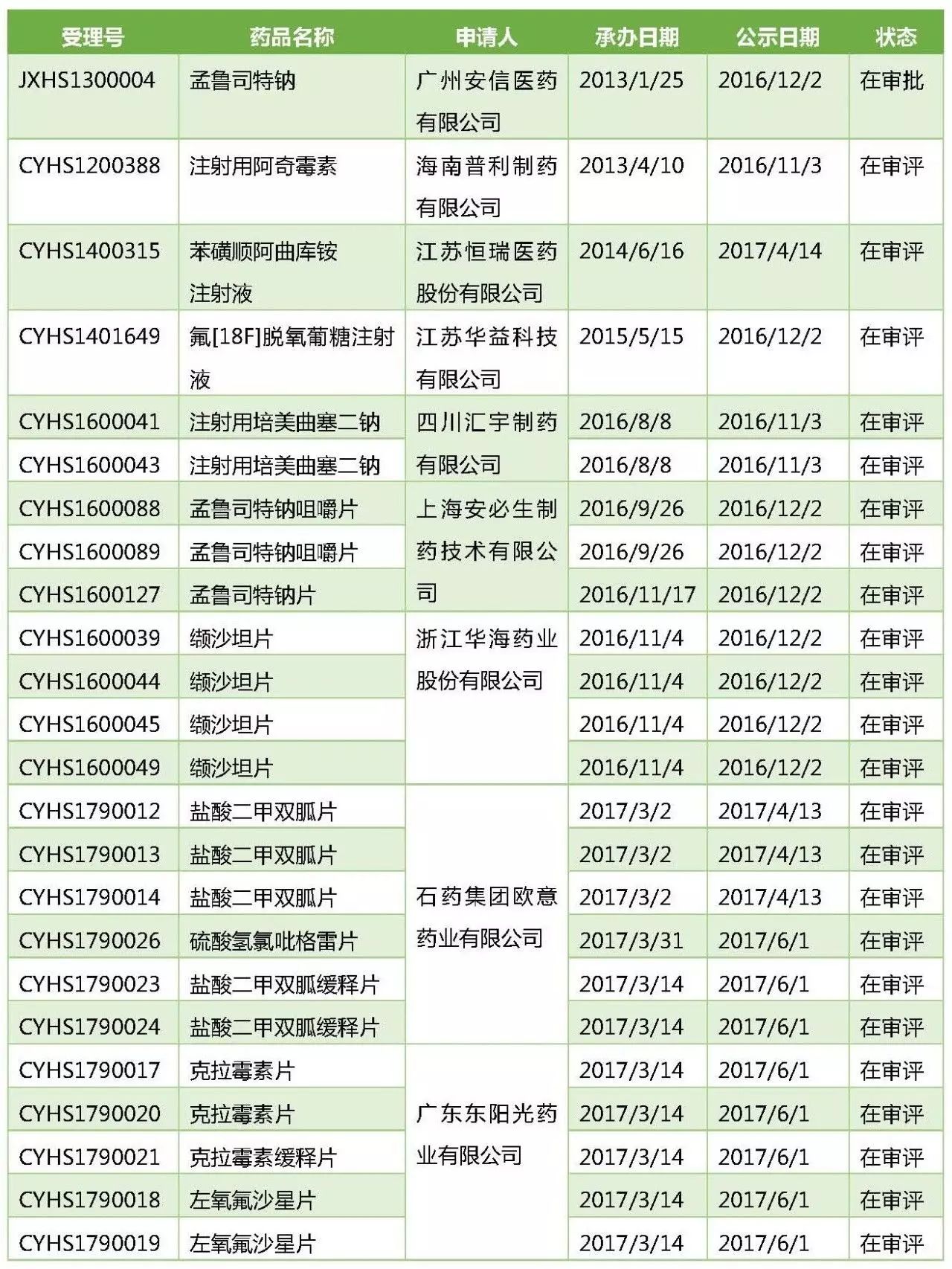
再加上第十二批优先审评名单中"国外已上市同步申请国内上市"的
孟鲁司特钠片/咀嚼片
(安必生)、
缬沙坦片
(华海),第十五批优先审评名单中“同一生产线生产,已在美国上市,申请国内上市的”
苯磺顺阿曲库铵注射液
(恒瑞)、
盐酸二甲双胍片
(石药欧意),我们可以观察到以下趋势:
-
CDE对这类品种优先审评理由的描述越来越明确,包括同一条线生产、国外上市地区、上市年份。信息更充分,意味着优先审评的理由无可辩驳,比如下图所示,CDE这次公布的拟纳入优先审评名单中,除了氯吡格雷外,其他几个国内外共生产线品种似乎不需要有异议……
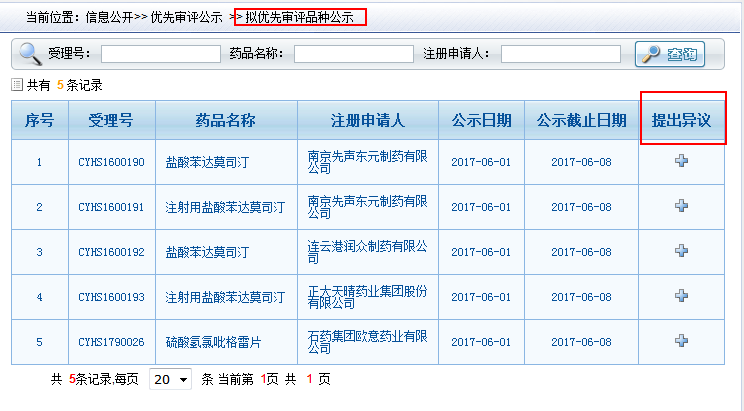
-
目前享受到“出口制剂在国内申请上市可获得优先审评”这一政策红利的主要是华海、恒瑞、石药、东阳光等国内最早一批开展制剂国际化业务的药企,他们在制剂国际化上的产品线布局和经验都更丰富。
-
制剂国际化能带来的好处已经被更多的制剂出口企业深刻意识到,石药欧意药业已经先后有盐酸二甲双胍片、盐酸二甲双胍缓释片、硫酸氢氯吡格雷片
的上市申请被纳入优先审评, 特别是氯吡格雷2月2日才获得FDA批准,国内的上市申请2017-03-31即被承办受理,说明石药欧意是在氯吡格雷获得FDA批准前就想好要利用政策转战国内,也可以由此推测,石药很可能会把所有出口品种都在国内报一遍。
再比如东阳光,2014年欧盟上市的左氧氟沙星片和2015年在欧盟上市的克林霉素缓释片在时隔数年后重新在国内申报上市
(均于2017-03-14获得CDE承办)
,显然也是意识到了政策的好处。
在之前文章“
石药、恒瑞出奇兵,留给“二甲双胍”们的时间可能不多了
”提到过,这种国内外共线生产品种,不仅可以借助“优先审评”在国内加快上市,更重要的是批准上市即视为通过一致性评价,进一步享受到招标采购方面的好处。
不出意外的是,后面肯定会有更多像东阳光这样的企业,像氯吡格雷这样的出口制剂纷纷转战国内抢夺市场
。现在有一个关键问题,还有哪些符合条件的出口制剂会杀回国内?特别是对于需要在规定时间完成一致性评价的289品种来说,如果对手都已经杀到身边了还不自知,那会是一件很可怕的事情。
纳入优先审评的国内外共生产线品种
举个“
孟鲁司特钠咀咀嚼片
”的例子,虽然不属于289品种,没有2018年底前完成一致性评价的压力,国内生产厂家也只有2家,俨然是你好我也好的形势……
国内上市的孟鲁司特钠制剂
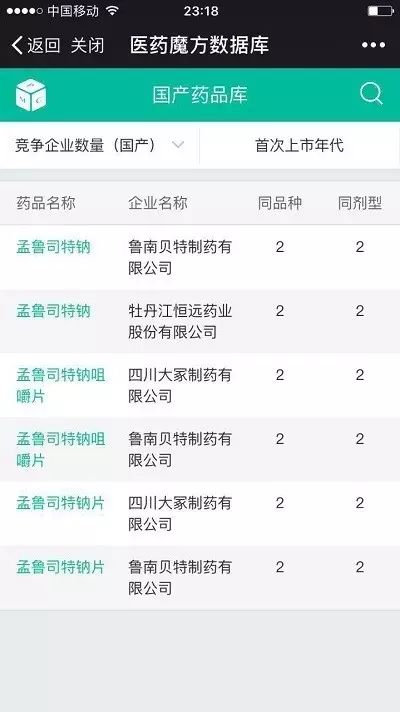
但要注意到,安必生的孟鲁司
特钠咀嚼片(CYHS1600088)已经被优先审评,目前处于“在审评在审批”中,而石药欧意的孟鲁司特钠咀嚼片4月18日获得了FDA批准
(见:
石药「孟鲁司特钠咀嚼片」获FDA批准
),
按照石药目前的策略,在国内申报上市并获得优先审评也是早晚的事。
如果安必生和石药的孟鲁司特钠咀咀嚼片上市并视同通过一致性评价,那鲁南和四川大冢难言高枕无忧……毕竟国家政策文件规定了:
同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种
。
说到最后,有必要提醒一下盐酸二甲双胍片、硫酸氢氯吡格雷片这两个需要在2018年底前完成一致性评价的品种,根据国家局的统计,涉及到的药品文号数量分别是116 和6个。出口的制剂品种已经杀回,国内的相关企业需要提速了……
相关阅读:
「优先审评」下的药审速度 ——最快审批仅需17天





