目前已经发现的单基因遗传疾病有 7000 多种,其中已经明确致病基因的有 4000 多种。单个病种的单基因遗传病发病率较低,但架不住种类多啊。所以在出生活婴中的总体发病率和人群的总体患病率并不低。
大部分单基因病具有致死性、致残性或致畸性,大部分至今尚无有效的治疗手段,且普通婚检无法检出。广州医科大学附属第三医院的范勇博士从事遗传病的干细胞基因治疗和基因编辑的研究。
2016年,他在J Assist Reprod Genet上发表了题为“Introducing precise genetic modificationsinto human 3PN embryos by CRISPR/Cas-mediated genome editing”的文章。利用CRISPR/Cas9基因组编辑技术在人类3PN精卵中引入CCR5基因的精确修饰。

在人类胚胎上使用基因编辑技术,伦理问题一直是一道无法回避的坎。在2016年的2月,英国人工授精与胚胎学管理局正式批准了全球首例在人类胚胎上使用基因编辑技术的实验申请。

对此,范勇博士认为:
“在伦理问题和科学问题都妥善解决以前,任何试图通过对早期胚胎进行改造并制造转基因婴儿的行为都要严格禁止”
。范勇博士团队在国际上第二篇关于人类胚胎基因编辑的报道中,用的就是无法继续发育的废弃胚胎,使用CRISPR/Cas9对于艾滋病和β地中海贫血相关基因进行编辑,从而为治疗遗传性疾病提供理论依据。
以遗传异质性疾病中发病率最高的耳聋为例,遗传性耳聋的发病率约为千分之0.5到千分之1.5。聋人群体中“聋-聋”婚配极为常见。虽然耳聋出生干预措施可预防不同基因型耳聋夫妇后代患病,但对于我国为数众多的同基因型夫妇(约占22%)而言,其后代耳聋风险仍为100%。
要想治愈并防止发病基因遗传给后代,实现孕育健康后代的梦想,现今最可行的办法就是在胚胎细胞水平进行基因治疗。
2015 年4月,中山大学黄军就博士就利用 IVF 废弃的 3PN 胚胎研究CRISPR/Cas9在人类早期胚胎中对地中海贫血突变位点的基因编辑,虽然有效,但还存在脱靶效应、胚胎嵌合性和同源重组效率低等问题。
范勇博士团队于2014年4月到9月,在87 名志愿者那里收集了213枚3PN胚胎。运用CRISPR/Cas9技术,对其中的CCR5基因进行了编辑,结果在26个编辑胚胎中有4个被成功编辑。
胚胎均在实验三天后被销毁。

A是靶向CCR5位点的示意图;B是人3PN受精卵(左图)和体外的8-16细胞期(右图)
他们将Cas 9 mRNA (100ng/ul)和gRNA (50ng/UL)注入了3PN受精卵。将供体寡糖-1 (99bp)或寡糖2 (99bp)或dsDonor (1 kb)与Cas9 mRNA、gRNA混合并注入胚胎。结果如下:
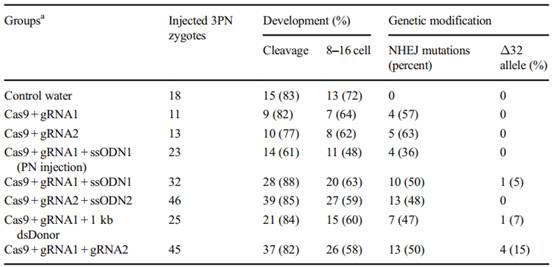
将含有CCR5Δ32等位基因人类3PN胚胎的RCR产物进行亚克隆并进行测序。
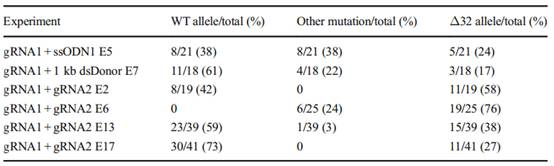
通过共同注入Cas9 mRNA、gRNA和供体DNA,范勇团队成功的将CCR5Δ32突变引入了人类早期的3PN胚胎。但在这些含有经编辑的CCR5Δ32基因的胚胎中,同一位点的其他基因由于保持原基因型或包含缺失突变不能被完全控制。
因为本次研究使用的是没有已知遗传疾病捐助者的3PN胚胎,选择引入天然存在的等位基因作为发生精确遗传修饰的测试。与2PN胚胎相比,3PN胚胎多了一个精子核并且能够进行大量的体外发育。
这项研究结果表明,
类似的技术可以应用于纠正人类早期胚胎中的致病突变。尽管还有着不同效率和特异性,但其他可编程内切核酸酶也可以通过相似的方式应用。
在目前,依然存在着几个主要科学问题。
1、对于人类中任何种系遗传修饰,其所需的等位基因需要准确预定义。这需要进一步改进精确的修饰效率以及选择含有所需等位基因的胚胎测定法。
2、单细胞阶段后,核酸酶作用导致的遗传嵌合问题需要解决。这方面,种系干细胞的基因组工程可能是一个潜在的解决方案。
3、需要进一步研究和改进技术特异性,以确保不会引入靶外突变。
4、对于任何引入的等位基因,即使是人类中天然存在的等位基因,其引入不同基因背景的效果也需要进行仔细评估。
现在的情况是,基因编辑的研究的确可以影响治疗遗传性疾病的进展,但同时也有重大的技术问题仍有待解决。













