高级研修班
欧美检查互认协议下的欧美和中国官方审计与迎检技巧
2019/4/26-27,杭州
本课程注重案例剖析和执行能力培养,由具有丰富国内外审计经验的英国高级质量总监和国内GMP合规主题专家合璧,传授符合最新监管趋势的审计经验和迎检技巧,在互动中带来全新感受,获取实实在在的能力提升。
随着中国加入ICH以及欧美检查互认协议的推进,GMP监管的国际化和趋严化趋势愈加明显。为帮助制药企业提升药品质量风险和法规符合性缺陷识别能力,允咨基于
制药企业GMP审计合规的疑难与关键问题
,设计出具有实践指导意义的基于药品全生命周期的审计培训课程。
第一天的课程邀请
英国高端合规顾问
进行讲解,将首先针对欧美对我国药品生产企业
现场审计认证检查的特点
、
审计的流程
和
触发点
进行简述。课程的重点将
基于运行过程中生产、质量管理、QC实验室、物料、生产和设备设施系统的风险点、疑难点和关键点
进行梳理分析并探讨合规的可执行的解决方法,讲解过程中引用大量实际的案例加深理解,同时课程对生产企业应对欧盟GMP检查的准备工作包括
内审的关键点和流程
进行阐述。
第二天的课程邀请
GMP法规编委及合规专家
进行讲解,将从
检察官的视角
,基于
国内外质量审计的实际案例及演练
,引导学员如何识别企业内部合规的风险点,抽丝剥茧,寻找根本原因,延申到风险背后的法规解读、体系建立直至纠正预防措施的建立,从而培养学员识别风险和降低风险的思维和能力。
两天的课程注重
实际运行的风险点、难点
并结合
丰富案例
,现场的模拟演练也将在互动和讨论中培养学员实际执行能力。
了解监管趋势和动态,企业运行中各个体系合规的风险点和难点,如何进行检查前的准备工作,提高药品质量风险和法规符合性缺陷识别能力及分析能力,了解建立合规的CAPAs的策略,了解迎检技巧。
掌握如何进行检查前的准备工作,掌握企业运行中合规的风险点和难点,从日常工作中识别缺陷能力及分析能力并建立合规的CAPAs。掌握内审的关键点和难点,迎检现场的答复技巧,了解监管趋势动态。
掌握如何进行检查前的生产部分准备工作,掌握工艺、设备设施、验证和物料管理合规的风险点和难点,掌握从日常工作中识别缺陷能力及分析能力并建立合规的CAPAs,掌握迎检现场的答复技巧,了解监管趋势动态。
掌握如何进行检查前的QC部分准备工作,掌握实验室管理合规的风险点和难点,掌握从日常工作中识别缺陷能力及分析能力并建立合规的CAPAs。掌握迎检现场的答复技巧,了解监管趋势动态。
-
了解欧美及国内GMP检查类型、检查发起与检查方法方式;
-
了解与掌握近几年药品检查缺陷类型与缺陷趋势;
-
掌握生产系统、设施设备管理系统、物料管理系统、质量管理系统、实验室管理的难点和风险点,掌握系统的检查方法及CAPA措施制订;
-
通过案例分析和演练培养发现企业GMP合规风险的能力和思维;
-
通过丰富互动提升迎检技能和迎检执行能力。
Anwarul Haque
英国制药行业全面质量管理(TQM)促进专家、ISPE会员、
GSK、Pfizer、Lilly、Aventis等
欧美著名企业高级技术管理履历 、大型合资企业欧盟项目总监
2019/4/26
(周五)
Anwarul Haque
主题:欧盟官方审计准备及技巧
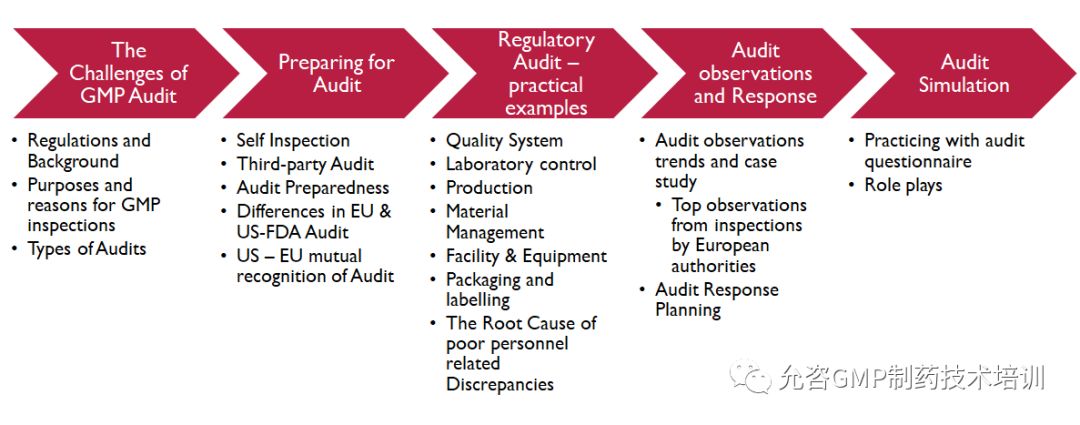
Part1
互认协议下的GMP审计面临的挑战
-
法规和背景概述
-
为什么要进行GMP 审计?
-
欧美审计类型和触发点
Part2
如何做好GMP审计准备
-
自检&自检难点和关键点
-
第三方审计的关注点
-
审计前准备的重点
-
EU和FDA审计的区别和特点
-
欧美检查互认协议的影响和对策
Part3
官方审计关键点-实际案例
-
质量系统
-
实验室控制
-
设备设施
-
包装和标签
-
物料
-
生产
-
人员不合规行为的根本原因剖析
Part4
审计的缺陷及应对技巧
Part5
现场模拟演练
2019/4/27
(周六)李老师
主题:基于案例分析和实践的药品GMP质量审计能力提升
Part1
审计趋势和触发点概述
Part2
常规审计-药品GMP合规性
-
案例1:产品工艺验证
-
案例讨论
-
能力延伸和提升1:产品工艺审计清单的制定和使用
-
能力延伸和提升2:法规指南解读和实施
Part3
有因审计-风险信号发启
-
大容量注射剂灭菌器使用日志提示的风险信号
-
案例讨论
Part4
药品全生命周期管理与核查
Part5
药品飞行检查案例分享
2800元/人
(含议期间中餐费、讲义费、证书费、增值服务资料费)
培训期间晚餐及住宿可由会务组统一安排,费用自理
1.同一集团或公司
5名(包括5名
)以上报名可享
8折
优惠,鼓励各集团公司、子公司统一报名享受优惠政策













