
投资要点
康方生物坚守自主创新,ACE平台和TETRABODY自有技术价值凸显,创新研发能力得到不断论证,在研管线丰富且2021年进入兑现期。
平台价值凸显,研发实力不断论证
。公司通过自建以端对端全方位药物开发ACE平台及独特的TETRABODY双特异性抗体研发技术,赋能in-house研发,对外部依赖极低。早在2015年,公司就将自主研发的CTLA-4单抗以总对价2亿美金授权给Merck,成为中国首个向全球制药龙头对外授权的biotech。目前,公司已建立含超过20个创新抗体药物的强大在研管线,包含PD-1/CTLA-4双抗(AK104)、PD-1/VEGF(AK112)双抗等6个双抗产品,以及PD-1单抗(AK105)、潜在的下一个泛癌种产品CD47单抗(AK117)和有望成为PD-1类药物好伴侣的CD73单抗(AK119)等新靶点药物,治疗领域覆盖肿瘤、自身免疫、炎症、代谢疾病等重大疾病领域,研发实力得以不断论证。
产品进入兑现期,商业化成果可期。
2021年将是公司商业化元年,有望凭借PD-1单抗的上市,不断打开在肿瘤免疫领域的布局。公司PD-1单抗的R/R cHL适应症,已于2020年5月在CDE受理,有望通过与中国生物制药的合作助力商业化和大适应症开发
,
预计2021-2022年将申报一线鳞/非鳞NSCLC、一线肝癌和二线胃癌的大适应症NDA。PD-1/CTLA-4双抗预计在2021H2提交NDA/BLA,
该药物的宫颈癌适应症已获美国快速通道认证和孤儿药资格认定、在中国纳入突破性疗法,有望成为全球首个获批实体瘤的双抗,划时代意义重大,胃癌、肝癌和NSCLC等大适应症一线疗法也在二期进展中。公司第二个进入临床的双抗产品PD-1/VEGF二期进展顺利,在多个瘤种中表现出抗肿瘤活性;此外,公司在自免领域的IL-12/23单抗和代谢领域的PCSK9单抗
,皆有望在2022/23年NDA,
未来商业化成果可期。
催化剂:
AK105获批上市,AK104提交注册申请,AK112和AK117等在研管线产品有效性数据公布。
风险提示:
商业化不及预期的风险,新药研发进度不及预期的风险。

公司致力于自主发现、开发及商业化全球病人可负担的下一代创新治疗抗体,“同类首创(First in class)”和“同类最佳(Best in class)”是公司产品的主要推动力,成为全球领先的biopharma是公司的终极目标。
在中国创新药崛起的浪潮中,康方生物具备其自身独特优势:
ACE平台涵盖新药靶
点验证、抗体发现与开发、CMC生产工艺开发和符合GMP标准的规模化生产,使药物在早期研发阶段已具备CMC开发能力,大幅提高新药研发成功率和后期推进速度。
自建双特异性抗体开发TERRABODY技术:为我国双抗研发龙头
公司凭借TERRABODY技术,实现了双抗药物在CMC和临床应用的突破,截止2020年12月31日,公司在研管线共6个双特异性抗体药物,其中,国际首创的双抗新药AK104(PD-1/CTLA-4)和AK112(PD-1/VEGF)已进入临床,双抗药物进展位居我国第一。
截止2020年12月31日,公司已建立超过20个创新抗体药物的强大在研管线,在高效的临床执行力下,已有13个候选药物在全球启动超40个临床项目,治疗领域覆盖肿瘤、自身免疫、炎症、代谢疾病等重大疾病领域。
公司产品进入兑现期,预计2021年或迎关键发展里程碑:
AK105(PD-1)预计2021H1获得上市批件
,
有望借助于中国生物制药的商业化合作快速放量,同时后续肺癌、肝癌、胃癌等大适应症也在关键性临床阶段;
AK104(PD-1/CTLA-4)预计在2021年提交2L/3L宫颈癌适应症上市申请,
有望成为全球首个在实体瘤获批适应症的双特异性抗体
,同时后续胃癌、肺癌、肝癌、食管鳞癌等大适应症临床在二期阶段;
AK117(CD47单抗)的临床数据预计将有更新,若安全性较好,则具备提升剂量显现有效性的基础,有望成为下一个“PD-1”;
商业化团队组建
加速,
预计2021年将建成一支300-500人的自有销售团队
。
1.
1
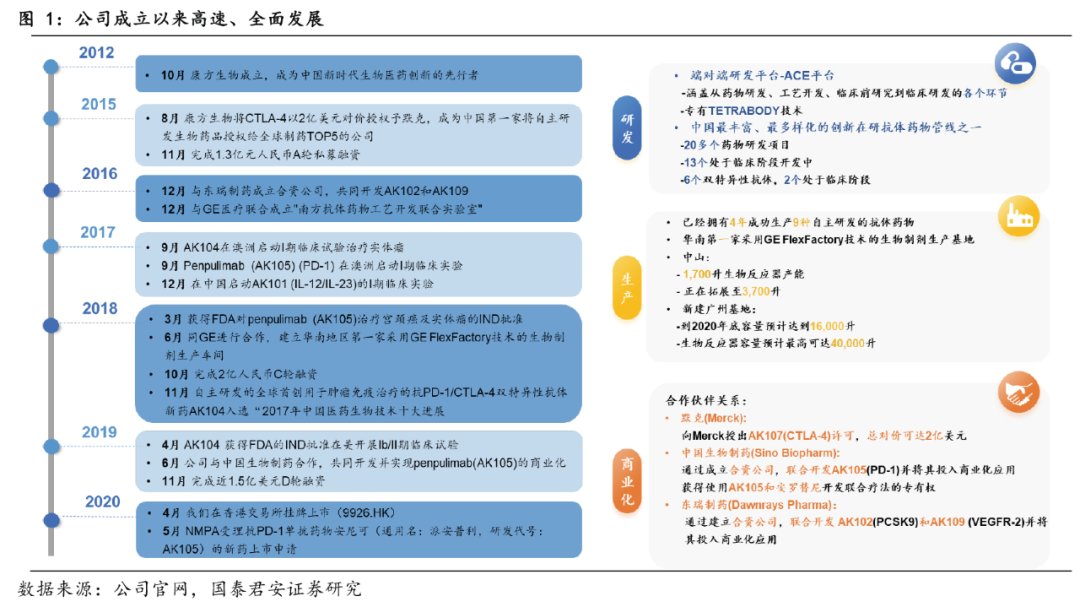
从研发到商业化,全面发展
康方生物于2012年3月在中山注册成立,于2020年4月在香港交易所挂牌上市。自成立以来,公司在自主研发、生产和商业化三方面高速发展。研发上,公司凭借自建的全方位药物开发平台(ACE平台)和双抗开发TERRABODY技术赋能新药研发,在研管线超20个自主研发的新分子候选药物;生产及产能建设上,公司遵从CMC及GMP标准打造生产工艺,成为华南第一家采用GE FlexFactory技术的生物制药生产基地;商业化上,公司通过合作化、国际化发展策略,与Merck、中国生物制药、东瑞制药等强大伙伴达成合作。
公司极具中国新生代biopharma潜力,有望在肿瘤、自身免疫及其他治疗领域上,实现本土乃至全球的领先地位。
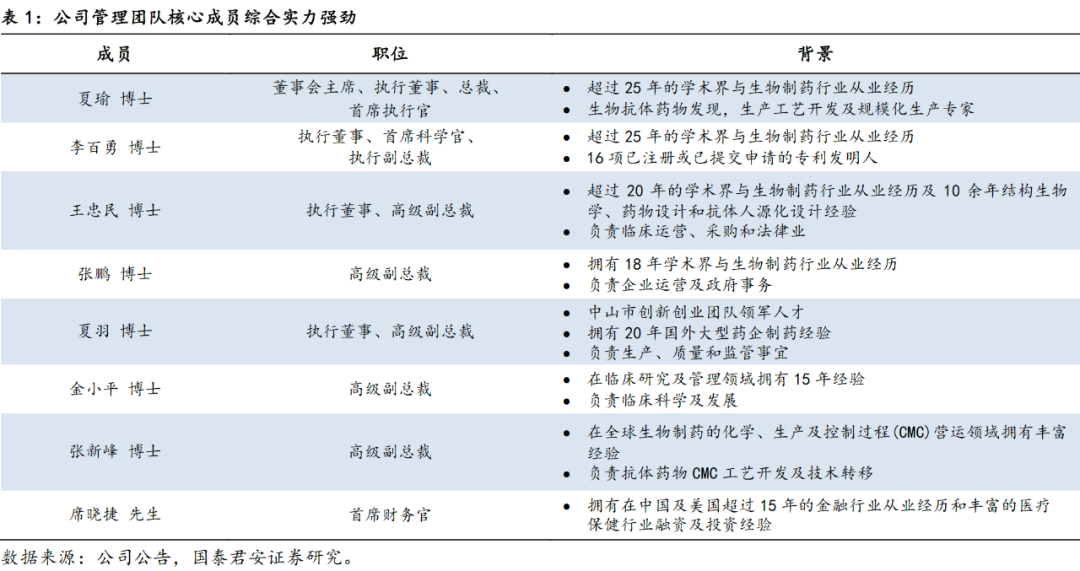
1.2 股权结构清晰,管理层实力强劲
公司主要创始人夏瑜博士拥有20多年学术界和生物制药工业界的从业经历,是生物抗体药物发现,生产工艺开发及规模化生产专家,曾在多个跨国药企供职,负责或参与了众多新药研发、生产和申报工作。公司股权结构清晰,核心管理团队研发实力雄厚,深厚背景加成的管理团队为公司进一步深耕新药研发、稳步推进国际化合作保驾护航。
1.3 紧抓创新赛道,研发投入持续注入
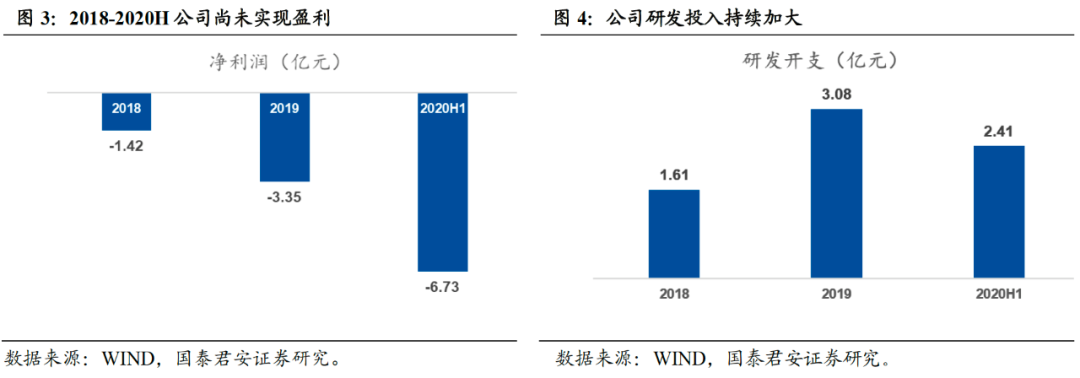
由于公司截至目前未有产品获批上市,因此未有因产品商业销售产生收入。目前收入主要来自于许可收入,包括对外授权产品(AK107、AK103、AK106在内)相关的预付款和里程碑付款。截止2020年中报,公司目前未实现盈利。
公司作为致力于新药研发的创新型制药企业,新药研发力度不断加大,研发开展呈快速增长态势。2020年上半年,公司研发投入2.41亿元,同比增长95.35%。随着公司在研管线的持续拓展和推进以及研发团队的进一步扩大,我们预计公司研发投入将保持高增长趋势。
2. 自建创新性一体化平台,研发能力不断验证
2.1 自建一体化ACE平台,赋能in-house研发生产实力
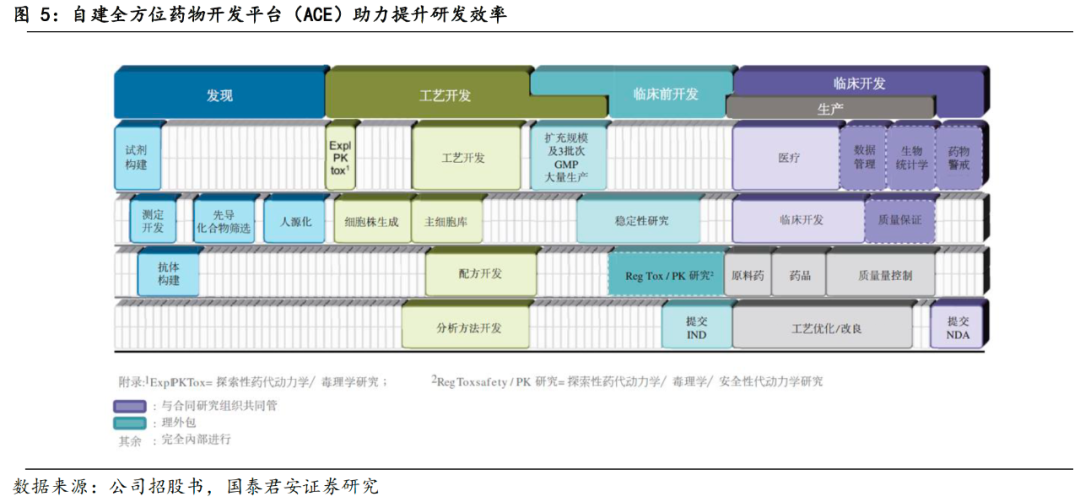
对于Biotech公司,自建平台的能力对公司能否持续性的拓展管线、研发新药至关重要。2012年4月,康方生物开创了以端对端全方位药物开发平台(ACE平台)及独特的TETRABODY双特异性抗体研发技术,以ACE平台和TETRABODY技术为核心,搭建了强大的一体化内部创新体系,全方位涵盖药物研发过程,包括药物发现、工艺开发、临床前和临床开发、CMC和GMP合规生产。
ACE平台有助于提升研发效率。
得益于ACE平台对药物研发从靶点验证到GMP生产的一体化覆盖,公司的药物发现团队会在新药发现阶段即引入CMC标准评估药物的商业可行性,在研发早期即解决CMC工艺问题,降低候选药物在后研发周期失败的风险,大幅提升研发效率,降低成本。
向Merck授权自研CTLA-4单抗,验证ACE平台创新实力。
2015年11月,公司将自主研发的CTLA-4单抗(Quavonlimab,AK107)授权给Merck(研发代码MK-1308),成为中国首个向全球领先制药公司对外授权自研看到的Biotech。根据该协议,公司将收到高达2亿美金的总对价(含预付款及未来的里程碑付款),Merck获得Quavonlimab的全球独家开发和销售权。随着2017年7月Merck在美国启动MK-1308的一期临床,截止2019年12月31日,公司已收到Merck预付款及里程碑付费共20百万美元。
目前,ACE平台的能力得到不断验证,公司研发创新对外部的依赖极低。现已打造超过20个创新抗体药物的强大在研管线,覆盖肿瘤、自身免疫、炎症、代谢疾病等重大疾病领域。
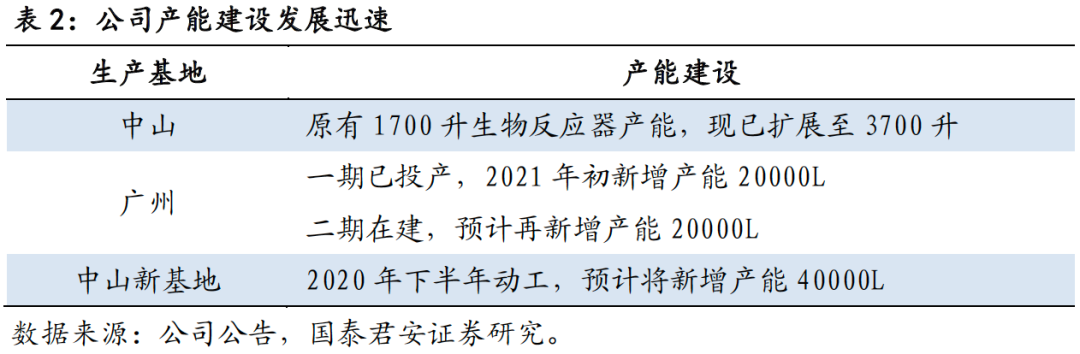
ACE平台还具有符合NMPA、FDA和EMA监管的国际GMP标准的内部生产能力。公司于2016年建立了华南地区第一家采用具有中央控制系统的GE FlexFactory技术的生物制药生产设置,使公司具备快速扩大生产规模或在各候选药物切换生产的能力。公司现有的中山生产基地,已具备GMP合规产能3700L,为满足不断增加的产能需求,新基地的产能也在积极加大建设。公司位于广州的生产基地一期设备已于2021年初投入运营,新增产能达20000L,二期工程规划2021Q2启动建
设,预计再新增20000L产能;同时公司中山市湾区科技园生产基地已于2020年下半年动工,预计该基地将为公司再添40000L的产能。
2.2 双抗领导者,Tetrabody技术解决CMC难题
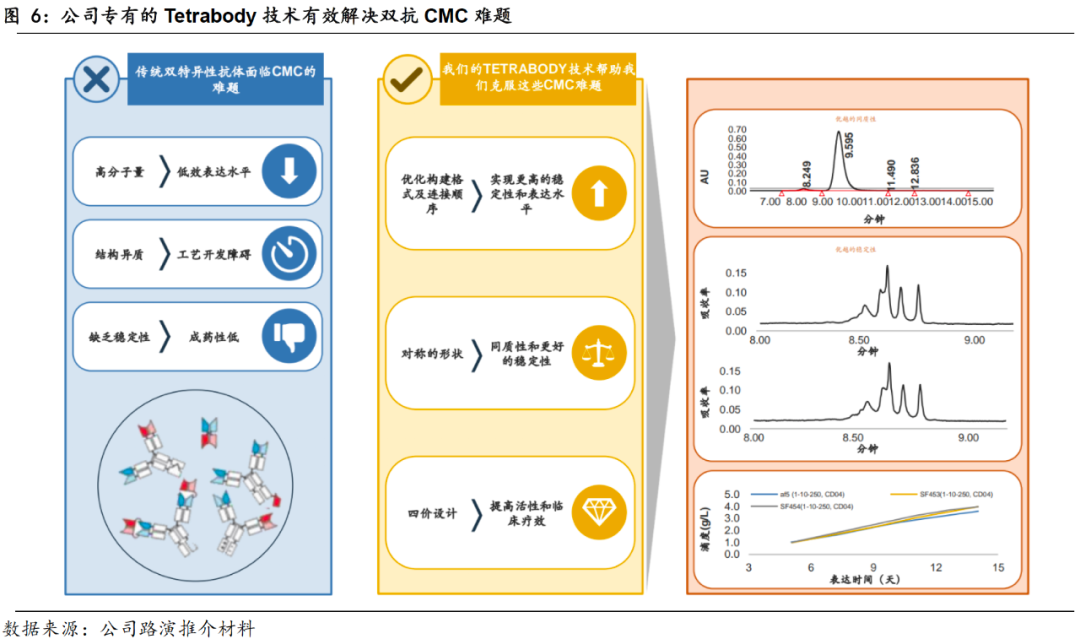
双特异性抗体技术(简称“双抗”)作为下一代抗体技术,其研发初衷是通过单一药品达到联合治疗的效果,以减少患者的用药数目、降低药企的研发周期和经费。理想的双抗甚至还可达到单抗联合用药所无法产生的功效,实现“1+1>2”的效果。然而,自1960年双抗概念被首次提出以来,截止2020年12月,全球仅有3款双抗获批上市(其中1款已于2017年退市),阻碍双抗研发的难点,主要因为双抗需在构建时,需将能结合两种抗原的抗体结构融合在单一抗体结构之中,这对实验室构建和CMC生产提出很大挑战,只有将均一、稳定的目标产物运用于临床,才能够保证人体用药的安全性和有效性。随着诸如KIH、CrossMab、scFv等抗体构建技术的发展,各式各样具备不同功能的双抗结构被成功构建,而CMC工艺仍是双抗研发关键阻碍,其难点集中在三处:①双抗的高分子量导致的低表达水平;②双抗的结构异质引起的工艺开发障碍;③双抗缺乏稳定性导致的药物副作用。
公司自主创新的TETRABODY技术成功解决双抗CMC难题。
公司于2012年4月开创了ACE平台并开发了拥有自主知识产权的TETRABODY双抗技术。针对双抗CMC的三大难题,TETRABODY技术均作了较好解决:①双抗低表达水平的难题:通过优化构建格式及连接顺序来克服;②抗体结构引起的工艺开发难题:通过运用对称性结构本身具有的均质性来克服;③双抗产物稳定性低的难题:通过独特的四价结构设计来克服。
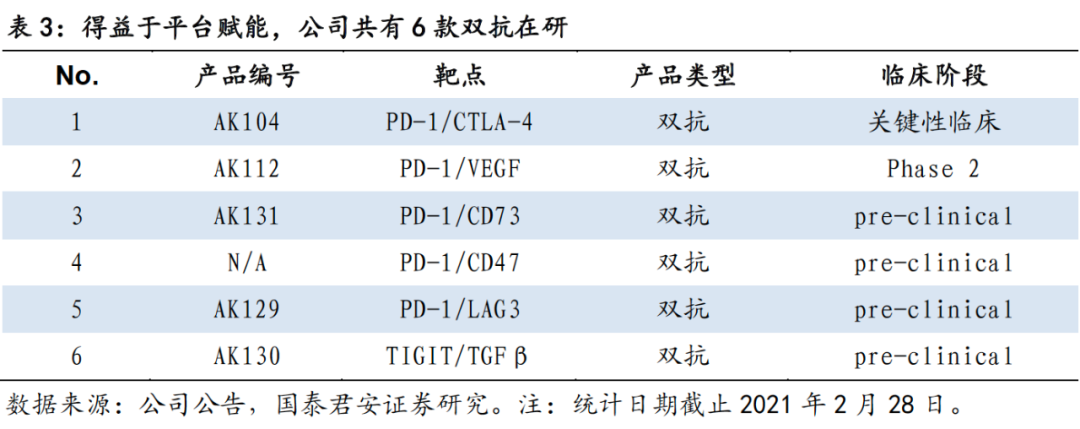
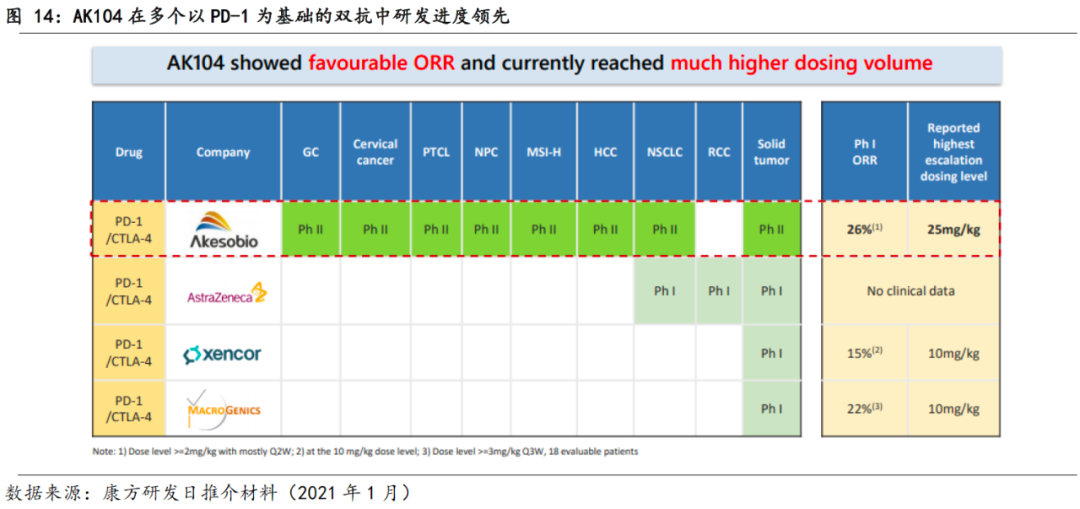
在研六个双抗药物,双抗管线进展位居我国第一。
基于独有的TETRABODY技术和内部CMC能力,公司已在双抗领域布局丰沛和领先的研发管线。截止2020年12月31日,公司在研管线中双抗药物共6个,包括PD-1/CTLA-4双抗、PD-1/VEGF双抗、PD-1/CD73双抗、PD-1/CD47双抗、PD-1/LAG3双抗和TIGIT/TGFβ双抗。其中,国际首创的双抗新药AK104(PD-1/CTLA-4)和AK112(PD-1/VEGF)已进入临床,双抗药物进展位居我国第一。
3. 产品管线丰富,步入收获期
公司在研管线丰富,临床进度快速推进。
截止2020年12月31日,公司已建立超过20个创新抗体药物的强大在研管线,包括6个双特异性抗体药物,其中,国际首创的双抗新药AK104(PD-1/CTLA-4)和AK112(PD-1/VEGF)已进入临床;在公司高效的临床执行力下,超20个在研产品中,已有13个候选药物在全球启动超40个临床项目,治疗领域覆盖肿瘤、自身免疫、炎症、代谢疾病等重大疾病领域。
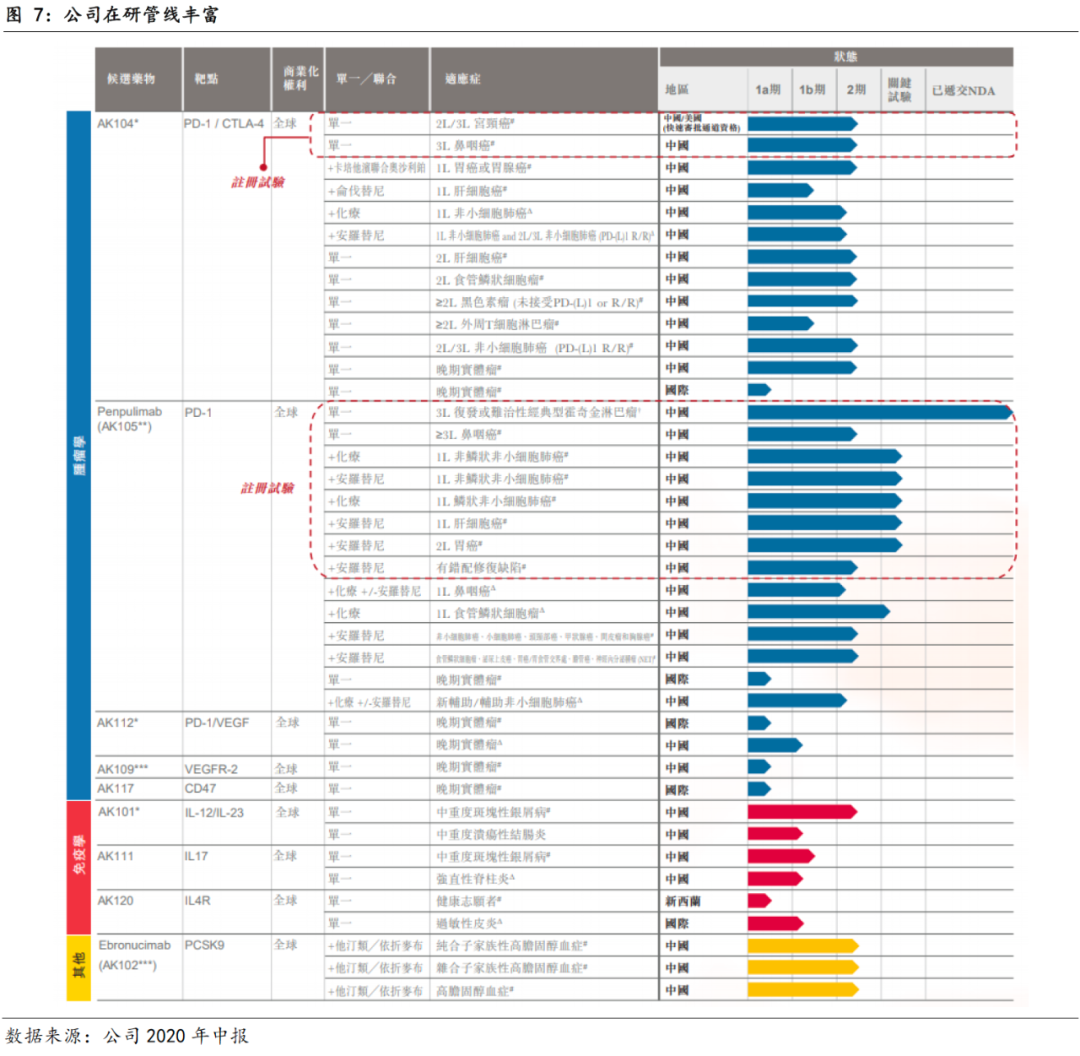
3.1 双抗技术领先,六款在研双抗已有两款进入临床
3.1.1 AK104(PD-1/CTLA-4):有望为全球首个获批实体瘤的双抗
AK104是公司基于TETRABODY技术自研的PD-1/CTLA-4双特异性抗体,可在肿瘤微环境中同时识别结合PD-1和CTLA-4,阻断肿瘤的免疫逃逸机制和T细胞活性的负向调控机制。不同于联合疗法,AK104有望通过双抗设计克服CTLA-4靶点的剂量限制性毒性,实现高效且低毒。目前其2L/3L宫颈癌适应症,已在中美同时进行单臂注册性临床
,
预计2021H2提交NDA/BLA申请
。
AK104意义特别,有望成为全球首个获批实体瘤适
应症的双抗,其2L/3L宫颈癌适应症已在美国获得fast track认证和孤儿药资格认定、在中国纳入突破性疗法。
AK104药物性能的优势集中在以下四点
:①通过设计,令PD-1及CTLA-4在肿瘤微环境的亲和力高于在外周位点;②毒性可能低于PD-1与CTLA-4的联合疗法;③在之前接受过大量治疗无效的癌症患者的试验中观察到强大疗
效;④临床进展快速且有序,
预计宫颈癌适应症2021下半年在中国申报
,并积极拓展多
项大适应症。
3.1.1.1 突破CTLA-4单抗的毒性瓶颈,兼顾高效和低毒
➢AK104的研发背景:PD-1/CTLA-4双靶点联合已被验证有效性,但副作用较大
PD-1热潮打开免疫治疗时代。
2014年Opdivo和Keytruda陆续上市,随着适应症的不断开拓,以PD-1为首的免疫治疗时代拉开帷幕
,据弗若斯特沙利文数据,全球PD-(L)1治疗市场已由2014年的0.8亿美元增至2018年的163亿美元,CAGR达283.5%,预计未来2027年将达到峰值798亿美元。PD-1在治疗和
商业上的成功离不开两点:①治疗机制的新颖,其采用人体自身免疫系统对肿瘤进行识别和杀伤,即通过阻断PD-1/PD-L1信号通路的免疫逃逸,达到“松刹车”效果,②多瘤种适应症的拓展,凭借着PD-L1蛋白在多个肿瘤表达,PD-1类药物在多个适应症上展现疗效并获批,以K药为例,在FDA共获批20个瘤种的适应症,助力其实现2020年全球144亿美元的销售规模。
PD-1单药的低响应率使其较为依赖联合疗法。
虽然对PD-1响应的患者往往可达到较好的缓解率和持续较长的缓解时间,但PD-1药物的低响应率是其重要缺点之一,研究显示,在多数实体瘤中,PD-1响应率在10%-30%之间。因此,以PD-(L)1单抗为基石的联合疗法是其临床开发的主要方向。
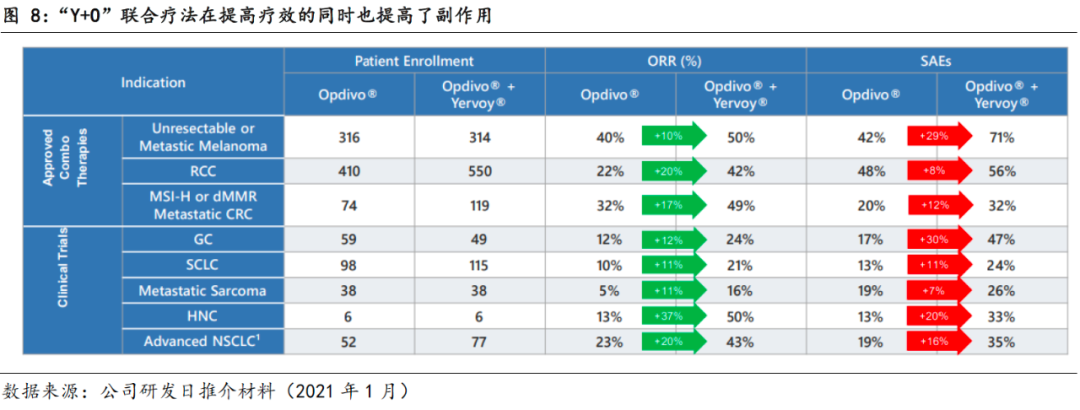
PD-1与CTLA-4的联合疗法,具备优于PD-1单药的抗肿瘤活性的同时,也产生更大的副作用。
已有临床数据证明,相比于PD-1单药,PD-1和CTLA-4的联合疗法可提高某些难治性癌症的治疗效果,截止2020年1月8日,Opdivo+Yervoy联合疗法已在黑色素瘤、非小细胞肺癌、恶性胸膜间皮瘤、肾癌、结直肠癌、肝癌适应症上获得FDA的批准。然而,Opdivo+Yervoy联合疗法在提高疗效的同时,也大幅增加了副作用发生率,因此,PD-1和CTLA-4两个靶点在已确认其有效性之后,如何减少毒性以拓展临床应用成为新药研发议题。
CTLA-4靶点自身存在剂量相关毒性。
PD-1的作用机制已为人所熟知,即松开了免疫系统的“刹车”,释放了T细胞攻击肿瘤的活性。值得注意的是,免疫系统的刹车并非只有PD-1信号通路,CTLA-4就是另一个重要的“松刹车”免疫检查点,它对T细胞的免疫反应起负向调控作用。然而,在研究早期就发现,CTLA-4抗体存在剂量相关毒性的问题,这也是目前限制其更广泛应用的主要原因。免疫相关副反应(immune-related adverse events, irAEs)是伴随CTLA-4研发的主要问题,甚至患者治疗后出现irAEs曾被研究者认为是治疗响应的先行替代指标。一项试验结果显示,伊匹单抗治疗组中,出现grade ≥3级irAEs的患者有36%的响应率,而未有irAEs的患者响应率仅5%。目前针对CTLA-4靶点的药物,仅有2011年在FDA获批的伊匹单抗(ipilimumab, Yervoy),其疗效与副作用皆与剂量呈正相关,如何实现在利用其有效抗肿瘤效果的同时,兼顾低毒性,成为研究重点。
注:针对伊匹单抗的剂量相关性毒性,BMS曾开展头对头研究,并将结果发表于2017的Lancet杂志。该三期临床招募了831例不可切除或转移性的黑素瘤患者,试验分为伊匹单抗3mg/kg every 3 weeks给药组和伊匹单抗10mg/kg every 3 weeks给药组,结果显示,10mg/kg对比3mg/kg中位OS延长了4.2个月(15.7mo vs 11.5mo),但治疗相关SAE发生率也大幅增加(37% vs 18%)。
➢
AK104的优势:有望通过双抗结构实现PD-1/CTLA-4的高响应和低毒性
此前的PD-1单抗和CTLA-4的联合疗法中所存在的剂量相关性毒性,可能与抗体对肿瘤微环境和外周血环境中的淋巴细胞无差别的结合亲和力所致。公司通过设计AK104双抗,以期利用单个药物同时靶向PD-1和CTLA-4的特性,实现肿瘤微环境的高亲和以及外周血环境的低亲和,突破PD-1和CTLA-4联合疗法的瓶颈。
AK104是基于公司特有的TETRABODY技术,设计出的人源四价双头结构的PD-1/CTLA-4双特异性抗体。由于PD-1和CTLA-4主要在肿瘤浸润淋巴细胞中共同表达,而不在正常外周组织淋巴细胞中表达,因此AK104的靶点和结构设计,使其对肿瘤微环境中淋巴细胞的亲和力较高、对外周组织淋巴细胞的亲和力较低,以实现在肿瘤部位保持功效,同时减轻肿瘤外的毒性。基于以上机制,
AK104在实体瘤中可能具有兼顾高响应和低毒性的潜力,同时AK104也大概率是首个获批实体瘤适应症的双抗。

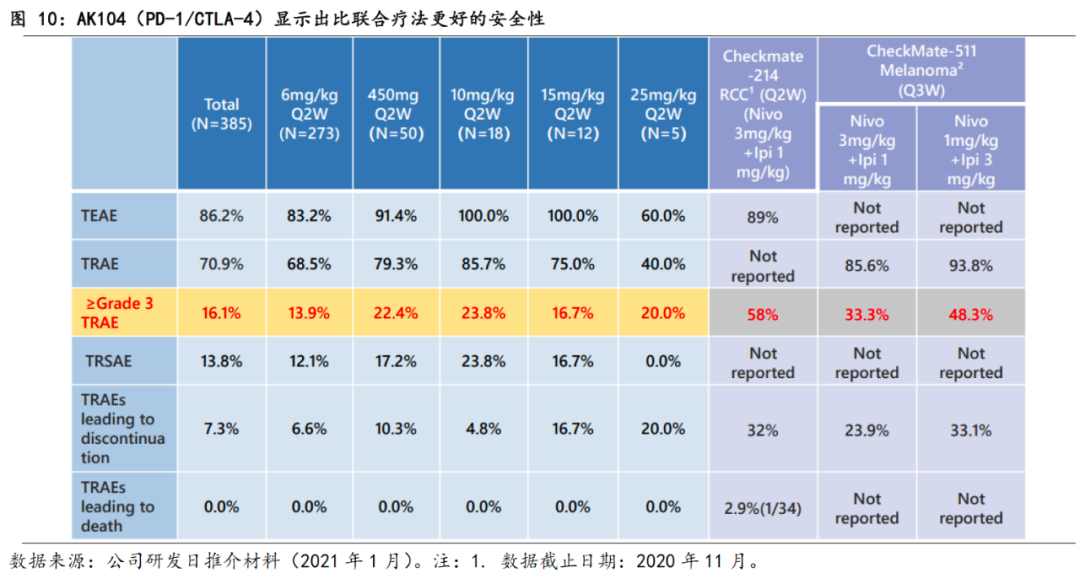
安全性是AK104的最大优势,也是提高剂量的基础。
AK104表现出比现有联合疗法更佳的安全性,目前剂量已提高至25mg/kg,有望在高剂量下,充分展现PD-1和CTLA-4两个靶点的疗效。据公司在2020年11月截止的数据,AK104在所有剂量组(N=385)中,≥3级的治疗相关不良事件发生率为16.1%,远低于联合疗法的CheckMate-214/551中33%~58%的水平。综合目前临床结果,
AK104在各剂量皆显示出较好安全性和耐受性,其≥3级的治疗相关不良事件发生率近乎为PD-1和CTLA-4的联合疗法的1/3
,较联合疗法安全性提高。
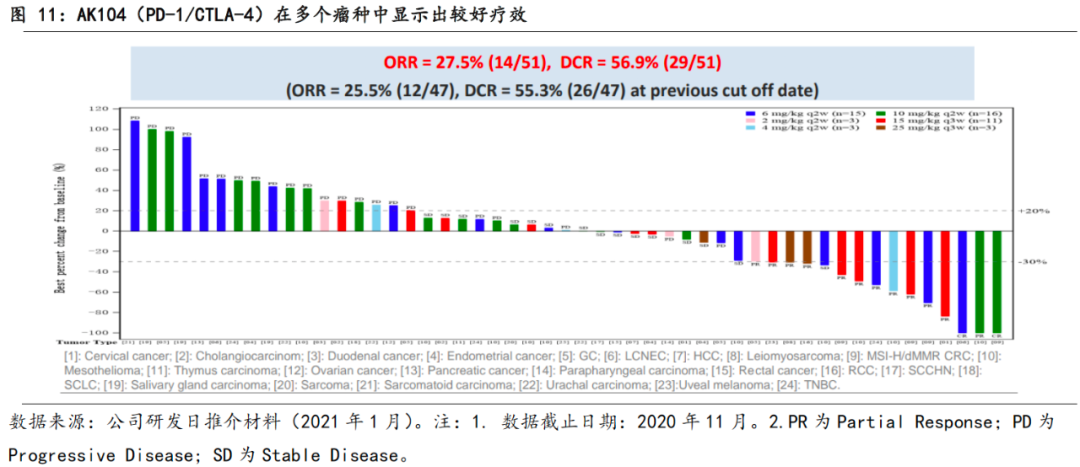
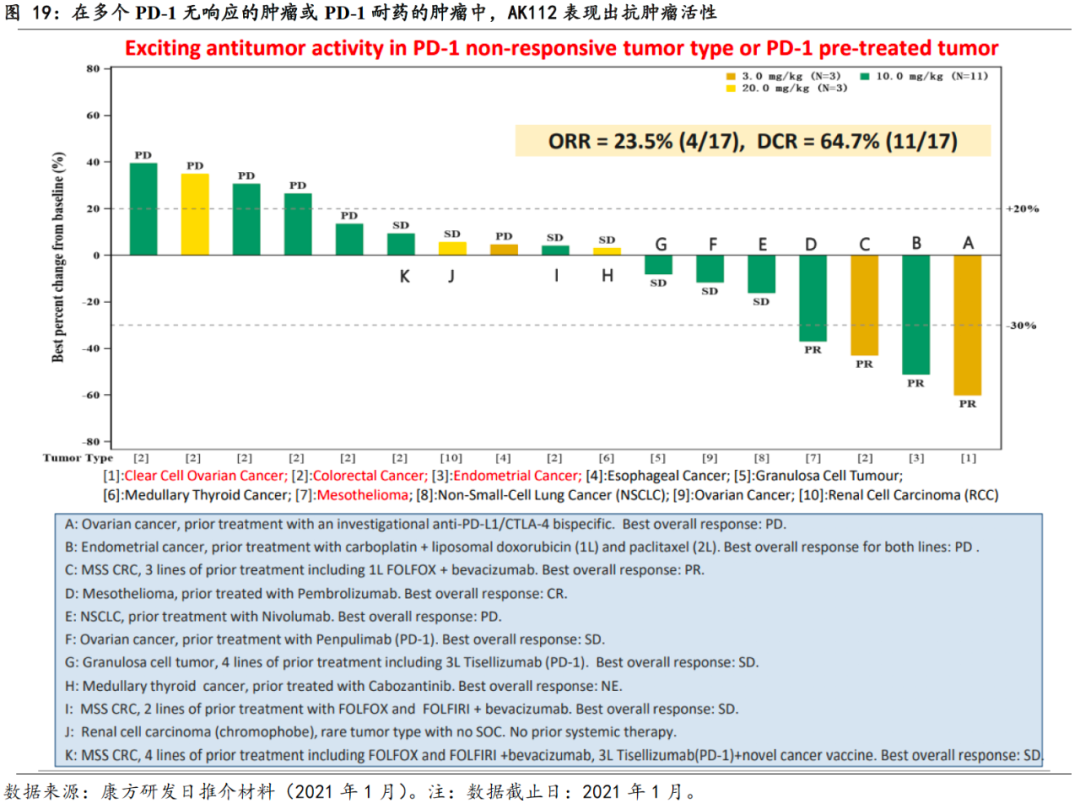
AK104在多个癌种中显示出疗效。
据公司在2020年11月截止的数据,AK104目前在澳洲开展的Phase 1a期试验中,入组的51位患者在多个癌种中整体实现ORR 27.5%、DCR 56.9%的较好疗效。
3.1.1.2 2L/3L宫颈癌2022E获批,多项大适应症快速跟上
AK104在中国于2018年6月获得IND批件、2019年1月开始Phase 1b/2临床,在美国于2019年3月获得IND批件,目前临床开展迅速,是全球首个进入二期临床的PD-1/CTLA-4双特异抗体,基于其在肿瘤微环境亲和力高、外周环境亲和力低的特性,目前AK104开发的适应症皆为实体瘤,且已有两项单臂注册性临床开展,分别为在中美同时进行的2L/3L宫颈癌试验和在中国进行的3L鼻咽癌试验,宫颈癌作为进展最
快的适应症,
有望在2021H2提交NDA/BLA申请,预计于2022年获批上市。
临床开发思路清晰,小适应症快速上市,大适应症和联合疗法积极拓展。AK104具体临床计划如下:
① 以未满足临床需求加快上市:
2L/3L宫颈癌适应症,已在中国和美国同时进行单臂注册性临床,并在2020年8月美国获得fast track认证、2020年10月在中国纳入突破性疗法;≥3L鼻咽癌适应症,正在中国进行单臂注册性临床;
②拓展大适应症一线疗法:
AK104已在一线胃癌(与化疗联合,Phase 1b/2)、一线肝癌(与仑伐替尼联合,Phase 1b/2)、一线非小细胞肺癌(与化疗或安罗替尼联合,Phase 2)等大适应症开展临床;此外,公司还计划将AK104作为联合疗法的骨干药物,未来将于与自身其他产品如AK109(VEGFR-2)、AK119(CD73)、AK114(IL-1 beta)开展临床;
③针对PD-(L)1药物耐药:
针对R/R及anti-PD-1/L1非小细胞肺癌,正在开展与安罗替尼联合的Phase 2,以及单药治疗的Phase 2;针对R/R及anti-PD-1/L1胰腺癌,计划开展与AK119(CD73)联合用药的Phase 1;
④全球计划:
美国针对2L/3L宫颈癌正在加速上市,同时AK104与血管生成抑制剂的联合疗法正在开辟大适应症,此外,AK104也在积极探索全球性的合作机会。

➢
宫颈癌:进展最快,预计于2021下半年中美申报NDA
2L/3L宫颈癌是目前AK104临床进展最快的适应症,改疗法收到中美多个资质认定:于2020年8月获得美国快速审批通道资格(fast track)、2020年10月获得中国突破性疗法认证,此外,2021年2月,AK104获得FDA授予的孤儿药资格认定,用于治疗宫颈癌(除极早期IA1期之外)。
目前AK104在中美皆已进入2L/3L宫颈癌的单臂关键性二
期注册临床,
预计2021下半年在中国、美国和澳洲申报NDA
。截止公司2020年7月的cut
-off数据,AK104宫颈癌适应症共有31个患者入组,在21个可供分析的患者数据中,ORR为47.6%,DCR为66.7%,相比于PD-1和CTLA-4的联合疗法或PD-1单药疗法,有效性数据皆有较大提高,临床效果较为振奋。

3.1.1.3 同靶点双抗中进度最快,有望尽显先发优势
AK104作为双抗,其突出特点是安全性好,在联合CTLA-4靶点特性后,可能展现出比PD-1单药或联合治疗更好的疗效。基于此,AK104的市场主要针对两类人群:
1)PD-(L)1单药应答人群:这部分人群对PD-(L)1单药具有应答,AK104预计能展现出比PD-(L)1单药更好的疗效;此外,还有使用PD-(L)1单药后耐药的人群,有已发表研究表明,晚期黑色素瘤患者经PD-1单一疗法而病情有进展后,使用PD-1(纳武单抗)与CTLA-4(伊匹单抗)单抗联合疗法,得出的总缓解率为21.2%(33名患者中的7名),疾病控制率为33.3%(33名患者中的11名)及一年OS为55%。
2)PD-(L)1联合用药应答人群:这部分患者对PD-1单药应答有限,但是对于联合疗法具有响应,因此AK104预计在对PD-1单药应答差的患者中可以展现出疗效。已有临床试验表明,对于胃癌、小细胞肺癌及肉瘤等癌种,采用纳武单抗及伊匹单抗的联合疗法有应答,这也给在肿瘤微环境更富集的AK104的疗效提供了可能。
基于此,我们认为AK104的竞争对手主要是PD-1产品和同靶点双抗产品。就PD-1而言,如前文所述,国内已形成4+4的竞争格局;就同靶点双抗而言,目前全球尚无获批的PD-1/CTLA-4双抗,全球在研PD-(L)1/CTLA-4双抗包括康方的AK104、阿斯利康的MEDI-5752、Xencor的XmAb-20717、MacroGenics的MGD-019,
在这些产品中,公司AK104是首个进入一期及二期临床试验的药物,且目前的一期ORR最高、达到的剂量水平也最高。我们预计,AK104有望凭借着快速上市和后续各项适应症临床的全面开展,快速拔得头筹兑现商业化成果。
3.1.2 AK112 (PD-1/VEGF):全球首个进入临床的同靶点双抗
AK112是公司基于TETRABODY技术自研的PD-1/VEGF双特异性抗体,可作为单一药物同时识别结合免疫抑制分子PD-1和血管内皮生长因子VEGF,从而抑制肿瘤细胞的免疫逃逸和肿瘤血管生成,具备比联合疗法更高安全性和活性的潜质。
目前全球尚无获批的PD-(L)1/VEGF双抗,AK112是全球首个进入临床阶段的PD-1/VEGF双抗,也是公司继AK104后第二款全球首创并进入临床阶段的双抗。目前,AK112正在中、美、澳同时开展临床,其单药或与联合疗法正在多个实体瘤中开展临床。
3.1.2.1 PD-1和VEGF在肿瘤微环境共表达,双抗具备安全性优势
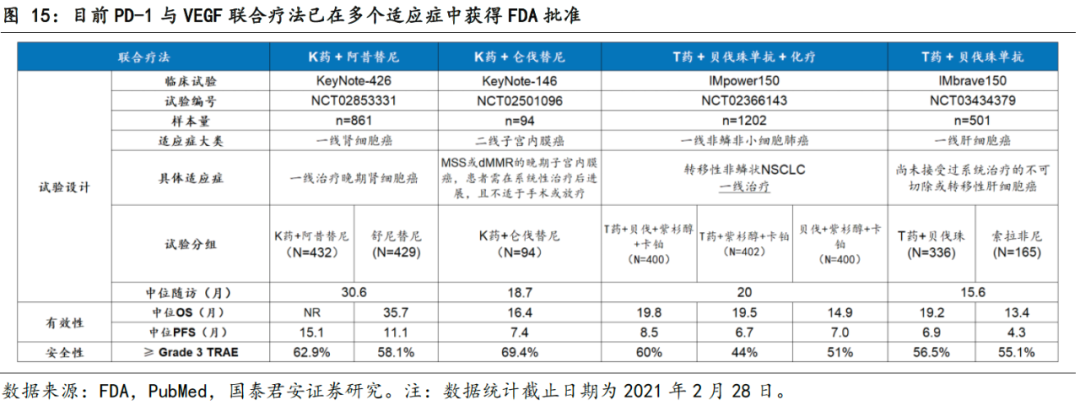
PD-1和VEGF联合疗法在多个适应症表现出抗肿瘤活性。
目前已有PD-(L)1单抗和VEGF靶向药的联合疗法在多个癌症中获批,如NSCLC、肾细胞癌、子宫内膜癌以及肝癌。尤其值得注意的是,在PD-1单药较难突破的一线肝细胞癌中,IMbrave150试验显示,Tecentriq (PD-L1单抗)与Avastin (VEGFR抑制剂)的联合疗法(T+A方案),中位OS达到19.2个月,相比于对照组索拉非尼的13.4个月有明显提高,而中国亚群患者的中位OS突破24个月。由此,PD-1和VEGF的联合用药再度在癌症治疗上证实更佳疗效。
PD-1和VEGF在抗肿瘤中相辅相成。
研究表明,PD-(L)1单抗和VEGF靶向药的联合疗法之所以能有较高抗肿瘤活性,不单单是因两者抗肿瘤作用机制的叠加,由于VEGF还会在肿瘤微环境对肿瘤免疫起负向调控作用,VEGF抑制剂在阻断VEGF介导的免疫抑制的同时,还可以放大免疫检查点抑制剂的免疫应答活性,将肿瘤内的微环境从免疫抑制调整为免疫激活。总而言之,消除VEGF后可以产生更强的抗肿瘤免疫活性,并与PD-1抗体的疗效相辅相成。
双抗设计更具安全优势,其有效性的的科学基础,源于PD-1和VEGF的在肿瘤微环境中的共表达。
研究表明,肿瘤组织内的VEGF表达与肿瘤浸润的CD8+细胞上的PD-1表达相关,鉴于VEGF和PD-1在肿瘤微环境中的共表达,AK112能够富集于肿瘤微环境,在降低对正常组织毒副作用的同时,更有效地阻断相互独立又彼此互补的PD-1通路和VEGF通路,促进免疫系统对肿瘤的杀伤,并具备比联合疗法更佳安全性的潜在优势。

3.1.2.2 二期临床进展顺利,多项临床快速开展
公司为AK112制定了全球性的临床开发计划,目前正在中美澳三地开展临床。AK112于2019年6月获得美国IND批件、2019年8月获得澳洲IND批件、2020年8月获得中国IND批件,并在澳洲率先启动了对于晚期实体瘤的1期临床,2019年10月完成了首例患者入组。目前AK112开发的适应症皆为实体瘤。在联合用药方面,公司也在积极探索与其他药物的联合使用,如联合PARP抑制剂、化疗等,以开拓更广阔的应用场景。
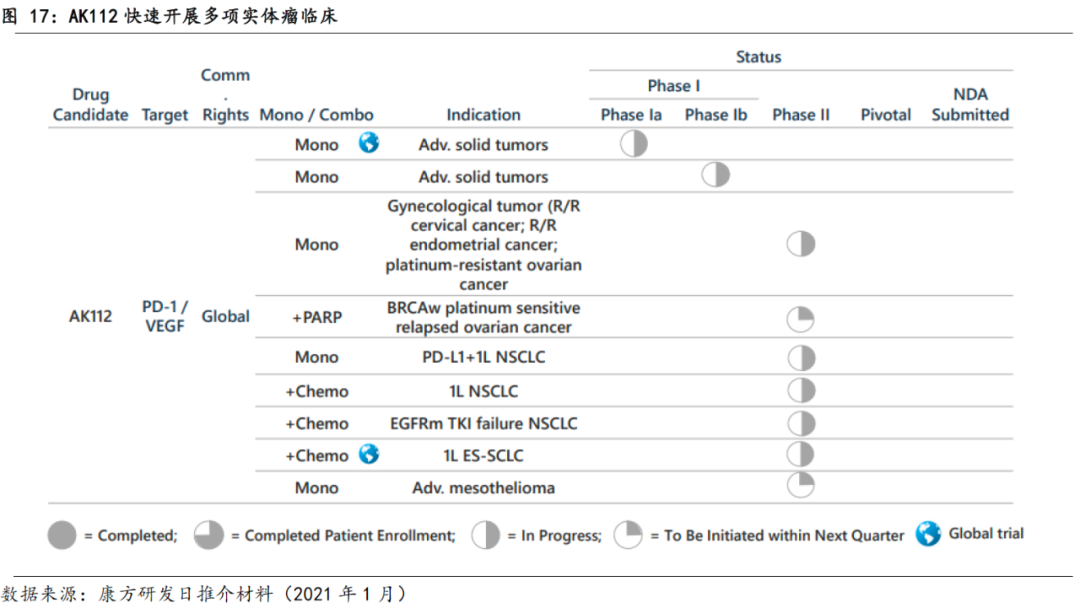
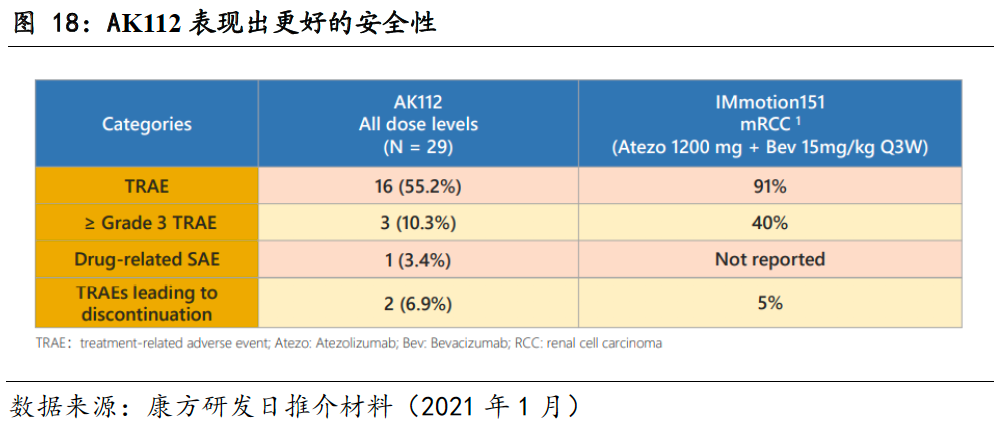
AK112表现出较好的安全性。
截止2021年1月13日,共有29例患者分别入组以下6个cohort:0.3mg/kg(n=1), 1mg/kg(n=3), 3mg/kg(n=3), 10mg/kg(n=13), 20mg/kg Q2W (n=8), 30mg/kg Q2W (n=1),在目前入组的29个患者中,未有剂量限制性毒性发生,3级及以上的治疗先关不良事件发生率为10.3%,低于IMmotion151试验中阿替利珠单抗和贝伐珠单抗联用时的40%。
AK112在多个瘤种中表现出肿瘤响应。
截止2021年1月13日,入组患者包括宫颈癌、子宫内膜癌、非小细胞肺癌等多个癌种,就目前17个患者的有效性数据来看,ORR为23.5%,DCR为64.7%,AK112初步显著出对于PD-1无响应的肿瘤,及PD-1治疗过的肿瘤的治疗效果,后续进展值得期待。
3.2 肿瘤领域:以PD-1打头阵,多个潜力新靶点在研
3.2.1
AK105:抢占免疫治疗广阔市场
AK105为公司研发的PD-1单抗
,因其抗体Fc端独特的改造而具备差异化优势,
同时,AK105与中国生物制药的合作,将助力产品临床开发和商业化。AK105为短期内公司最受瞩目的产品之一,核心原因集中在两点:
①AK105预计为公司最先上市的产品。
AK105的新药上市申请已于2020年5月获得受理,适应症为复发或难治性经典霍奇金淋巴瘤(R/R c
HL),
预计2021年开始上市销售
,同时大适应症拓展积极进行,目前有四大适应症的5项研究已进入注册性临床,
预计皆在2021-2022期间申报NDA
,其适应症包括一线鳞/非
鳞NSCLC、一线肝癌和二线胃癌,均为和安罗替尼或化疗的联合疗法。
②与中国生物制药达成合作,加持商业化和大适应症联用开发。
公司与中国生物制药签署合资协议,授予正大天晴AK105在中国的独家销售权,同时公司拥有正大天晴重磅产品安罗替尼联合疗法的独家权利,考虑到中国生物制药在肿瘤领域的渠道积淀及3800人的肿瘤销售团队,预计该合作将给予AK105商业化和开发大适应症的强大助力。
3.2.1.1 通过Fc改造成为差异化的PD-1
PD-1蛋白是表达在T细胞表面的抑制性免疫检查点,通过识别正常细胞表面的PD-L1或PD-L2,以阻止T细胞介导免疫应答攻击体内正常细胞,然而,部分癌细胞通过大量表达PD-L1和PD-L2,形成免疫逃逸机制。抗PD-1单抗通过与T细胞表达的PD-1结合,解除肿瘤通过PD-1信号通路对T细胞免疫功能的“刹车”作用,使得T细胞恢复识别并清除癌细胞的能力。
AK105为公司研发的靶向PD-1的单克隆抗体,其
差异
化作用机制集中在两点:
可去除Fc-受体介导的效应功能以提高抗肿瘤活性;
解离速率较慢和提高受体占有率。
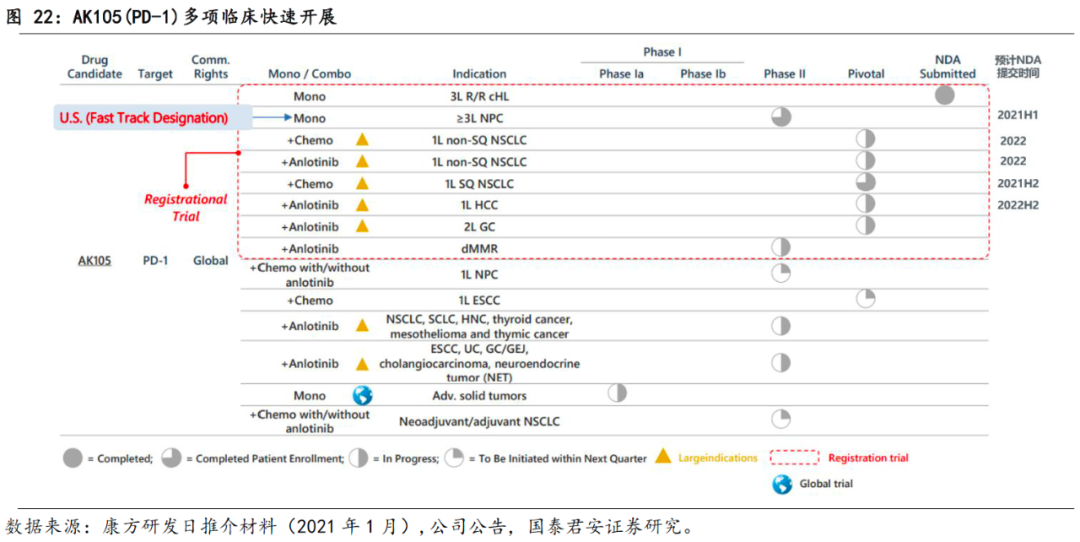
3.2.1.2 R/R cHL适应症预计于2021H1获批上市
AK105临床开发计划,遵循以单药单臂小适应症快速上市、同步开展联合用药大适应症临床、兼顾全球开发的中心思想
。目前AK105已在中国开展两项II期注册临床试验,分别为单药单臂治疗R/R cHL和≥3L鼻咽癌(NPC),其中,R/R cHL的新药上市申请已于2020年5月获药监局受理
,
NPC适应症预计2021年上半年提交NDA,
预计AK105在2021年可实行商业化销售。
随着AK105已申报上市,其大适应症开发也快速跟上,目前有四大适应症的5项研究已进入注册性临床阶段
,
预计皆在2021-2022期间申报NDA
,其适应症包括一线鳞/非鳞NSCLC、一线肝癌和二线胃癌,均为和安罗替尼或化疗的联合疗法。AK105具体临床进展如下:
①单药单臂快速上市策略
:AK105分别针对cHL和NPC进行单臂注册性临床,以用于有条件获批上市,目前3L R/R cHL已在2020年5月获得NDA受理,≥3L NPC
预计在2021H1递交NDA;
②联合疗法拓展大适应症:
目前AK105在四大适应症的5项研究已进入注册性临床阶段,
预计皆在2021-2022期间申报NDA
。其中,与化疗联合治疗一线鳞NSCLC适应症,
预计于2021H2提交NDA
;与化疗或安罗替尼联合治疗一线非鳞NSCLC的2项适应症,
预计于2022提交NDA
;与安罗替尼联合治疗一线肝癌适应症,
预计于2022H2提交NDA
;另有与安罗替尼联合用
于二线胃癌也在注册性临床。值得注意的是,公司在肺癌领域的适应症开发颇为全面,共有4项临床进入后期,分别为一线鳞NSCLC(+化疗, phase 3)、一线非鳞NSCLC(+化疗, phase 3)、一线鳞NSCLC(+安罗, phase 3)、新辅助/辅助NSCLC(+化疗/安罗, phase 2)。
③全球策略:
目前AK105已获得FDA针对评估其在宫颈癌和晚期实体瘤两个适应症的IND批准,并于2020.10获得FDA对于mNPC的快速审评认证,同时,AK105也在积极寻求全球合作机会。
3.2.1.3 PD-1格局尚未定型,正大天晴将强助力销售
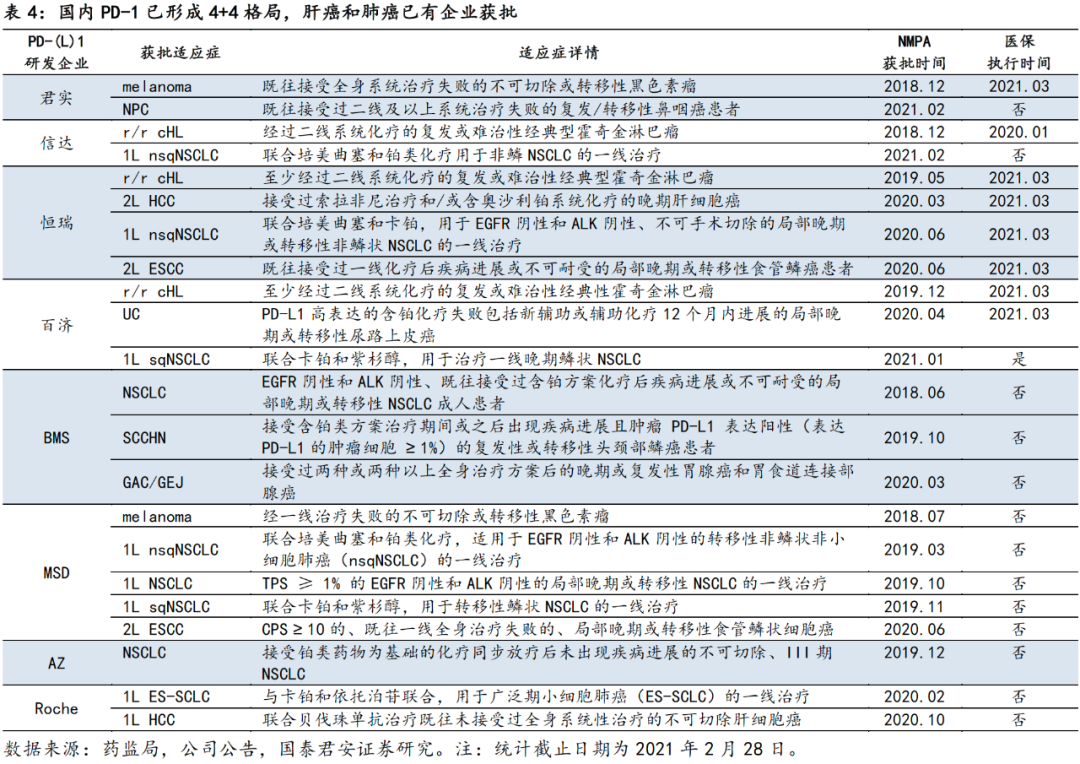
目前我国PD-1产品已形成4+4的竞争格局,自2020年12月医保谈判以来,国产PD-1价格均以降低至年花费平均约四万水平,进口PD-1虽未进入医保,但也随后更新了总体支付价更低的赠药方案,本土PD-1的竞争趋于白热化,未来竞争格局我们更趋于关注商业化能力强、大适应症快速获批进医保的PD-1玩家,同时也看好在一些现有治疗方案未能很好解决临床需求的小适应症(如鼻咽癌、宫颈癌)上部署的差异化战略。
在这场PD-1红海竞争中,big pharma商业化优势自不必说,而对于Biotech企业,当医保变成众人皆有的“武器”之后,虽然医保依旧具有帮助产品进院和放量的效果,但也无法成为撑起销量的免死金牌,毕竟现阶段本土Biotech的软肋仍在尚无成功商业化的经验,能否成功的借助医保这把推手成功的铺开销售渠道、建立销售网络管理和支持部门体系,还值得观察。此番分析之下,
我们认为,PD-1的竞争格局目前还未形成定局,2021年动态观察商业化团队扩张和进院落地情况,更为关键。
中国生物制药成为AK105在中国临床开发和商业化的合作伙伴,强势助力AK105商业化前景。
2019年6月,公司与中国生物制药的子公司正大天晴签署合资协议,根据协议,公司享有正大天晴重磅产品安罗替尼开发联合疗法的独家权利,正大天晴获得AK105在中国的独家销售权。考虑到中国生物制药具备强大的销售实力,其肿瘤销售团队截止2020年底达3800人规模,
我们认为,此次合作将极大的助力AK105的临床进度加快和上市后放量。
预计AK105虽然上市略晚,但后续销售额爬坡动力充足。

3.2.2
肿瘤免疫新靶点CD47和CD73研发进展值得期待
AK117是公司自研的下一代CD47单抗,
基于CD47在多个肿瘤中高表达的特性,该靶点有望成为下一个PD-1。CD47单抗的研发中,减少红细胞毒性是一大难点,公司AK117在保留抗肿瘤活性的同时,消除了红细胞凝集作用,显示出了差异化特性。在SITC 2020公布的首次人体数据来看,AK117在剂量提升至10mg/kg QW的情形下,未有患者发生药物相关贫血症状,目前20mg/kg QW的队列正在筹备中。总而言之,AK117安全性好,成药潜力值得期待。
我们认为,CD47单抗有比PD-1类单抗更高的价值
,集中体现在两点:①
CD47靶点市场空间大、竞争格局好
:CD47靶点在多个肿瘤中广泛表达,然而其凝血相关副作用为靶点药物的研发铸造较高技术壁垒,使得CD47单抗研发的成功难以被复制,AK117若研发进展顺利,有望获得竞争格局良好的蓝海市场;②
公司未来有望形成以CD47为核心的双抗组合
:CD47单抗前景广阔,公司自有的双抗TETRABODY技术有望赋能形成以CD47为核心的双抗组合,疗效和市场规模想象空间大。
AK119是公司自研的CD73单抗,
基于CD73在产生免疫抑制微环境中的关键作用,AK119的临床开发适应症主要针对COVID-19和实体瘤的治疗。已有临床前研究表明,CD73与PD-(L)1有较好的协同效应,
我们认为,值得关注公司对于CD73与双抗AK104(PD-1/CTLA-4)的联合用药,CD73有望成为提高PD-1类药物响应率的强力助手。
3.2.2.1 AK117(CD47单抗):有望成为下一个PD-1
PD-1类药物的成功,无疑打开了肿瘤免疫治疗的时代。那么在PD-1竞争白热化的当下,下一个“PD-1”在哪里?
众所周知,肿瘤免疫疗法的理论基础是“免疫监视”假说,即免疫系统可以监控并消除肿瘤以维持体内平衡环境。而免疫系统中的巨噬细胞、T细胞和自然杀伤(NK)细胞皆在免疫监视、抗肿瘤发生发展中起重要作用。红极一时的PD-1,即是作为T细胞表面的Checkpoint,参与了肿瘤免疫逃逸。然而,肿瘤细胞从免疫识别和清除中逃避的行为取决于多种因素,大体包括诱导免疫抑制性肿瘤微环境和降低肿瘤细胞的免疫原性,
其中,免疫抑制性肿瘤微环境并非仅PD-1这条信号通路,CD47也是其中一个重要的免疫抑制信号分子。
注:Checkpoint的定义如下,在T细胞活性上调时,为避免T细胞的过渡活化损伤正常组织,T细胞表面的免疫抑制分子在负向调控、维持稳态中起到重要作用,这类分子被称为免疫检查点checkpoint。checkpoint的发现对揭示肿瘤免疫逃逸机制至关重要,PD-1就是其中最成功的成药checkpoint。
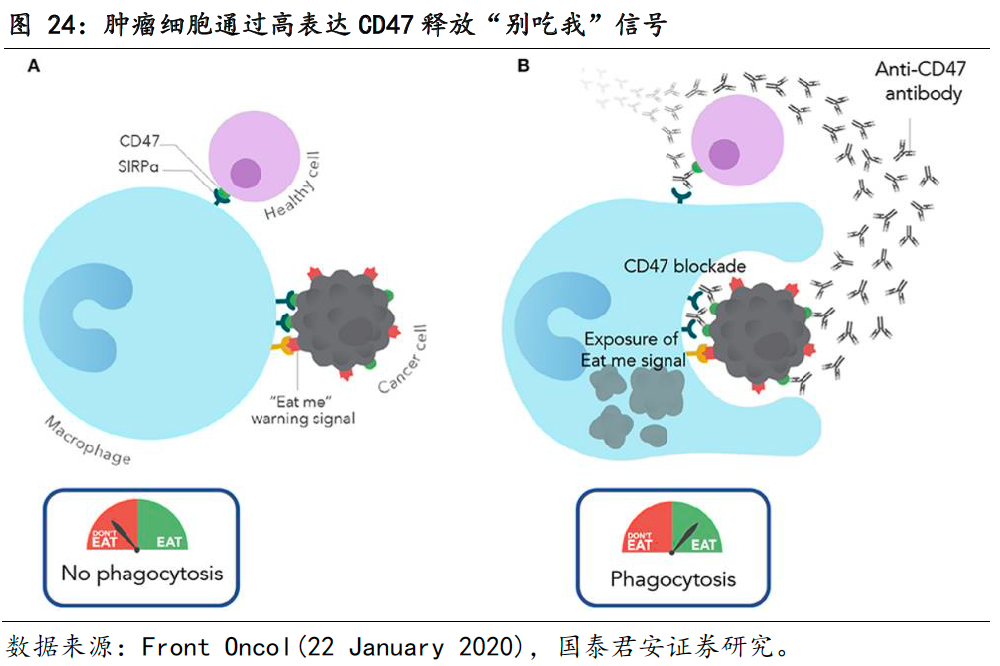
CD47在正常细胞中广泛表达,在多个肿瘤细胞中过表达。
正常细胞通过表达CD47来释放“别吃我”信号,CD47与巨噬细胞表面的SIRPα结合,从而保证正常细胞免受巨噬细胞吞噬。需注意,CD47的表达量会因为细胞的生理状态而发生改变,而细胞是否被巨噬细胞吞噬,是同时受“别吃我”和“吃我”两个信号平衡调控的。正常情况下,正常细胞在受到损害的过程中,会诱导“吃我”信号表达,以维持体内的平衡。然而,有些受损的正常细胞向恶性细胞的发展中,还会出现“别吃我”信号(即CD47的上调),以平衡“吃我”信号,逃逸巨噬细胞的清除。研究表明,
CD47在多个血液瘤和实体瘤中过表达,并通过与吞噬细胞表面的SIRPα结合,形成肿瘤免疫逃逸机制。
CD47单抗旨在通过结合肿瘤表面的CD47,阻断CD47/SIRPα信号通路,恢复巨噬细胞对肿瘤的识别和杀伤作用。而CD47单抗之所以可以特异性的杀伤肿瘤细胞,同时不杀伤正常细胞,正是因为肿瘤细胞不仅表达CD47,而且表达“吃我”信号,而正常细胞表达CD47,但是缺乏“吃我”信号。
然而在正常细胞中,红细胞(red blood cells, RBCs)是个例外,随着RBC的衰老,它们表面的CD47表达下调,同时表达并上调“吃我”信号,以帮助巨噬细胞清除衰老红细胞。因此,CD47单抗可能会通过与红细胞表面CD47结合,暴露“吃我”信号来加速RBC清除,从而使得患者使用CD47单抗时出现贫血。早在1980s,CD47就在卵巢癌作为肿瘤抗原被发现。然而至今,CD47靶点尚未有成药获批,其新药研发一波三折,
限制CD47靶点药物发展的主要因素就是严重的血液不良反应。
2017年Tioma终止其CD47单抗Ti-061、2018年Clegene终止其CD47单抗CC-90002,皆是因为血液学毒性。
直至2019年,Forty Seven在ASH公布了其研发的CD47抗体在AML和MDS适应症的Phase 1b试验所展示出的安全性和疗效,CD47才重新燃起科学界和资本界的广泛关注和热情。2020年以来,CD47也频频出现重磅交易,总价最高的当属吉利德在2020年3月以49亿美金收购Forty Seven公司(其重要产品为CD47单抗Magrolimab)。值得想象的是,如果能够克服CD47靶点的血液学毒性,凭借其在多个肿瘤的过表达特性,CD47单抗极有可能成为继PD-1之后的下一个泛肿瘤免疫药物。
公司研发的下一代CD47单抗(AK117)展现出良好的药物耐受性。
AK117与Forty Seven公司的Magrolimab(Hu5F9-G4)靶点同为CD47,但其差异化特点体现在:①在对红细胞的结合活性低,因而不引起红细胞聚集(血凝反应);②AK117介导巨噬细胞对红细胞吞噬的活性,显著弱于对肿瘤细胞的吞噬;③相较于其他CD47抗体所表现出的明显贫血症状,AK117在食蟹猴中仅出现轻微的红细胞变化,并且未观察到对血小板的毒性作用。
在临床前试验中,AK117表现出比Hu5F9-G4更好的安全性和相似的抗肿瘤活性。安全性上,与吉利德的Magrolimab相比,AK117表现出更低的对人RBC和B细胞的促吞噬作用,以及对RBC和B细胞更弱的结合能力;有效性上,AK117在两种不同的动物模型中,均展现出与吉利德的Magrolimab相似的抗肿瘤活性。
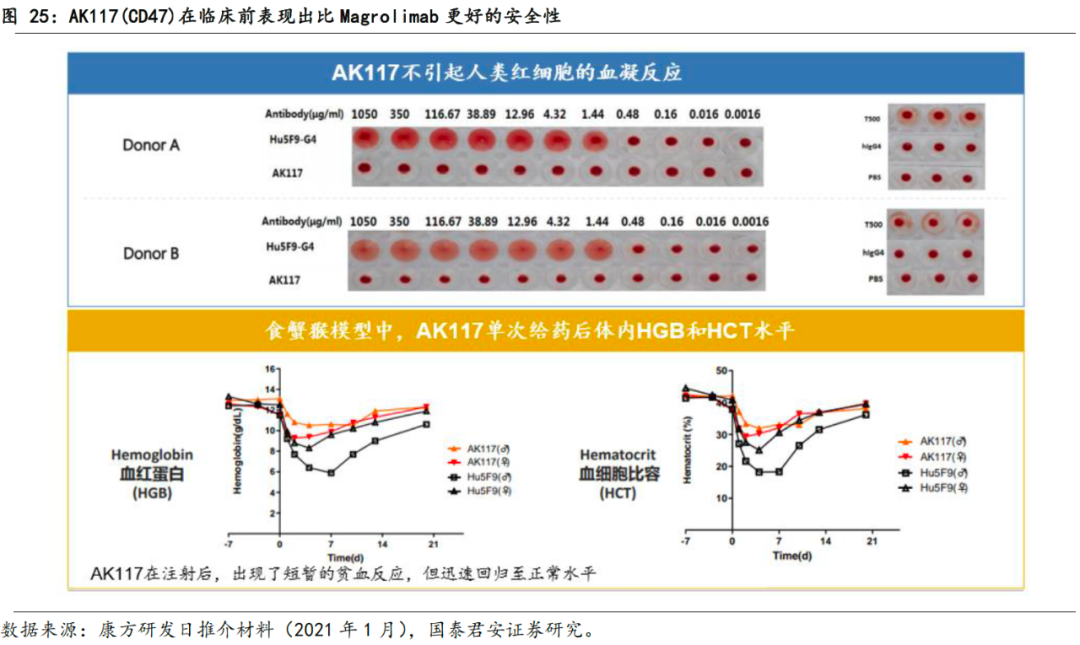

首次人体试验发布初步结果,再次证明AK117的安全性和成药潜力。
在2020年11月举办的免疫治疗学会年会(SITC)上,AK117临床数据的初步公布,进一步揭示了其良好的安全性和剂量爬坡后的有效性。AK117正在澳洲进行总样本量为159例的一期临床,适应症为晚期或转移性实体瘤或淋巴瘤,SISC 2020以壁报形式公布的阶段性结果表明,AK117最高已爬坡至10mg/kg QW,20mg/kg QW队列的受试者给药正在筹备中,从现有数据来看,未有药物相关贫血症状,无需使用预激剂量(priming dose),预示出较好的安全性,和基于安全性可展现出的剂量提升下的有效性。

目前AK117的多项临床正在筹备中。我们认为,AK117作为CD47单抗,于公司未来进一步打开肿瘤免疫市场至关重要,其重要性体现在两点:
1)CD47靶点市场空间大、竞争格局好
:CD47靶点虽然同PD-L1靶点一样在多个肿瘤中高表达,然而CD47靶点的凝血相关副作用铸造了靶点药物研发的高技术壁垒,使得CD47单抗研发的成功难
以被复制,AK117若研发进展顺利,有望获得竞争格局良好的蓝海市场。
2)公司未来有望形成以CD47为核心的双抗组合:
公司自有的双抗TETRABODY技术有望赋能形成以CD47为核心的双抗组合。目前公司的双抗平台,凭借着成功研制出的PD-1单抗,已打造出5款围绕PD-1靶点的双抗药物,未来如果CD47单抗研发成功,将进一步助力公司继续探索以CD47为核心的多样化双抗组合,疗效和市场规模的想象空间巨大。
3.2.2.2 AK119(CD73单抗):新兴的PD-1好伴侣
前文已经提到,肿瘤细胞从免疫识别和清除中逃避的行为取决于多种因素,大体包括诱导免疫抑制性肿瘤微环境和降低肿瘤细胞的免疫原性。多项研究表明,
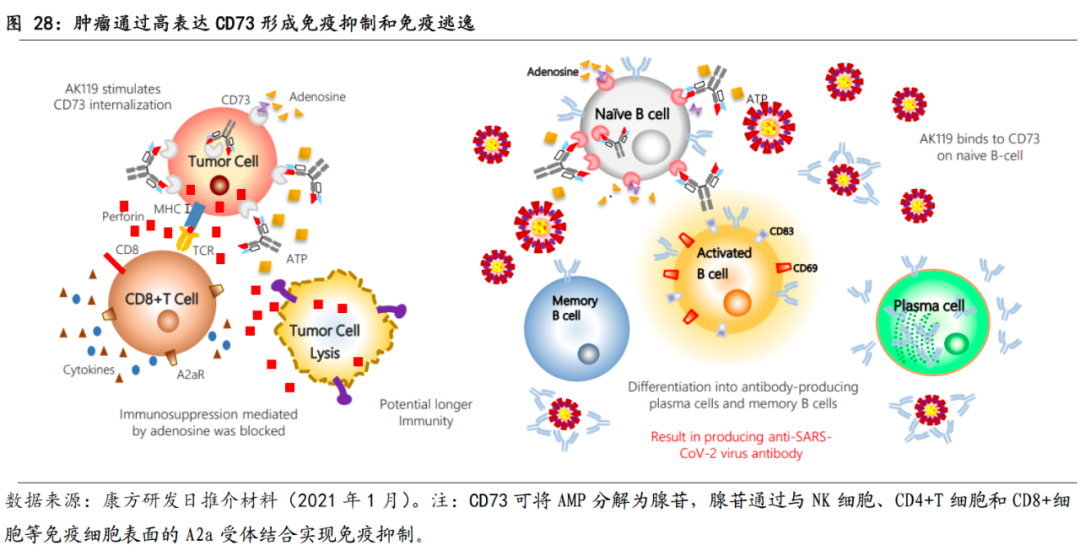
在实体瘤中,CD73是形成免疫抑制微环境、发生肿瘤免疫逃逸的关键成分之一。
CD73是一种细胞表面酶,广泛表达于人体内皮细胞、淋巴细胞(如Treg)等细胞表面,它可以将具有免疫激活功能的ATP转化为具有免疫抑制作用的腺苷,腺苷通过与下游腺苷受体(A2AR)结合,下调免疫活性。在肿瘤微环境中,低氧诱导癌胞表面过表达CD73,以通过CD73将AMP去磷酸化为腺苷,形成免疫抑制性肿瘤微环境,促进肿瘤生长。因此,抑制CD73可能会激活T细胞功能。
已有临床前研究表明,
CD73与PD-(L)1有较好的协同效应
。从目前全球CD73单抗临床开展情况来看,探索的治疗方案也多是CD73与PD-1或其他药物联用,未来,CD73有望成为PD-1类药物的好伴侣,进一步提高肿瘤免疫治疗的响应率。
公司自研的AK119为CD73单抗,基于CD73对于免疫的抑制作用,AK119的临床开发主要针对的是COVID-19和实体瘤的治疗。目前,公司已开展了针对COVID-19的单药治疗一期临床,其中,针对健康受试者的Phase1a试验正在入组
中,
针对中重度COVID-19感染者的phase1b试验预计将在2021H1开展
。针对实体瘤适应
症,公司已开展了AK119与双抗AK104(PD-1/CTLA-4)在多项实体瘤中的临床,未来的有效性数据值得期待。

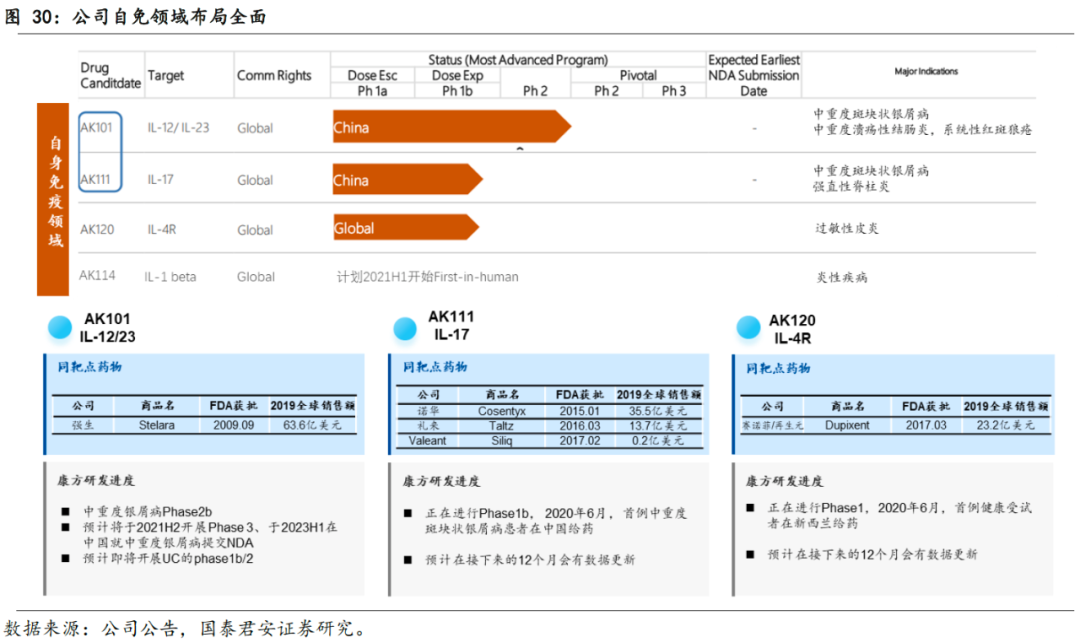
3.3 自身免疫领域:布局全面,战略性推进IL-12/23
公司在自身免疫性领域布局全面,已开发出本土生物制药公司里最丰富的创新产品管线之一,在研产品包括IL-12/23单抗(AK101)、IL-17单抗(AK111)、IL-4R(AK120)和IL-1 beta抗体(AK114)
。
➢自身免疫病的特征及治疗药物发展历程
自身免疫病是由于机体免疫系统对自身组织和器官发生了免疫应答,并造成组织损失和功能障碍的一类疾病,具体疾病类型有类风湿关节炎、系统性红斑狼疮、炎症性肠病、多发性硬化症、干燥综合征、强直性脊柱炎、慢性活动性肝炎、支气管哮喘等。自免患病人群约占世界人口的5%~10%,其发病特征为局部或全身性异常炎症免疫反应,其治疗目标为症状缓解和延缓病程。
21世纪前,自免疾病治疗药物主要为非甾体抗炎药(NSAIDs)、甾体抗炎药(SAIDs)和改善病情抗风湿药(DMARDs),随着生物制药的迅猛发展,以细胞因子、受体和信号分子为治疗靶点的生物制剂开始上市,这类生物制剂可针对自免疾病的潜在诱因,因此可减少因免疫系统受损而引起的副作用,并增加疾病缓解的机会。21世纪初,以TNF-α为主要靶点的生物制剂上市,随后,鉴于一大部分人对于TNF-α抑制剂响应不足或长期使用后疗效下降、副作用增强,以白介素为靶点(IL-1、IL-6、IL-17、IL-12及IL-23)的第二代自免靶向抑制剂开始出现,相比于TNF-α抑制剂开辟适应症广泛,针对IL分子的生物制剂多表现出针对某些特定自身免疫病,且有显著提高的PASI 75/90/100缓解率和良好的安全性。
目前,全球自免生物制剂涵盖的前五大适应症为自身免疫性关节炎(即幼年特发性关节炎及类风湿性关节炎)、炎症性肠病(含克罗恩病和溃疡性结肠炎)、银屑病、狼疮(含系统性红斑狼疮)及1型糖尿病。
3.3.1 AK101:有望成为首个本土开发的IL-12/IL23抑制剂
AK101是公司自研的靶向IL-12/IL23的单克
隆抗体药物,主要在研适应症为自身免疫性疾病,具体包括银屑病和溃疡性结肠炎,目前进度最快的适应症为中重度银屑病
,预计将于2021H2开展Phase 3、于2023H1在中国就中重度银屑病提交NDA,同时溃疡性结肠炎将会在中美同时开展临床。
AK101的亮点:可能是首个本土开发的针对已验证第二代自身免疫性疾病靶点IL-12/IL-23的单抗。
AK101的关键优势具体集中在三点:①作用靶点基于Stelara验证过的IL-12/IL-23,疗效较Stelara相似
或更佳;②相比于TNF-α抑制剂,剂量和给药频率上更佳;③安全性方面,目前为止在AK101在试验中未发现SAE,安全性与TNF-α抑制剂截然不同。
参考同靶点药物Stelara目前在销售上取得的巨大成功(2019年全球销售额64亿美元),AK101的前景值得期待。
3.3.1.1
有望追随Stelara在全球商业化的巨大成功
➢
AK101的研发背景:与全球自免重磅产品Stelara同靶点
AK101与强生的Stelara(乌司奴单抗)靶点相同,皆针对第二代自身免疫性疾病靶点IL-12/IL-23。Stelara自2009年在FDA首次获批以来,目前已获批克罗恩病、溃疡性结肠炎、银屑病性关节炎、斑块状银屑病四项适应症,2019年全球销售额64亿美元(YOY +23.4%),是2019年全球治疗自身免疫性疾病的第三大畅销药。疗效上,相较于第一代自身免疫性疾病靶点TNF-a抑制剂的潜在不良反应(如严重感染),Stelara副作用更低。Stelara的高销售额及较低的副作用,皆充分证明该靶点广阔的应用场景和市场空间,虽然2015年以来,FDA也陆续获批了IL-17抑制剂和IL-23抑制剂,但这些靶点的抑制剂,无论从适应症拓展和转化的销售额上来看,皆未达到Stelara的风光程度。

目前,AK101适应症开发延续Stelara已获批适应症轨迹,在研适应症为斑块状银屑病和溃疡性结肠
炎,
其中,中重度银屑病进展最快,预计将于2023H1在中国就中重度银屑病提交NDA。
➢
AK101的作用机制:通过p40同时阻断IL-12和IL-13
IL-12及IL-23是两种不同的促炎细胞因子,在炎症反应及免疫反应中自然产生。IL-12和IL-23皆为异源二聚体,两者有共用的亚基p40。IL-12由p40亚基键接至p35亚基组成,IL-23由p40亚基键接至p19组成。在机体中,抗原引发T细胞活化,进而使活化后的T细胞分泌出IL-12和IL-23,IL-12和IL-23通过结合各自的受体复合物,激活下游的JAK2-STAT信号途径,不同的是,IL-12主要激活STAT4,而IL-23主要激活STAT3。在后续的信号传导中,IL-12的出现导致Th1细胞增殖,Th1细胞会释放干扰素IFN和肿瘤坏死因子TNF-α;IL-23则引起Th17细胞发育,并分泌IL-17、IL-22等促炎性细胞因子以参与机体免疫。据《中国银屑病诊疗指南(2018)》显示,Th17细胞及IL-23/IL-17轴在银屑病发病机制中可能处于关键环节。
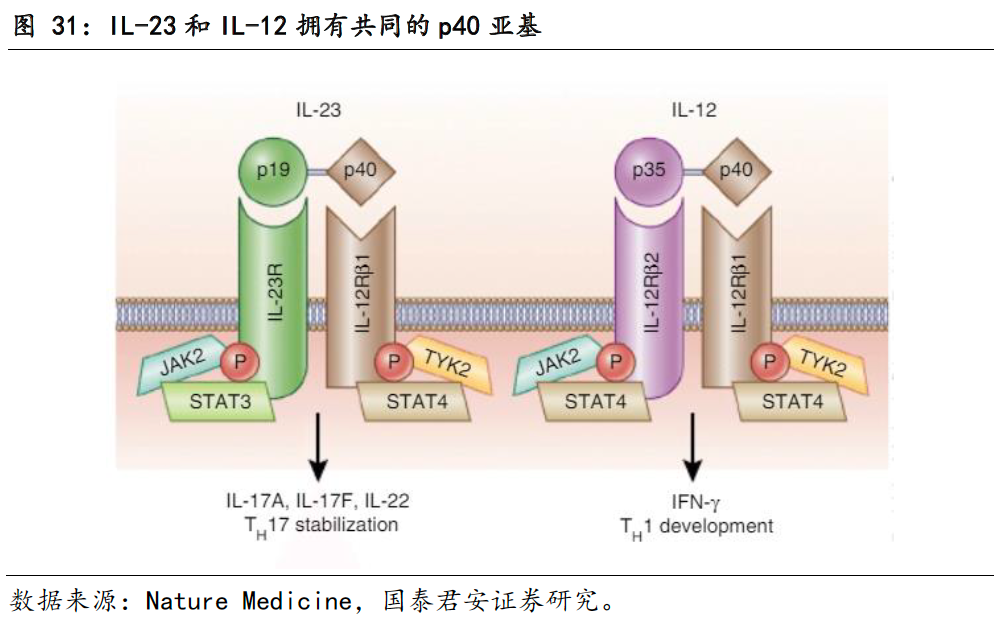
AK101作为单特异性抗体,通过与IL-12和IL-23的p40亚基结合,同时抑制IL-12和IL-23与细胞表面的IL-12Rβ1受体结合,导致Th1细胞和Th17细胞减少,导致其分泌的的IL-17和TNF-α减少,从而阻止疾病的发生。
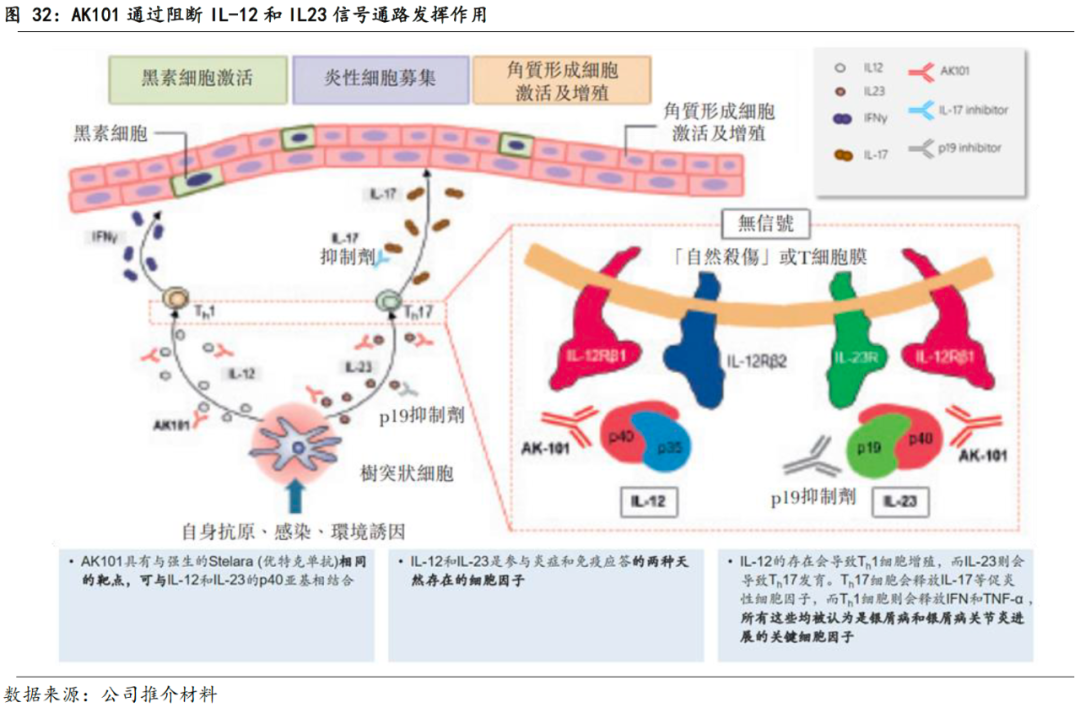
3.3.1.2















