 Sherene Loi, Damien Drubay, Sylvia Adams, Giancarlo Pruneri, Prudence A. Francis, Magali Lacroix-Triki, Heikki Joensuu, Maria Vittoria DieCI, Sunil Badve, Sandra Demaria, Robert Gray, Elisabetta Munzone, Jerome Lemonnier, Christos Sotiriou, Martine J. Piccart, Pirkko-Liisa Kellokum Pu-Lehtinen,Andrea Vingiani, Kathryn Gray, Fabrice Andre, Carsten Denkert, Roberto Salgado, Stefan Michiels
Sherene Loi, Damien Drubay, Sylvia Adams, Giancarlo Pruneri, Prudence A. Francis, Magali Lacroix-Triki, Heikki Joensuu, Maria Vittoria DieCI, Sunil Badve, Sandra Demaria, Robert Gray, Elisabetta Munzone, Jerome Lemonnier, Christos Sotiriou, Martine J. Piccart, Pirkko-Liisa Kellokum Pu-Lehtinen,Andrea Vingiani, Kathryn Gray, Fabrice Andre, Carsten Denkert, Roberto Salgado, Stefan Michiels
点评
山重水复疑无路,柳暗花明又一村
——论肿瘤浸润淋巴细胞在早期三阴性乳腺癌预后中的意义
点评专家:
吕铮
吉林大学第一医院
三阴性乳腺癌是乳腺癌所有分子亚型中预后最差的一种亚型,相比
Luminal
型和
HER-2
过表达型乳腺癌,三阴性乳腺癌缺乏靶向治疗和内分泌治疗,化疗仍是辅助治疗的唯一全身治疗手段;
同时预后方面,三阴性乳腺癌缺乏用来区分复发风险高低和是否可以放弃化疗的多基因标签,如
21
基因检测、
MammaPrint 70
基因检测、
EndoPredict®
(
EpClin
)和
Breast Cancer Index
(
BCI
)等,目前还需依赖组织学分级、肿瘤大小、淋巴结转移等病理指标来判断预后。
对于三阴性乳腺癌的研究似乎已到了山重水复的境地。
已有研究发现,对于多种实体肿瘤如黑色素、卵巢癌等,肿瘤微环境中肿瘤浸润淋巴细胞(
Tumor-Infifi ltration Lymphocytes, TIL
)的高度浸润往往提示较好的预后,
Aaltomaa
等也在
1992
年首次报道了乳腺癌中
TILs
的预后作用。
随着研究的进展,已经有研究陆续报道了
TIL
在早期三阴性乳腺癌中预后的意义。
本研究将已经发表的
9
个前瞻性研究和大型回顾性研究中三阴性乳腺癌患者的原始病理资料,利用汇总分析的方法,重新分析了间质
TIL
(
stromall TIL, sTIL
)与预后的关系,发现
sTIL
可以预测
iDFS
、
D-DFS
、
OS
等生存指标,每增加
10% sTIL
,
iDFS
、
D-DFS
、
OS
也随之增加,并且在淋巴结阴性的三阴性乳腺癌中,
sTIL
高于
30%
的患者,
3
年的
iDFS
、
D-DFS
、
OS
均可达到
92%
以上。
这个研究结果似乎让我们看到了柳暗花明又一村的景象。
sTIL
可能会成为类似
21
基因一样的预测指标,将三阴性乳腺癌区分为预后不同的亚组,对于预后好的患者,我们也许会放弃化疗,或者降阶梯化疗,如仅用
AC/TC
等;
对于预后差的患者,我们可能会更倾向于应用密集的
AC-T
等强度较大的方案。
本研究采用的汇总研究,区别于荟萃分析,它能够利用原始资料进行更深入的数据合并和再分析,尽管花费较大的人力、物力,但是可以将不同研究中的
sTIL
原始资料按照统一标准分析,同时可获得大样本资料,使得本研究的证据级别更高,结果更可靠,更有可能应用于临床实践。
sTIL
常用的检测手段是免疫组织化法,但评价标准尚无统一规定。
2014
年国际
TILs
工作组(
International TILs Working Group
)进行了统一规定,建议通过计算
TILs
在肿瘤浸润范围内所占面积(并非数量)的百分比进行评估。
本研究也着重强调了检测方法的一致性和可重复性,这为临床推广提供了前提。
本研究也存在一些局限性,比如纳入的人群不是近
10
年诊断的患者,这可能影响生存分析;
sTIL
的浸润程度以
30%
为界,目前还需要更多前瞻性的研究进一步得出更精准的界限值,指导临床医师判断三阴性乳腺癌的预后。
摘要
目的
本 研 究 是 对 肿 瘤 浸 润 淋 巴 细 胞(
tumor-infifi ltrating lymphocytes, TILs
)在早期三阴性乳腺癌(
triple negative breast cancer, TNBC
)中的预后价值进行汇总分析。
方法
所纳入的研究评估了位于间质
TILs
(
stromally TILs, sTILs
)的浸润比,这些
TILs
以相同的方式在接受以蒽环类药物为基础或联合紫杉类药物治疗的早期
TNBC
患者诊断样本中进行定量分析。试验分层的
Cox
比例风险回归模型用于分析无侵袭性疾病生存期(
invasive diseasefree survival, iDFS
;主 要 终 点), 无 远 处 疾 病 生 存 期(
distant disease-free survival, D-DFS
)和总生存期(
overall survival, OS
),以根据临床病理因素调整的
sTILs
作为连续变量。
结果
我们收集了来自
9
项研究的共
2,148
例患者的数据,平均年龄为
50
岁(
22-85
岁),
33%
的患者为淋巴结阴性。
sTILs
平均值为
23%
(标准差,
20%
),
77%
的患者
sTILs
值不低于
1%
。年龄越大(
P
=0.001
),肿瘤越大(
P
=0.01
),浸润的淋巴结数量越多(
P
=0.02
),组织学分级越低(
P
=0.001
),则
sTILs
数量越少。共观察到
736
例
iDFS
和
548
例
D-DFS
以及
533
例死亡事件。在多变量模型中,
sTILs
为所有终点增加了重要的独立预后信息(相似比 χ
2
,
48.9 iDFS
;
P
<0.001
;χ
2
,
55.8 D-DFS
;
P
0.001
;χ
2
,
48.5 OS
;
P
<0.001
)。
sTILs
中每增加
10%
,与之对应,
iDFS
风险比为
0.87
(
95%
置信区间
[confifi dence interval, CI]
,
0.83-0.91
),
D-DFS
风险比为
0.83
(
95% CI
,
0.79-0.88
),
OS
风险比为
0.84
(
95% CI
,
0.79-0.89
)。
sTILs ≥ 30%
的淋巴结阴性患者,
3
年
iDFS
为
92%
(
95%CI
,
89%-98%
),
D-DFS
为
97%
(
95% CI
,
95%-99%
),
OS
为
99%
(
95% CI
,
97%-100%
)。
结论
这项汇总数据分析证实了
sTILs
在早期
TNBC
中的强预后作用以及辅助化疗后高
sTIL
患者生存率更佳,并支持将
sTILs
整合到
TNBC
患者的临床病理学预后模型中。该模型见
www.tilsinbreastcancer.org
。
前言
在对乳腺癌患者进行预后评估时,通常不考虑宿主微环境。
无论是我们还是其他学者早前的研究,已经表明早期三阴性乳腺癌(
triple-negative breast cancer, TNBC
)和人表皮生长因子受体
2
(
human epidermal growth factor receptor 2, HER2
)阳性乳腺癌样本中免疫相关细胞浸润比例越高,则临床结果越改善明显
[1]
。浸润比通过苏木精
-
伊红染色的标准诊断方法进行定量,这种简单的量化肿瘤浸润淋巴细胞(
tumor infifiltrating lymphocytes, TILs
)在以计算出肿瘤和周围间质中的浸润百分比的方法已被证实是一种可重复的生物标志物,可以在全球标准临床病理学中进行相对简单的实施
[2,3]
。
目前早期
TNBC
的主要预后因素代表的是解剖学上的肿瘤负荷。
在这项主要从大型临床研究中获得的患者数据的汇总分析中,我们试图最终确定
TILs
在该乳腺癌亚型中的预后价值。这些证据将有力地支持未来乳腺癌预后分期系统中早期
TNBC
应用新的生物标志物
[4
]
,这些标志物可以用作为临床试验分层因子,并有可能指导乳腺癌的免疫治疗发展。随着免疫检查点阻断剂的应用在其他实体肿瘤类型中不断获得成功,明确乳腺癌免疫浸润的预后作用十分必要。
因 此, 本 研 究 的 主 要 目 的 是 深 入 了 解 间 质
TILs
(
stromal TILs, sTILs
)生物标志物在接受标准辅助化疗治疗的早期
TNBC
中的预后价值。
我们通过对来自多个个体研究的
2,000
多例患者的数据进行汇总分析,其中
TILs
都是以相同的方式即苏木精
-
伊红染色的标准诊断方法进行评估
[3]
。使用先前选择的
sTILs
变量用于初步分析,仅在二级分析中使用肿瘤内
TILs
(
intratumoral TILs, iTILs
)。此外,来自多种不同类型研究的大数据集合为预测模型的开发和验证提供了新的机会
[5]
;因此,我们的次要目的是开发和验证预后模型,该模型将
TILs
评估与传统临床病理因素相结合,这将有助于临床医生做出更全面、更准确的预后评估。我们还试图确定
TIL
的预后效果是否在接受蒽环类药物或联合紫杉类药物的早期
TNBC
患者中有定量差异,这也许可以表明化疗药物的种类对其预后影响是否重要。
方法
患者数据集
此次合作项目的研究方案由入选的研究人员制订,并于
2014
年
11
月得到了
Gustave Roussy
当地的机构审查委员会的批准和法国国家计算机和自由委员会的授权。
已有前瞻性随机临床试验或大型回顾性医院系列的研究评估了
TILs
(间质和肿瘤内)同在辅助治疗中接受了相同的指定的蒽环类化疗或联合紫杉类药物治疗的早期
TNBC
确诊患者的预后相关性
[6-13]
。接洽所有做过相关报告或参与过
TIL
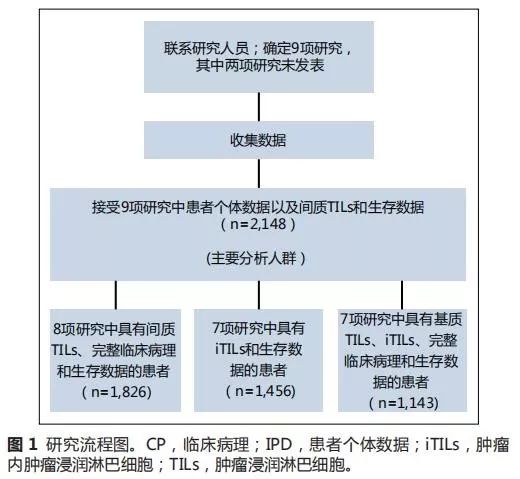
评估的研究人员和团队,均答应参与本研究。使用个体患者数据元分析技术对个体患者水平数据进行整理、核对和汇总(图
1
)。
TNBC
定义为雌激素受体(
estrogen receptor, ER
)、孕激素受体(
progesterone receptor, PR
)和
HER2
阴性,但由于
PR
状态未知,所以排除
Gustave Roussy
(
GR
)队列研究。根据每个方案每项研究定义
ER
和
PR
状态,或由中心病理学审查通过以下免疫组织化学染色百分比规定:乳腺国际组(
Breast Infernational Group, BIG
)
2-98
,国际乳腺癌研究组(
International Breast Cancer Study Group, IBCSG
)
22-00
(
ClinicalTrials.gov
注册号:
NCT00022516
),和美国东部肿瘤协作组(
Eastern Cooperative Oncology Group, ECOG
)
2197
(
ClinicalTrials.gov
注 册 号:
NCT00003519
)定义
ER
和
PR
的表达低于
1%
,其他研究定义为低于
10%
(
ECOG 1199 [ClinicalTrials.gov
注册号:
NCT00004125]
,芬兰赫赛汀(
Finland Herceptin, FinHER
),欧洲肿瘤学研究所(
European Institute of Oncology, IEO
),乳腺癌辅助方案(
Protocole Adjuvant dans le Cancer du Sein, PACS
)
01
, 和
PACS04
)。除 了
FinHER
、
IEO
、
ECOG 2197
和
ECOG 1199
之外,其余研究均集中进行
ER
和
PR
染色。少数中心
ER
状态缺失的患者,使用局部
ER
评估。对
FinHER
、
IEO
、
IBCSG22-00
、
ECOG 2197
、
PACS01
和
PACS04
系列进行中心
HER2
评估。
 TIL 的量化
根据国际免疫肿瘤学生物标志物工作组的指南对
sTIL
和
iTIL
进行量化
[
2,3
]
。方法详情可在网页(
www.tilsinbreastcancer.org
)上免费获取,且该网页为病理学家提供了免费的
TIL
评估培训工具。基于本研究的目的,获得
PACS01
和
PACS04
临床试验中尚未发表的
TILs
数据(由
R.S.
和
M.L.
提供)。
sTILs
变量作为汇总分析的主要预定义的生物标志物,因为与
iTILs
相比,它已被发现具有更高的可重复性
[
2,3
]
。
TIL 的量化
根据国际免疫肿瘤学生物标志物工作组的指南对
sTIL
和
iTIL
进行量化
[
2,3
]
。方法详情可在网页(
www.tilsinbreastcancer.org
)上免费获取,且该网页为病理学家提供了免费的
TIL
评估培训工具。基于本研究的目的,获得
PACS01
和
PACS04
临床试验中尚未发表的
TILs
数据(由
R.S.
和
M.L.
提供)。
sTILs
变量作为汇总分析的主要预定义的生物标志物,因为与
iTILs
相比,它已被发现具有更高的可重复性
[
2,3
]
。
统计分析
预定义的主要终点是无侵袭性疾病生存期(
invasive disease-free survival, iDFS
),规定为首次浸润复发的日期,或任何原因导致的第二终点或死亡的日期
[14
]
。无远处疾病 生 存 期(
distant disease-free survival, D-DFS
)规定为首次远处复发或任何原因导致死亡的日期。以上没有发生本研究关注事件的存活患者最近一次到医院行检查的时候,我们对其进行访视。总生存期(
overall survival, OS
)定义为任何原因导致死亡的日期。仍然存活的患者在最后一次就诊时访视。我们使用
Kaplan-Meier
方法建立生存曲线,并使用
log-rank
检验来比较各亚组的生存曲线。
预定义的初步分析使用
sTIL
作为
Cox
比例风险回归模型中的连续变量。
在
BIG 2-98
数据的基础上
[8]
,我们假设
TNBC
患者中
sTILs
变化
10%
范围内的标准差为
1.75
。以此值为基础,在
iDFS Cox
比例风险回归模型中,共
111
例侵袭性事件或死亡,在
5%
的双侧显著性水平下提供了
85%
检验效能,用于检测
sTILs
增加
10%
时的风险比(
hazard ratio, HR
)为
0.85
。
使用具有
gamma frailty
的
Cox
比例风险回归模型进行单变量和多变量风险分析以解释研究异质性。我们使用趋势检验和基于
Schoenfeld
残差的图形诊断验证比例风险假设,以及使用拟合样条验证对数线性假设。使用研究校正的线性回归进行与临床病理学变量的相关性分析。
进行
Cochrane Q
检验并且估算每个终点的
I
2 指数以确定每项研究之间的异质性(
I
2
=0
表示没有异质性,
I
2 值与异质性成正比)。
在多变量模型中,我们使用似然比检验来评估
sTILs
、
iTILs
和临床病理因素的影响(年龄;肿瘤大小分级:
T1
,
T2
,
T3+
;淋巴结阳性数目;组织学分级:
1
和
2
v
3
;以及化疗方式:蒽环类药物
v
蒽环类药物联合紫杉类药物)。在
ECOG 2197
研究中,对
Cox
模型进行加权以考虑病例对照样本
[
6
]
。
完全开发的多变量
Cox
比例风险回归模型利用
gamma frailty
,将
sTILs
、上述指定的临床病理因素用于研究,以及
Breslow
评估基线风险。
分别以
iDFS
、
D-DFS
和
OS
为终点,开发三个这样的模型。为了估计这些多变量预后模型的差异和标准,我们采用了留一交叉验证法。每项研究都会被排除一次,模型会与其他研究项重建。然后将该模型应用于排除的研究以评估差异和标准。我们通过
5
年内曲线下的时间依赖区域来评估区分
[
1
5]
,校准通过校准图进行评估。在留一交叉验证法的每个步骤中,根据留一试验的预测存活时间的十分位数来定义层。良好的标准与
Kaplan-Meier
估计及每个层中的平均预测值之间没有显著性差异相符。
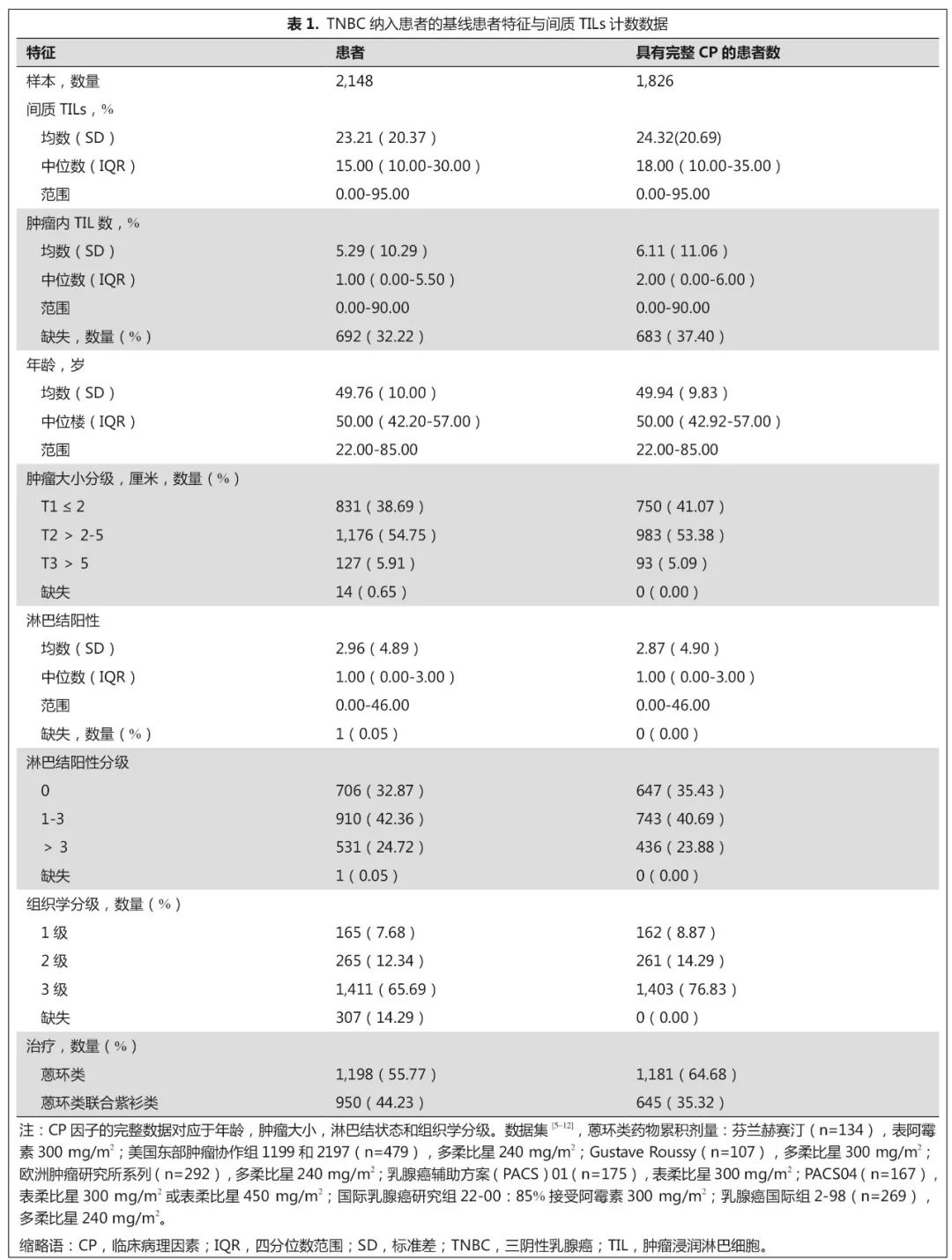
患者特征
总共纳入了包含
2,148
例患者个体数据的
9
项研究,用于初步分析中评估
sTILs
的预后价值。
这些研究及患者特征列于表
1
和数据补充中。仅有一个数据集
[
10
]
不是前瞻性临床试验。对于
iDFS
终点,中位随访时间为
6.58
年(范围为
2.71-9.12
年),共
736
例事件(补充数据)。
D-DFS
终点的中位随访时间为
6.99
年(范围为
3.50-9.54
年),共
584
例事件。
OS
终点的中位随访时间为
7.15
年(范围为
4.18-9.61
年),有
533
例事件。在这
2,148
例患者中,
1,826
例(
84.7%
)同时具有多变量模型的
sTIL
和完整的临床病理学信息(图
1
和表
1
)。
平均
sTILs
水平为
23%
(标准差,
20%
;范围
0%-95%
),中位数为
15.00%
(四分位数间距,
10%-30%
)。研究提供了柱状图,并在补充数据中提供了总数据。淋巴结阴性肿瘤患者占该队列的
32.9%
(
706/2,148
)(平均
sTIL
水平,
20.2%
;标准差,
20.3%
),所有患者均接受单独使用蒽环类药物(
55.8%
)或联合紫杉类药物(
44.2%
)作为辅助化疗。共有
1,592
例患者(
73.8%
)接受了
iTIL
评估,
1,144
例患者(
53.1%
)具有完整的临床病理信息(补充数据)。在这个汇总的数据集中,
sTILs
和
iTILs
的数量具有很强的相关性(
R=0.63
;
P
<0.001
)。
与临床病理因素的联系
随着年龄的增长,
sTILs
数量显著降低(线性模型,
P
=0.001
)。肿瘤负荷与存在的
sTIL
数量之间存在明显的负相关关系(肿瘤大小
P
=0.01
;更多节点
P
=0.02
;补充数据)。与之前的报告相符,组织分级越高,
TIL
数量越多(
P
=0.001
)。
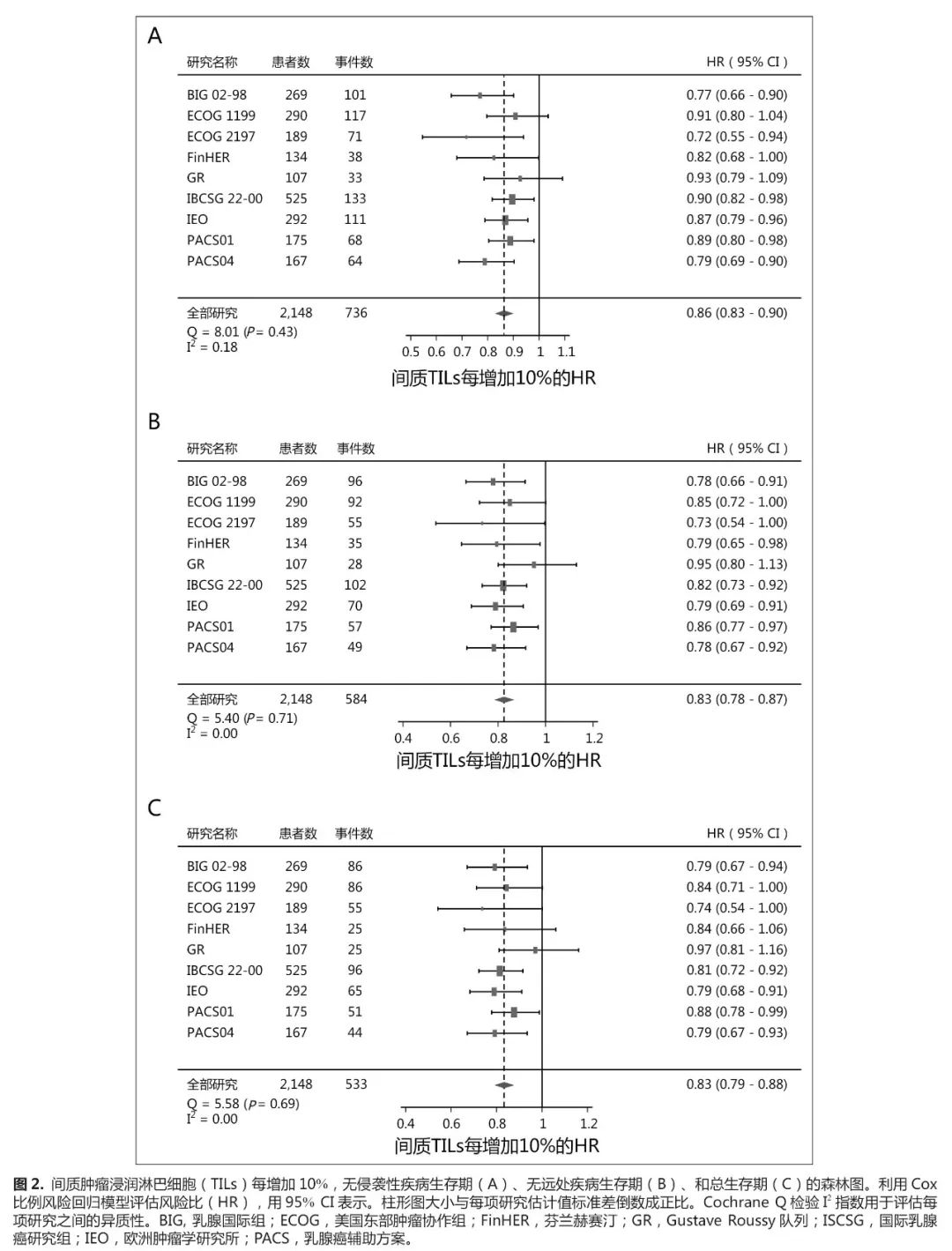
与预后的联系
sTILs
的数量与所有终点的生存结果改善显著相关(图
2
)。对于
iDFS
,在
sTIL
中
HR
增加
10%
等于
0.86
(
95%CI
,
0.83-0.90
), 并 且 观 察 到
D-DFS
(
0.83 [95% CI
,
0.78-0.87]
)和
OS
(
0.83 [95% CI
,
0.79-0.88]
)也具有相似的结果,每个终点都没有发现显著的异质性。
sTILs
和化学治疗之间没有显著的相互作用(即,患者单独使用蒽环类或蒽环类联用紫杉类药物,这两种方案的预后结局相似;
相互作用
P
值分别为:
iDFS
:
P
=0.62
;
D-DFS
:
P
=0.63
;
OS
:
P
=0.54
)。
iTIL
的预后分析结果相似(补充数据),在每个终点的研究之间同样没有显著的异质性。总体而言,
iTIL
增加
10%
相当于
iDFS
的
HR
为
0.74
(
95% CI
,
0.65-0.85
),
D-DFS
的为
0.73
(
95% CI
,
0.62-0.84
),
OS
的为
0.76
(
95%CI
,
0.65-0.88
)。
预后 sTIL 探索性阈值
图
3
描绘了使用
sTILs
探索性水平阈值
30%
的生存曲线,图
4
显示了由节点状态和阈值分层的生存曲线。尽管预后受到变量和线性的影响导致在
Cox
比例风险回归模型中很难选取阈值,但选择百分比作为阈值是因为它反映了整个研究中三个临床终点的
sTILs
水平的最高四分位数。全部亚组和整个人群中所有三个终点的
3
年和
5
年生存概率估计值见补充数据。在所有节点类别中观察到生存结局的绝对差异很大。对于所有淋巴结阴性并且诊断出至少有
30% sTILs
的
TNBC
患者(
n=213
),可以观察到预后良好,估计
3
年
iDFS
为
92%
(
95% CI
,
89%-98%
),
3
年
D-DFS
为
97%
(
95% CI
,
95%-99%
),
3
年
OS
为
99%
(
95% CI
,
97%-100%
)。
当聚焦到至少有
30% sTILs
的
T1-2
,
N0
亚群——三分之一淋巴结阴性人群(
206/684
)的
3
年
iDFS
,
D-DFS
和
OS
的估计值分别为
93%
(
95% CI
,
90%-97%
),
98%
(
95% CI
,
95%-100%
)和
99%
(
95% CI
,
98%-100%
)。
 临床病理学预后综合模型
单变量和多变量分析证实了早期
TNBC
中
sTIL
和
iTILs
作为连续变量的显著且独立的预后价值(表
2
和补充数据)。
应用似然比检验,我们研究了标准临床预后因素的额外
TILs
预后信息。
除了传统的临床病理因素之外,
sTILs
还增加了显著的预后信息(似然比检验 χ
2
,
iDFS
为
48.9
;
χ
2
,
D-DFS
为
55.8
;
χ
2
,
OS
为
48.5
;
所有
P
<0.001
)。
相反,
iTIL
没有使用
sTIL
(补充数据)向模型添加其他信息。
临床病理学预后综合模型
单变量和多变量分析证实了早期
TNBC
中
sTIL
和
iTILs
作为连续变量的显著且独立的预后价值(表
2
和补充数据)。
应用似然比检验,我们研究了标准临床预后因素的额外
TILs
预后信息。
除了传统的临床病理因素之外,
sTILs
还增加了显著的预后信息(似然比检验 χ
2
,
iDFS
为
48.9
;
χ
2
,
D-DFS
为
55.8
;
χ
2
,
OS
为
48.5
;
所有
P
<0.001
)。
相反,
iTIL
没有使用
sTIL
(补充数据)向模型添加其他信息。
建立综合预后模型,将标准预后临床病理因素与连续的
sTIL
水平相结合,用于提高早期
TNBC
生存结局的估计值。
添加
sTILs
变量增加了模型的差异性,如使用留一交叉验证法估计时,














