由于广泛的遗传和表观遗传改变,肿瘤细胞产生了大量正常细胞中不存在的蛋白质。这些蛋白质导致MHC I类相关肽段库的改变。表位的范围不仅包括肿瘤细胞中异常表达的基因所产生的肽段,还包括因肿瘤细胞中的体细胞突变而产生的“新抗原”。因此,这些新抗原是肿瘤特异的,也是患者独有的。T细胞可识别人类肿瘤细胞表面的这些抗原,从而介导癌症消退。
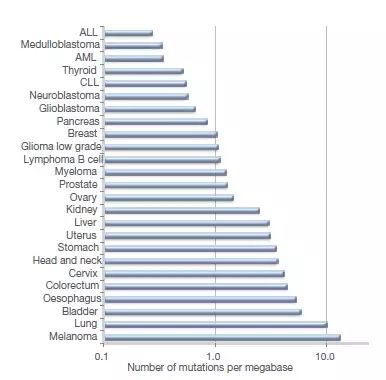
各种人类癌症中体细胞突变的发生率
癌症表位
最近大量使用新一代测序来鉴定癌症基因组,为鉴定潜在的肿瘤特异抗原谱提供了一个独特的机会。动物模型以及人类癌症的外显子组测序数据,可以预测T细胞对肿瘤特异突变所形成的新抗原的反应。人们逐步了解哪些抗原在有效免疫治疗中形成了主要目标,最终有望带来更准确的预后和治疗。
综述
Rosenberg SA. Finding suitable targets is the major obstacle
to cancer gene therapy. Cancer Gene Ther. 2014 Feb;21(2):45-7.
具有抗肿瘤活性的淋巴细胞的开发已经成为目前癌症免疫治疗研究中的一项主要工作。然而,作为目标的癌细胞表面蛋白在健康组织上仍有表达,尽管水平很低,这导致治疗存在严重毒性作用的风险。主要的障碍是如何确定癌细胞上适当的免疫目标。对于遗传改造的淋巴细胞,理想的抗原是共有的突变,它们是每种癌症类型特有的,且不出现在正常组织上。例如,黑色素瘤中的B-RAF或胰腺癌及其他癌症中的K-RAS等常见突变可能代表了细胞转移免疫治疗的理想靶点,假设适当的抗原受体能被鉴定出。淋巴细胞的基因编辑为这个基因治疗领域开辟了新的潜能。
Kvistborg P., van Buuren M.M., and Schumacher T.N. Human
cancer regression antigens. Current Opinion in Immunology 25: 284-290
细胞毒性T细胞可以识别人类肿瘤细胞表面的抗原,从而介导癌症消退。为了利用癌症治疗的潜能,挑战仍在于鉴定肿瘤抗原,它们需要满足:i)
为患者组所共有;ii) 只在肿瘤中表达;iii)
在选择性压力下抗原丢失的可能性低。随着新一代测序的发展,人们能够相对轻松地描述个体肿瘤中肿瘤特异的突变库,为预测满足这些标准的患者特异的突变抗原带来可能。
肿瘤免疫编辑
肿瘤免疫编辑是适应性和先天免疫系统控制肿瘤生长和塑造肿瘤免疫原性的过程。此过程包括三个阶段:清除(elimination)、平衡(equilibrium)和逃逸(escape)。清除,或肿瘤免疫监控,是指适应性和先天免疫分支鉴定和破坏新形成的癌细胞的过程。平衡是最长的阶段,包括防止肿瘤生长和塑造少量瘤细胞的免疫原性之间的平衡状态。在逃逸阶段,最少免疫原性的肿瘤细胞逐渐生长并扩散为可见的肿瘤。
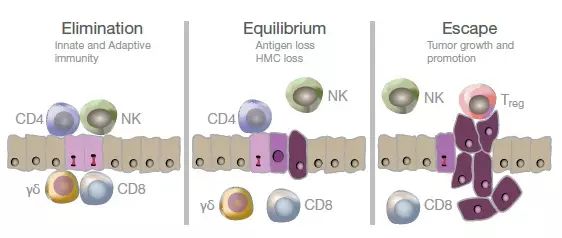
免疫编辑既防止又促进肿瘤生长。清除阶段描述了当组织中出现肿瘤时,适应性和先天免疫反应识别和清除肿瘤的过程。平衡阶段包括了防止肿瘤生长和选择不被杀死的癌细胞之间的平衡状态。这个阶段的结果是肿瘤细胞的定向选择,它们不再表达外来抗原,也不再表达MHC。逃逸阶段指的是变异的肿瘤细胞逃避免疫系统的清除机制和/或招募调节细胞来保护它们的过程。
外显子组测序让研究人员能够从实验上鉴定肿瘤表位,并具体鉴定未编辑肿瘤的表位。这已在最近一项研究中得以证明,该研究将大规模并行测序与cDNA
捕获测序(cDNA CapSeq)技术相结合,结果表明,T 细胞依赖的免疫编辑是缺乏强排斥抗原的肿瘤细胞增殖的潜在机制。
Cap-Seq
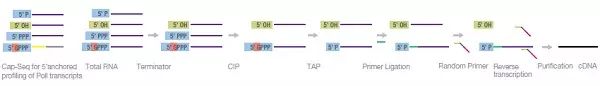
CXXC 亲和纯化测序(CAP-Seq)定位了锚定在RNA 聚合酶II 上的RNA 的5’端。在这种方法中,RNA
转录本先经过终止子、小牛肠碱性磷酸酶(CIP)处理,再经过烟草酸焦磷酸酶(TAP)处理,与接头连接,并逆转录为cDNA。cDNA
的深度测序带来了高分辨率的RNA 聚合酶II 转录本序列。






