

摘要
:
间充质干细胞(
MSCs
)是人体内参与免疫平衡、维持组织器官的稳态和功能以及组织损伤修复的一类重要成体干细胞。
MSCs
具有自我更新能力和多向分化潜能,国际干细胞协会将
MSCs
向脂肪、成骨等细胞分化的能力作为其重要的检测标准。作为骨细胞和脂肪细胞的共同来源,
MSCs
在成骨和成脂分化之间相互协调和相互竞争,并在多种调控因素作用下保持着微妙的平衡。对
MSCs
成骨、成脂分化的信号通路、调控因素进行分析,并对其分化诱导方法以及鉴定方法进行总结,以期为
MSCs
基础研究及临床应用提供参考依据。
1970
年
Friedenstei
首次利用骨髓培养出能够诱导分化为成骨细胞的成纤维样多能细胞
[
1
]
,随后
Martin
于
1981
年在鼠幼胚中分离出类似多能细胞系
[
2
]
。自此陆续有学者从人骨髓、脂肪、脐带血、羊水、胰腺、牙髓等组织分离出干细胞
[
3-6
]
。随着人多能间充质干细胞(
MSCs
)在许多生物医学领域发挥越来越重要的作用,国际细胞治疗学会对
MSCs
提出了通用标准
[
7-8
]
:首先,
MSCs
必须具有黏塑性,即
MSCs
能够在标准培养条件下,黏附生长在组织培养瓶上;其次,
MSCs
必须能够表达其特异性的表面标志物,包括阳性标志物
CD105
、
CD73
和
CD90
以及阴性标志物
CD45
、
CD34
、
CD14
、
CD11b
、
CD79a
和
HLA-DR
;再次,
MSCs
必须具有多能分化潜能,即
MSC
在体外具有向成骨、成脂以及成软骨分化的能力
[
8
]
。这一标准为
MSCs
的临床前以及临床研究提供鉴定依据。诱导成骨的因素常抑制成脂分化,而诱导成脂的因素常抑制成骨分化,因成骨分化和成脂分化相关因子之间的相互作用在
MSCs
细胞分化命运决定中发挥着重要作用,本研究对
MSCs
成骨、成脂分化的信号通路、调控因素进行分析,并对其分化诱导方法以及鉴定方法等进行总结,以期为
MSCs
基础研究及临床应用提供参考依据。
1
MSCs
成骨、成脂分化信号通路
MSCs
作为成骨细胞和脂肪细胞共同的祖细胞,在多种信号调控下,其向成骨、成脂细胞的分化处于一种平衡状态。这些调控都是通过不同的信号通路来激活转录因子进而发挥作用(图
1
),其中
BMP
、
Wnt
以及
Hippo
等信号通路在
MSCs
分化调控中发挥主要作用。
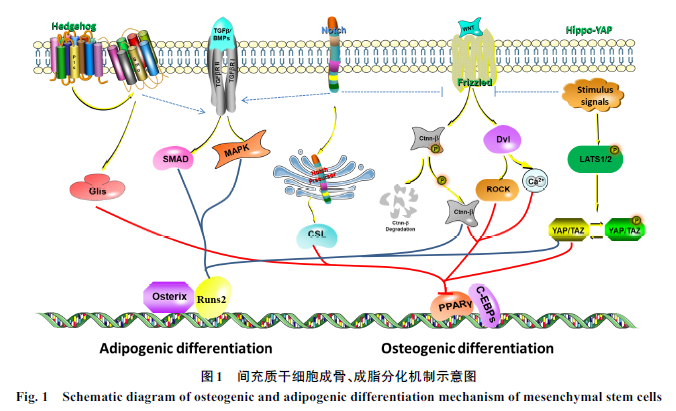
1.1
BMP
信号通路
骨形态发生蛋白(
bone morphogenetic protein
,
BMP
)是转化生长因子
-β
(
TGF-β
)超家族中的多功能生长因子
[
9
]
。
BMP
信号通路主要是通过
Smad
和
MAPK
途径触发细胞反应
[
10
]
。
BMP
信号通路通过与
BMP-Ⅰ
和
BMP-Ⅱ
受体结合进而激活
BMP
信号,磷酸化的
Smad1/5/8
与
Smad 4
形成复合物后进入细胞核内并与转录因子结合,以细胞类型特异的方式调节特异性基因的转录
[
11-12
]
。在
BMP
信号激活下,由
Smad
和
MAPK
途径调控
Runx2/Cbfa1
和
PPARγ
基因的表达,而特异性转录因子表达水平的改变则直接影响
MSCs
的成骨、成脂分化能力
[
13
]
。因此
BMP
信号通路在
MSCs
成骨、成脂分化过程中起到双重的调控作用。
1.2
Wnt
信号通路
Wnt
是分泌性糖蛋白家族。
Wnt
信号通路主要是通过典型的
Wnt/βcatenin
和非典型的
Wnt
-
cGMP/Ca
2+
信号通路来调节
MSCs
向成骨、成脂细胞的分化
[
14
]
。
Wnt
与跨膜受体
FZD
和核心受体
IRP5/6
结合通过抑制
Axin/GSK3/APC
复合物使得
βcatenin
在细胞核内稳定积累
[
15
]
。
βcatenin
与淋巴增强因子结合因子
/T
细胞因子结合能够抑制
PPARγ
基因的表达来抗
MSCs
向成脂细胞分化;通过上调
Runx2/Cbfa1
基因的表达来促进
MSCs
向成骨细胞的分化
[
16
]
。因此
Wnt
信号通路在
MSCs
分化过程中起到了促成骨细胞和抗脂肪细胞生成的重要作用。
1.3
Hippo
信号通路
Hippo
信号由衔接蛋白和抑制激酶组成,并且是果蝇和哺乳动物之间高度保守的信号通路
[
17-19
]
。经典的
Hippo
信号通路是由
MST1/2
和
LATS1/2
激酶与
SAV1
和
MOB1
磷酸化并抑制
YAP
和
TAZ
发挥功能的
[
20
]
。当
LATS1/2
的
PY
基序与
YAP
和
TAZ
的
WW
结构域相互作用时,使得
YAP/TAZ
磷酸化并定位于细胞质内,同时
β-TRCP
依赖性蛋白酶降解;
YAP/TAZ
去磷酸化后转移至细胞核内,作为其他转录因子的转录辅激活剂调控细胞的成骨、成脂分化
[
20-22
]
。
Hippo
信号通路通过
TAZ
的
WW
结构域与
RUNX2
的
PY
基序结合上调
RUNX2
、
ALP
以及
Osterix
的表达,从而诱导
MSCs
向成骨细胞分化
[
23
]
。相较于
TAZ
而言,
YAP
的作用更为复杂,不但可以作为
RUNX2
的阻遏物,还能够在
YAP
过表达时促进
MSCs
的成骨分化
[
24-25
]
。在成脂分化过程中,
Hippo
信号通路在
TAZ
的
WW
结构域与
PPARγ
的
PY
基序结合后,通过抑制
PPARγ
的转录活性从而抑制成脂分化
[
26
]
。而
YAP
则通过诱导
Wnt
拮抗剂来减少成骨信号,进而促进
MSCs
的成脂分化
[
27
]
。
1.4
其他相关信号通路
除上述
BMP
、
Wnt
和
Hippo
信号通路外,还有一些参与
MSCs
分化调控的信号通路。如
Notch
信号通路可通过阻断
PPARγ
和
C/EBPα
的表达来抑制
MSCs
向成脂细胞的分化
[
28
]
。除此之外,
Notch
信号通路还可以通过抑制
Wnt/βcatenin
信号通路来降低
MSCs
向成骨细胞的分化
[
29
]
。
Hedgehogs
信号通路通过抑制
PPARγ
和
C/EBPα
的表达及脂质积累来阻止
MSCs
向成脂细胞分化
[
30
]
。同时
Hedgehogs
信号通路通过与
BMP
信号通路相互作用来调控
Smad
进而促进
MSCs
向成骨细胞分化
[
31
]
。其他的信号分子如
FGF
、
IGF
等也参与
MSCs
的分化调控
[
32
]
。值得注意的是这些信号通路在
MSCs
分化过程中并不是单独地发挥作用,而是在特定条件下相互作用共同调控
MSCs
的成骨、成脂分化过程。
2
MSCs
成骨、成脂分化调控
转录因子是各种信号通路的直接或间接靶点,而
RUNX2
、
PPARγ
、
YAP/TAZ
等多个转录因子在
MSCs
向成骨细胞和脂肪细胞的分化过程中起着重要的作用。此外,包括
microRNA
、物理刺激等因素也对
MSCs
的成骨及成脂分化具有重要调控作用。
2.1
RUNX2
Runx2
作为最早的成骨标志物之一,在新骨形成过程中发挥着控制细胞增殖和分化的重要作用
[
33
]
。在成骨细胞分化过程中,目前研究的大多数信号通路都是以
Runx2
为靶点,通过上调
Runx2
促进
MSCs
向未成熟成骨细胞分化,同时抑制其向脂肪细胞的分化
[
34
]
。
Runx2
由
PI
和
PII
启动子启动表达
[
35
]
,并且弱表达于未分化的间充质细胞中,表达上调于前成骨细胞中,在未成熟成骨细胞中达到最高表达水平,而在成熟成骨细胞中表达下调
[
36
]
。
Runx2
与
CBFB
形成的异源二聚体能够增强结合
DNA
的能力和蛋白质的稳定性
[
37
]
。最近有研究表明,蛋白质翻译后修饰能够调节
Runx2
进而调控
MSCs
向成骨、成脂细胞的分化
[
38
]
。
2.2
PPARγ
PPARγ
是促进
MSCs
成脂分化的关键转录因子,其不仅能够调控脂肪生成,同时具有抗骨母细胞生成的作用
[
39
]
。通常所有的前脂肪信号通路都与
PPARγ
相关,并且过表达
PPARγ
能够使成纤维母细胞有效分化为成熟脂肪细胞,而敲除
PPARγ
的研究表明
PPARγ
是体内外脂肪生成所必需的
[
40
]
。此外,
C/EBP
能够促进前脂肪细胞的成脂分化
[
41
]
。磷酸化的
C/EBP
诱导
C/EBPβ
激活
PPARγ
和
C/EBPα
转录表达
[
41
]
。而
PPARγ
和
C/EBPα
在整个成脂分化过程中都保持较高水平的表达,并在脂肪细胞的整个生命过程中持续表达
[
9
]
。
2.3
YAP/TAZ
14-3-3
结合蛋白
TAZ
是
YAP
的一个副同源物,是具有
PDZ
结合基序的转录辅激活因子,能够抑制
PPARγ
依赖性基因转录,并且辅激活
Runx2
依赖性基因转录
[
42-45
]
。小鼠的
TAZ SiRNA
转染
C2C12
细胞的研究表明
TAZ
调控
Runx2
刺激的骨钙素基因的表达是成骨细胞分化的重要内源性调节因子;同时也证明了
TAZ
是
PPARγ
诱导基因表达的转录阻遏物,并且是
MSCs
成脂分化程序的内源性抑制剂
[
26
]
。然而
YAP/TAZ
并不是
Hippo
信号通路调节的唯一决定因素,在坚硬的基质上,当
YAP/TAZ
消耗殆尽时
MSCs
成骨分化受到抑制,而在相同基质上敲除
YAP/TAZ
时则促进
MSCs
的成脂分化
[
25
]
。除此之外,
YAP/TAZ
还能够与其他的信号通路如
Wnt
、
TGF
、
TNF-α
、
Eph-Ephrin
等相互作用来共同调控
MSCs
的成骨、成脂分化过程
[
46-50
]
。
2.4
其他因素
除上述转录因子之外,成纤维细胞生长因子(
FGFs
)、
miRNAs
和物理因素也能够影响
MSCs
的成骨、成脂分化。
FGFs
是细胞增殖、分化的有效调节因子,而不同
FGF
成员对
MSCs
分化具有不同的调控作用。
FGF7
可通过激活
ERK-Runx2
信号通路刺激干细胞向成骨细胞分化
[
51
]
,而
bFGF
则可通过上调
PPARγ
的水平从而促进成脂分化
[
52
]
。
miRNA
在
MSCs
分化方向中也发挥重要调控作用,不同的
miRNAs
参与
MSCs
分化调节的作用不同,例如
miR204
、
miR211
、
miR637
过表达能够在促进成脂分化的同时抑制成骨细胞的分化
[
53-54
]
。
miR21
不仅能够促进人脐血干细胞的成骨分化,而且可以促进人脂肪来源的干细胞的成脂分化
[
55
]
。
miR138
、
miR335
抑制
MSCs
的成骨、成脂分化
[
56-57
]
。此外,机械信号在
MSCs
的谱系分化中也发挥重要的作用。例如振荡流体流动(
OFF
)能够通过上调
Runx2
、
PPARγ
等的表达来调控
MSCs
的成骨、成脂分化
[
58
]
;动态压迫(
DC
)能够增加骨髓间充质干细胞(
BMSCs
)中成骨基因的表达进而促进成骨分化
[
59-60
]
;而拉伸应变则能够促进
BMP2
、成骨基因的表达以及钙沉积从而促使
MSCs
向成骨细胞分化
[
61-63
]
。因此,机械信号作为
MSCs
分化的关键调节因素,能够很好地阐明各种物理因素对
MSCs
成骨、成脂分化的调控,进而可以更好地服务于再生医学相关的研究领域。
3
MSCs
成骨、成脂的分化诱导及验证
3.1
MSCs
成骨分化诱导方法
MSCs
向成骨细胞分化过程中转录因子
Runx2
的表达进一步促进
ALP
、
Osterix
、
Col1a1
、
OPN
、
BSP
、
OCN
的表达。这些表达的连续上调将促进成骨细胞成熟和矿化细胞外基质的沉积
[
64-66
]
。在体外培养体系中常用的
MSCs
成骨分化诱导补充剂为
100 nmol/L
地塞米松(
DEX
)、
50 mmol/L
抗坏血酸
-2-
磷酸(
As-2-P
)和
10 mmol/L β-
甘油磷酸(
β-GP
)
[
67
]
。
As-2-P
不仅可以促进胶原细胞外基质的形成和成骨细胞相关蛋白的合成,而且能够上调碱性磷酸酶和骨钙素
mRNA
的表达从而促进成骨分化
[
68
]
。
β-GP
是蛋白磷酸酶抑制剂,在基质矿化研究中充当磷酸基团供体,有助于成骨细胞
Ca
2+
的沉积,促进矿化结节的形成
[
69-70
]
。
DEX
是广泛应用的糖皮质激素,在体外诱导成骨分化可提高碱性磷酸酶(
ALP
)活性、骨钙素(
OC
)和骨唾液蛋白(
BSP
)的表达水平
[
71
]
。研究表明,
1 μmol/L
的
DEX
不仅抑制
MSCs
的成骨分化,促进成脂分化。而且能够降低细胞活性,提高活性氧水平,促进细胞凋亡
[
72
]
。
近年来的研究表明除化学药物外,细胞因子、中药及提取物和物理因素等均影响成骨细胞的分化。例如
2 μmol/L
锶能够促进成骨细胞分化和矿化形成,并且抑制脂肪细胞的过度生成
[
73
]
。
H
2
S
通过
Wnt
信号通路来保护成骨细胞免受
H
2
O
2
或
DEX
诱导的细胞损伤
[
74
]
。生长分化因子
5
(
GDF-5
)是骨组织工程的一个显著因素,而
DEX/GDF-5
则能增强
ALP
的活性和钙沉积
[
75
]
。类胰岛素一号生长因子(
IGF-1
)不仅能够促进骨形态发生蛋白
9
(
BMP9
)诱导的成骨分化,同时通过
PI3K/AKT
途径降低高浓度
DEX
对
BMP9
诱导的成骨分化的抑制作用
[
76
]
。紫草在体外能够诱导
BMSCs
分化为成骨细胞并具有促进其成骨的作用
[
77
]
。低浓度黄芩苷通过调节
OPG
和
RANKL
蛋白的表达来参与骨重塑过程
[
78
]
。
LDI-glycerol-AA-GP-DEX
支架、
HBMSCs laden-LPN-GelMA
支架等均能够支持成骨分化,促进矿化结节的形成
[
79-80
]
。对
MSCs
成骨分化影响因素的深入研究将会为防治糖皮质激素引起的骨质疏松症提供新的方向。
3.2
MSCs
成骨分化验证方法
MSCs
成骨分化的鉴定方法主要包括染色法、成骨特异性转录因子表达以及成骨蛋白质表达的检测等。茜素红、
Von Kossa
是常见的成骨染色方法
[
81
]
。茜素红染色法主要是基于茜素磺酸钠能与
Ca
2+
发生显色反应,产生深红色的带色化合物
[
82
]
。而
Von Kossa
染色法主要是利用硝酸银与钙盐发生反应在强光或紫外下生成金属银,使得钙化组织呈黑色或褐色颗粒
[
83
]
。也可以应用实时荧光定量
PCR
(



















