免疫相关内分泌疾病
甲状腺疾病
虽然甲状腺疾病常发生于接受细胞因子IL-2和Ⅰ型IFN等免疫治疗的患者,但是使用ICPi治疗的患者其甲状腺疾病的发生率也在明显升高。甲状腺功能亢进和减退均有报道,其中甲状腺功能减退更为常见。甲状腺功能亢进通常是暂时性的,并且可能进展为甲状腺功能减退。目前,关于ICPi治疗后甲状腺功能紊乱的发病机理尚不明确。其可能的原因是由T细胞而非B细胞自身免疫介导。最近,Keynote-001研究纳入了51例非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者,pembrolizumab单抗治疗后,测定促甲状腺激素(thyroid-stimulating hormone,TSH)、游离三碘甲状腺氨酸和游离甲状腺素(FT3,FT4)和抗甲状腺抗体[28]。甲状腺功能障碍需要甲状腺激素替代治疗的发生率为21%(其中80%的患者可以检测到抗甲状腺抗体),而8%的患者未发现甲状腺功能障碍。这些结果说明自身免疫性甲状腺疾病和甲状腺功能障碍与免疫相关不良事件的发病机理类似。
甲状腺功能障碍在抗PD-1/PD-L1单抗治疗或者联合抗CTLA-4单抗药物治疗和阻断PD-1/PD-L1药物治疗时发生率最高。有研究报道,ipilimumab(3 mg/kg)治疗中甲状腺功能障碍发生率为1%~5%[1,2],其发生率随着ipilimumab单抗治疗剂量的增加(10 mg/kg)而增加(高达10%)[4]。
据报道,抗PD-1(pembrolizumab或者nivolumab)或抗PD-L1(atezolizumab)单抗治疗时,甲状腺功能紊乱发生率为5%~10%(且与肿瘤类型无关)[6,10,12]。免疫联合治疗(ipilimumab 3 mg/kg联合nivolumab 1 mg/kg)使甲状腺疾病发生率增加至20%[2]。这些不良事件分级很少超过2级。大多数患者甲状腺功能紊乱是通过血液常规检查(TSH和FT4)发现;这些患者每次用药前或者至少每月需要检查一次(每2周用药一次的患者)甲状腺功能。
处理措施:
即使是亚临床甲状腺功能减退,但是有疲劳或者其他甲状腺功能减退相关主诉[Ⅳ-Ⅴ,B]的患者需要考虑使用甲状腺激素替代治疗。有症状特别是甲亢的患者,需要使用β-受体阻滞剂(心得安或阿替洛尔)[Ⅳ-Ⅴ,B]。需要使用卡比马唑或者类固醇激素治疗的情况罕见。这些患者需中断ICPi的治疗,直至症状消失。激素替代疗法(hormone replacement therapy,HRT)需长期维持(见图5)。
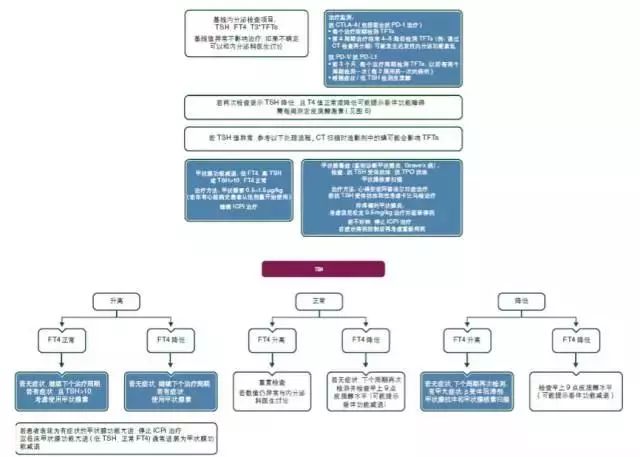
图5. ICPi治疗监测与处理:甲状腺功能。
CT:计算机断层扫描;CTLA-4:细胞毒性T淋巴细胞相关抗原4; FT4:游离甲状腺素;ICPi:免疫检查点抑制剂;PD-1:程序性死亡受体-1;PD-L1:程序性死亡受体配体1;T3:三碘甲状腺氨酸;T4:甲状腺素;TFTs:甲状腺功能检测;TPO:甲状腺过氧化物酶;TSH:促甲状腺激素。
垂体炎
垂体炎作为一种脑垂体前叶炎症,在未使用抗CTLA-4药物治疗的患者中极为罕见。现在,研究报道的ipilimumab 3mg/kg、ipilimumab 10 mg/kg 以及ipilimumab联合nivolumab治疗中的垂体炎发生率分别为1%、16%和8%[1,2,4]。
抗PD-1和抗PD-L1治疗的患者中垂体炎发生率极低[29]。
抗CTLA-4治疗诱导垂体炎的病因尚不清楚。最近,一项小鼠模型实验表明,脑垂体分泌促甲状腺激素和催乳素的细胞中有低水平异常CTLA-4的RNA和蛋白表达[30]。但到目前为止,还无法解释这种现象产生的原因。抗CTLA-4治疗可以导致动物脑垂体中单核细胞浸润、抗垂体抗体产生、补体级联系统的激活,导致与典型人类垂体炎中观察到的现象相似的腺体炎症。然而,CTLA-4是否会在人体内异常表达仍未可知。
患者可能有不同的主诉。对于头痛和视觉障碍需要立即评估,需要注意鉴别脑转移、软脑膜疾病、脑血管疾病和垂体炎。脑部磁共振检查主要表现为肿胀或扩大的脑垂体。若血中促甲状腺激素、促肾上腺皮质激素和/或卵泡刺激素/黄体生成素比值(FSH/LH)同时降低,提示最可能的诊断为脑垂体炎。患者还会表现出甲状腺功能减退和/或肾上腺皮质功能减退,还有可能有低睾酮的相关主诉。
处理措施
一旦确诊为2级或以上脑垂体炎,需立即中断ICPi治疗,并采取HRT[Ⅴ,B]。有头痛和其他神经系统症状的患者,需要使用大剂量类固醇激素治疗。然而,大剂量的类固醇激素治疗不能纠正CTLA-4治疗导致的激素缺乏。大多数患者可以继续使用ICPi,但是需要长期HRT(见图6)。
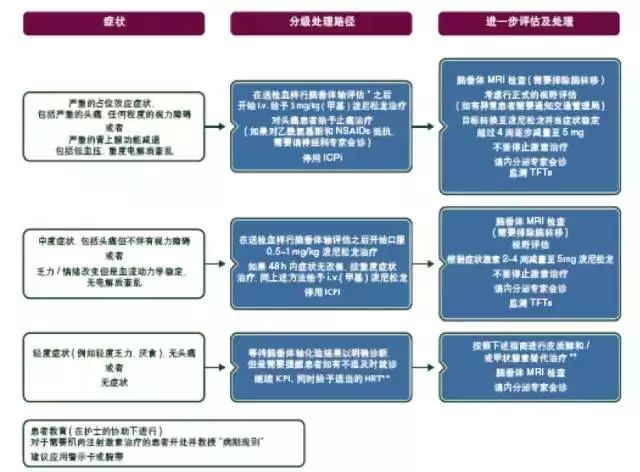
图6. ICPi相关毒性:垂体炎的处理。
*垂体轴血液学化验:9 am皮质醇(如果患者不适且治疗不能推迟时可随意选择时间)、ACTH、TSH/FT4、LH、FSH、绝经前的雌二醇、男性睾酮、IGF-1、催乳素。在垂体功能低下患者中很少需要盐皮质激素替代治疗。
**皮质醇和甲状腺激素的初始替代治疗建议:
• 如果9 am皮质醇<250或随机皮质醇<150同时症状轻微;
- 给予氢化可的松 20/10/10 mg
- 如果甲状腺功能正常,起始1~2周监测一次(通常在给予甲状腺素治疗前的1周开始给予皮质醇替代治疗)
• 如果TSH进行性下降+/-低FT4
- 根据症状考虑给予甲状腺素替代治疗(建议0.5~1.5 ug/kg)+/-每周复查9am皮质醇。
- 参考甲状腺指南寻找关于异常TSH/T4解释的更多信息。
ACTH,促肾上腺皮质激素;FSH,促卵泡素;FT4;游离甲状腺素;HRT,激素替代治疗;ICPi,免疫检查点抑制剂;IGF-1,胰岛素样生长因子-1; i.v.,静脉注射;LH,黄体生成素;MRI,核磁共振影像;NSAIDs,非甾体抗炎药;od,每天一次;TSH,促甲状腺素;TFTs,甲状腺功能检查。
I型糖尿病
ICPi治疗引起原发性糖尿病的概率很低(<1%)。用抗PD-1和PD-L1(或免疫联合治疗)治疗引起的糖尿病比ipilimumab治疗更常见[31]。PD-1通路在自身免疫性糖尿病中也有一定作用,因为在小鼠模型中,阻断PD-1/PD-L1 轴,通过特异性CD8 T细胞介导,导致1型糖尿病的发生。然而,随着更多患者采用抗PD-1和抗PD-L1药物治疗,Ⅰ型糖尿病的发生率可能会上升。
对于ICPi治疗的患者,为及时发现糖尿病(Ⅰ/Ⅱ型),建议常规检测血糖水平。即使是Ⅱ型糖尿病患者也可能会发生不常见,但是危及生命的酮症酸中毒,需根据指南标准及时处理[Ⅰ,A]。大剂量类固醇激素治疗能否阻止胰岛β细胞的全部损失尚不明确。类固醇激素很可能对这些患者糖尿病的控制产生不良影响。
为了鉴别Ⅰ型和Ⅱ型糖尿病,需要测定C肽、谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)抗体和胰岛细胞抗体(islet cell Abs)。
一旦患者血糖经胰岛素治疗控制后,可考虑重新开始ICPi治疗。
免疫相关肝脏毒性
发生率
接受常规剂量ipilimumab、nivolumab和pembrolizumab单药治疗的患者肝炎发生率为5%~10%(其中3级反应1%~2%)。ipilimumab 3 mg/kg和nivolumab 1 mg/kg联合治疗的患者肝炎发生率为25%~30%(其中3级反应15%)。
诊断:所有接受ICPi治疗的患者在每个治疗周期前,都需要检测血清转氨酶和胆红素水平以评估是否有肝炎症状或体征。肝炎通常是无症状的,常在血常规检查中被发现。如果出现肝炎,尤其是病毒性肝炎需排除疾病相关因素、辅助药物(包括酒精)和感染因素。然而,如果没有明显的致病因素,必须的保肝治疗无需等到血清学结果即可开始。
为了与严重的肝炎反应鉴别,可考虑行肝组织活检[15]。许多报道表明,小叶性肝炎和自身免疫性肝炎很难区分[32,33];多数病例是全小叶型,而炎症可能局限在3段。此外,肝窦组织细胞增生症和中央静脉炎对诊断ipilimumab相关炎症有帮助。极少数病例表现为汇管区感染、胆管炎或难以与非酒精性脂肪性肝炎相鉴别的改变。
处理措施:对于转氨酶或总胆红素中度(2级)升高的患者,需停止使用ICPi,并且每周检测两次血清转氨酶和胆红素水平。2级水平升高持续超过1~2周,在排除其他致病因素后,需使用皮质类固醇激素治疗,剂量为1 mg/kg/d(甲基)泼尼松龙或其他等效药物。一旦改善,皮质类固醇激素逐渐减量后,可继续使用IPCi。如果使用皮质类固醇激素后情况恶化或没有改善,增加皮质类固醇激素剂量至2 mg/kg/d(甲基)泼尼松龙或其他等效药物,并且永久停用IPCi[Ⅳ-Ⅴ,B]。对于转氨酶或总胆红素3级或4级升高的患者,永久停用ICPi,并且使用皮质类固醇激素治疗,初始剂量1~2 mg/kg/d(甲基)泼尼松龙或其他等效药物。如果2~3 d内患者对皮质类固醇激素无反应,应加用吗替麦考酚酯(mycophenolate mofetil,MMF)1000 mg,每天两次[Ⅳ-Ⅴ,B] [34]。对于皮质类固醇激素和麦考酚酯难治病例,可以请肝脏科医生会诊并考虑肝组织活检(见上文)[Ⅳ-Ⅴ,B]。三线的免疫抑制治疗不好定义,但是也有治疗成功的案例,1例ipilimumab引起的对激素及麦考酚酯抵抗的肝炎患者应用抗胸腺细胞免疫球蛋白(anti-thymocyte globulin,ATG)治疗成功。另一种三线免疫抑制剂药物是他克莫司。不推荐英夫利西单抗用于免疫相关肝炎的治疗(见图7)。
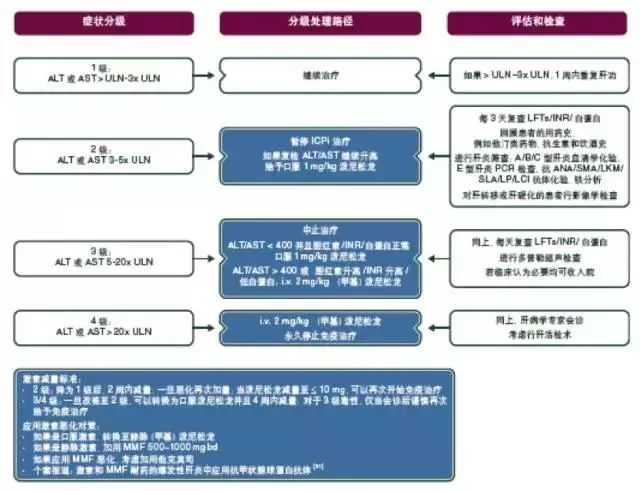
图7. ICPi相关毒性:肝炎的处理。
ALT,谷丙转氨酶;ANA,抗核抗体;AST,谷草转氨酶;bd,一天两次;ICPi,免疫检查点抑制剂;INR,凝血酶原时间国际标准化比值;i.v. 静脉注射;LCI,肺清除指数;LFTs,肝功能检查;LKM,肝肾微粒体;MMF,吗替麦考酚酯;PCR,聚合酶链反应;SLA/LP,可溶性肝抗原/肝胰抗体;SMA,平滑肌自身抗体;ULN,正常值上限;US,超声。
在接受适当治疗后,肝炎通常会在4~6周内痊愈,而对于未治愈的病例,需要重新考虑其他的病因,必要时重复初始诊断流程,特别要考虑到同时服用其他肝毒性药物(包括草药和非处方药)和巨细胞病毒(cytomegalovirus,CMV)再激活的可能。
胃肠道毒性
癌症免疫治疗中抗CTLA4单抗治疗引起的胃肠道毒性已有详细描述。但是在抗PD-1和抗PDL-1单抗以及抗CTLA4和抗PD-1单抗联合治疗中描述较少。
抗CTLA4单抗介导的胃肠道毒性
发生率:有27%~54%接受抗CTLA4单抗治疗的癌症患者发生了腹泻[35]。在大多数报道中,大约有1/3的患者出现腹泻,而结肠炎的发生率为8%~22%[35]。胃肠道毒性是抗CTLA4单抗治疗相关irAE中最常见和最严重(3级或更高)的毒性反应[18]。通常是导致抗CTLA4单抗治疗中止的首要原因[18]。
在接受ipillimumab治疗的黑色素瘤患者中,结肠穿孔发生率为1%~1.5%[35-37],在肾细胞癌患者中达6.6%[36],1.1%患者死于ipillimumab引起的小肠结肠炎相关并发症[4]。
有报道显示,应用非甾体抗炎药(non-steroidal anti-inflammatory drug,NSAID)与ipillimumab介导的小肠结肠炎发生风险增加有关[38]。很少有研究报道免疫介导结肠炎在克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)患者中的发生风险。6例伴有CD或UC的患者中,2例出现ipillimumab介导的结肠炎或CD或UC复发[39]。
诊断:在1~10次抗CTLA4单抗输注治疗中,胃肠道症状可以发生于任何时间[36]。小肠结肠炎也可能在最后一剂ipillimumab治疗后数月出现[40]。ipillimumab的半衰期是2周,但在药物清除后生物学效应仍可持续很长时间。
抗CTLA4单抗治疗介导的小肠结肠炎最常见的症状是腹泻[1–4]。在最新的报道中,92%的抗CTLA4单抗治疗介导的小肠结肠炎患者都有腹泻[38]。其他的症状包括腹痛、便血、体重减轻、发热和呕吐[38]。口腔溃疡、肛门病变(肛瘘、脓肿、肛裂)和肠外表现(例如关节痛、内分泌紊乱、皮肤病变、肝炎、肾炎、心包炎和胰腺炎)也可能与抗CTLA4治疗介导的小肠结肠炎有关[38]。在抗CTLA4单抗介导的小肠结肠炎中观察到的主要异常表现有贫血、血清C反应蛋白升高和低白蛋白血症[38]。有1项研究发现,在ipillimumab引起的小肠结肠炎患者的粪便中钙卫蛋白水平升高[38],但是其他的报道未能发现粪便中钙卫蛋白水平与胃肠道毒性相关[41]。在少数ipillimumab引起的小肠结肠炎患者的血清中发现对抗肠道菌群的抗体和抗中性粒细胞胞质抗体[41]。
抗CTLA4单抗介导的小肠结肠炎主要的鉴别诊断是胃肠道感染和肿瘤相关症状。每1例接受抗CTLA4单抗治疗出现明显腹泻的患者,需要行粪便细菌性肠道病原菌和艰难梭菌毒素分析。此外,胃肠道转移在扩散的黑色素瘤中并非不常见,但在肺癌中情况不明,因此也需要鉴别。抗CTLA4介导的小肠结肠炎可以通过可弯曲乙状结肠镜或结肠镜活检确诊。内镜下抗CTLA4结肠炎病变表现为红斑/血管形态的缺失、糜烂和溃疡形成。大多数病例累及乙状结肠和直肠。因此,可弯曲乙状结肠镜检查通常足以诊断抗CTLA4介导的小肠结肠炎[38]。然而,镜下的结肠病变通常比较广泛,在2/3的病例中可累及乙状结肠的近端。在一半的患者中可以观察到不连续的内镜下病变[38]。组织学图像通常不同于炎症性肠病(inflammatory bowel disease,IBD)的表现。在大多数病例中,表现为急性结肠炎(中性粒细胞和嗜酸性粒细胞浸润),或者是弥漫性或局灶性片状隐窝脓肿。某些病例中,也有报道表现为慢性IBD特征,例如肉芽肿、基底部浆细胞增多和片状病变(萎缩、扭曲、分枝和发芽)[38]。上消化道症状(吞咽困难和上腹痛)和内镜下病变(食管溃疡、胃炎和十二指肠炎)也有报道[35, 38]。大约有一半的抗CTLA4介导的小肠结肠炎患者伴有胃部和十二指肠的慢性、轻度、片状炎症(腺窝扭曲、局灶性和异质性绒毛缩短、固有层嗜酸性和单核炎症细胞增多)[38]。
分级和风险评估: 依据美国国家癌症研究所的CTCAE(第4版)评估严重程度。严重的腹泻指3或4级腹泻以及1或2级腹泻伴有脱水、发热、心动过速或便血。对于严重腹泻或持续的2级腹泻患者推荐行可弯曲乙状结肠镜或结肠镜检查。
处理措施: 有两项随机试验试图通过口服布地奈德防止ipillimumab引起的小肠结肠炎,但未能发现任何获益 [41, 42]。抗CTLA4治疗出现腹泻的患者需要进行的检查项目包括全血细胞计数、血清电解质、粪便肠道病原菌和艰难梭菌毒素分析(见图8)。不伴有严重腹泻的患者必要时接受抗腹泻治疗、补液及补充电解质治疗[IV–V, B] [35]。可继续应用抗CTLA4治疗。伴有持续的2级腹泻或严重腹泻者(3/4级腹泻,伴有上述报警症状的1/2级腹泻),应该停用抗CTLA4治疗,同时接受全身糖皮质激素治疗(每天静脉注射1~2 mg/kg)[IV–V, B]。静脉糖皮质激素治疗3~5 d内有效的患者,可以转为口服激素治疗,并在8~12周内逐步减量[35]。静脉糖皮质激素3~5 d内无效的患者,若无禁忌证,应该转换为英夫利西单抗治疗[IV–V, B](见图8)。总体上,有1/3~2/3的患者对大剂量的静脉激素无反应,或在激素减量过程中出现复发需要增加糖皮质激素剂量。这些患者需要接受英夫利西单抗治疗,通常可以取得很好的疗效。通常单剂英夫利西单抗(5 mg/kg)已足够[18, 35, 36, 38]。某些患者可能在第一次治疗后两周,需要第二剂英夫利西单抗。















