
电荷转换纳米颗粒(NPs)可深入穿透肿瘤,但传统的电荷转换策略具有局限性,包括肿瘤微环境中的低选择性和缓慢、不一致的转化率。因此,韩国首尔国立大学Dae-Duk Kim、Jae-Young Lee合成了一种七甲川菁两性离子近红外环糊精衍生物,并与二茂铁络合,开发了一种多功能纳米疗法。本研究中的NPs显示出增强的肿瘤靶向能力,使直肠肿瘤的高度特异性成像成为可能,肿瘤-直肠信号比高达7.8。在880 nm的近红外激光照射下,NPs的两性离子表面电荷在肿瘤内迅速转化为阳离子电荷,通过胞吞作用促进NPs的肿瘤穿透。穿透后,使用660 nm激光开始光动力学/化学动力学治疗。NPs根除临床相关大小的异位肿瘤(约250 mm3)和原位直肠肿瘤,显示出了作为靶向直肠癌的治疗纳米平台的潜力。
相关研究成果以“Photobleaching-mediated charge-convertible cyclodextrin nanoparticles achieve deep tumour penetration for rectal cancer theranostics”为题于2024年8月21日发表在《Nature Nanotechnology》。
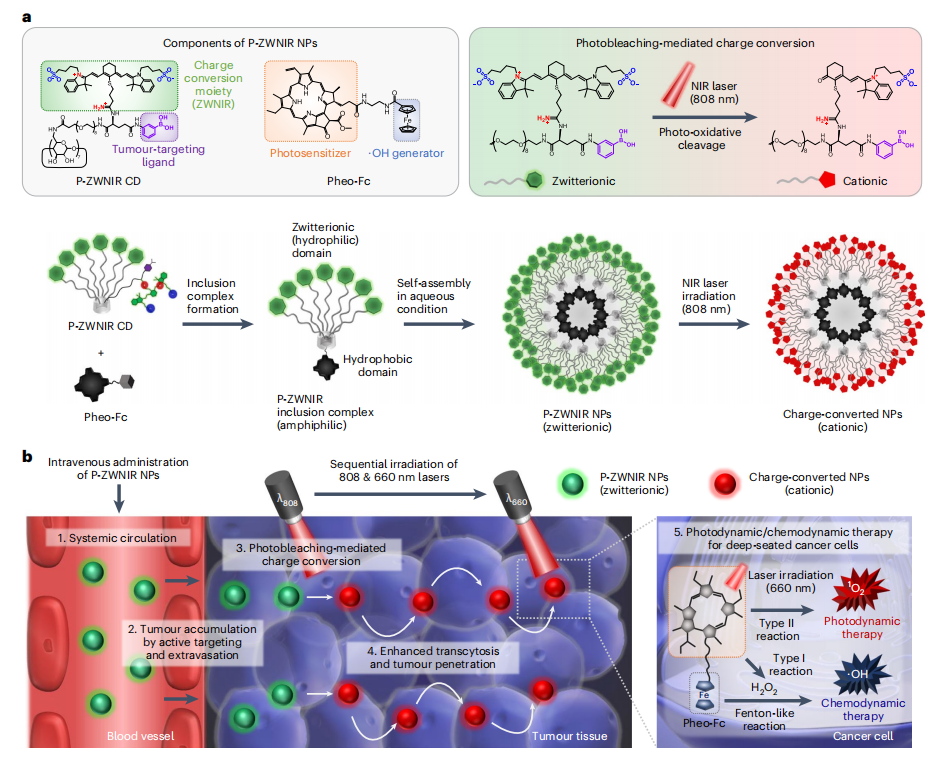
图1 用于肿瘤靶向和增强穿透的P-ZWNIR NPs的设计
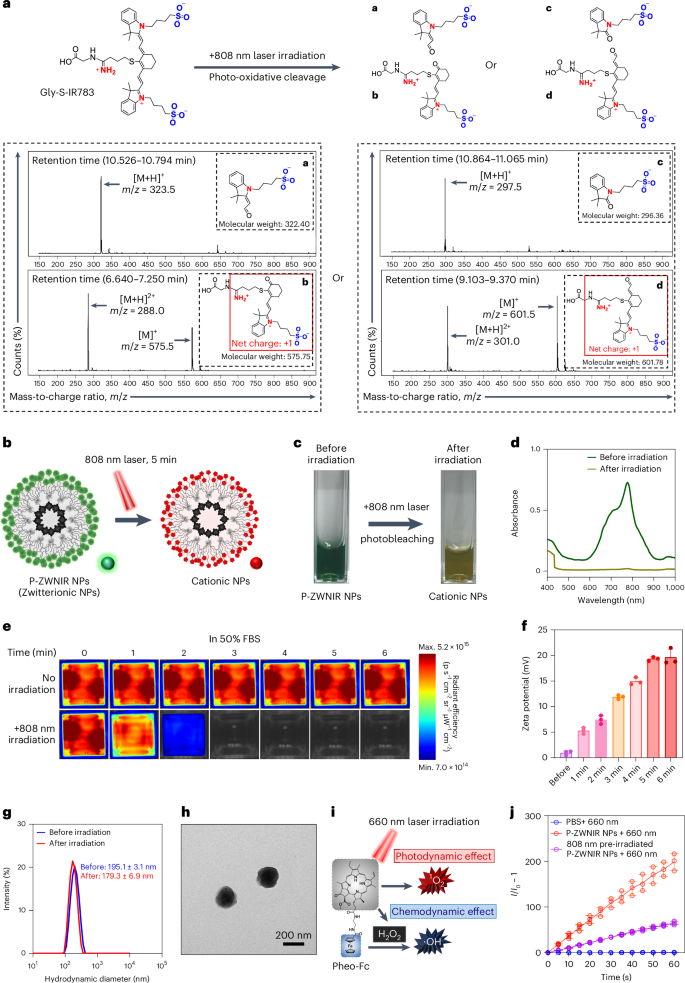
图2 P-ZWNIR NPs的表征
本研究利用β-环糊精(CD)衍生物和光敏剂之间形成的包涵体配合物构建了P-ZWNIR NPs;NIR荧光团和肿瘤靶向部分共价附着在CD核心上,从而形成P-ZWNIR CD;P-ZWNIR NPs的外部ZWNIR结构在NIR暴露时由于氧化裂解而发生不对称降解,两性离子P-ZWNIR NPs在808 nm激光照射后可以转化为带正电荷的NPs(图1a)。如图1b所示,静脉注射P-ZWNIR NPs时:(1)它们以两性离子的形式在血液中循环;(2)通过外渗和主动靶向在肿瘤中逐步积累。在808 nm激光暴露于肿瘤区域时:(3)肿瘤中的NPs发生电荷转化为阳离子NPs;(4)通过胞吞作用增强肿瘤的穿透能力。在随后的660 nm激光照射下,(5)光动力疗法和化学动力疗法的协同效应可能会增强抗癌效果。
激光照射诱导NIR荧光团Gly-S-IR783的不对称降解,导致酮和醛片段的两种不同组合(a + b或 c + d)(图2a)。在相同照射条件下,评价P-ZWNIR NPs的光漂白特性(图2b)。NIR激光将绿色的P-ZWNIR NPs漂白成深黄色的悬浮液,其光吸收减弱(图2c、d)。生理相关介质中的P-ZWNIR NPs在808 nm照射下的NIR荧光减弱,90%的荧光在4 min内发生光漂白,表明P-ZWNIR NPs具有快速光漂白特性(图2e)。P-ZWNIR NPs的zeta电位在NIR激光照射下逐渐增加,并在5 min后趋于稳定,表明完成光漂白介导的电荷转换(图2f)。动态光散射(DLS)分析显示,P-ZWNIR NPs和阳离子NPs(光漂白后的P-ZWNIR NPs)表现出相似的尺寸分布轮廓(图2g)。透射电子显微镜(TEM)图像也显示相应的颗粒尺寸(图2h)。接下来,本研究评估了Pheo-Fc的光动力学和化学动力学活性(图2i)。利用DCFH作为探针,评估活性氧(ROS)的生成,结果显示与808 nm预照射的P-ZWNIR NPs相比,660nm照射下的P-ZWNIR NPs表现出更高的ROS生成(图2j)。
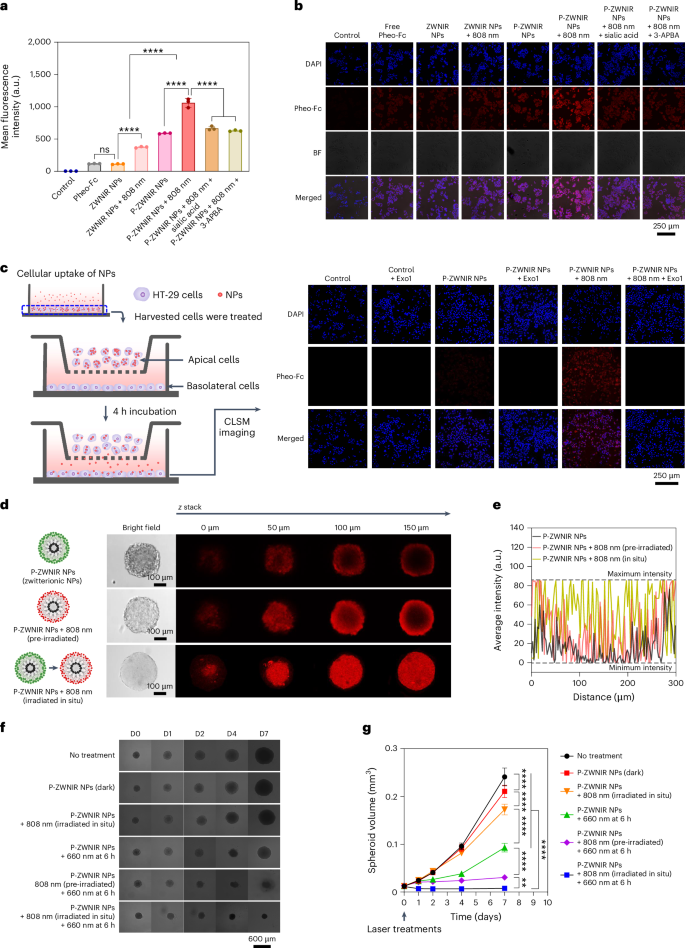
图3 P-ZWNIR NPs的体外细胞摄取、ROS产生、胞吞作用和渗透
在HT-29细胞中评估P-ZWNIR NPs的细胞摄取效率。P-ZWNIR NPs + 808 nm组的荧光强度明显高于ZWNIR NPs + 808 nm组(图3a)。共聚焦激光扫描显微镜(CLSM)分析显示,在P-ZWNIR NPs + 808 nm组的荧光信号最明显(图3b)。接下来,以Pheo-Fc荧光为探针,在Transwell培养系统中探索P-ZWNIR NPs的胞吞能力。P-ZWNIR NPs + 808 nm组的荧光强度明显高于P-ZWNIR NPs组(图3c)。综上,光漂白介导的电荷转换提高P-ZWNIR NPs的胞吞效率。接下来通过3D HT-29多细胞肿瘤球状体(MCSs)评估NPs的肿瘤穿透能力。P-ZWNIR NPs主要定位于MCSs外围(图3d)。相比之下,P-ZWNIR NPs+808nm(预照射)比两性离子显示出更深的渗透。原位照射的NPs比预照射的NPs具有更高的渗透效率。图3e的荧光强度-距离图证实了结果,其中原位照射组表现出的平均强度最高。综上结果表明,光漂白驱动的电荷转换通过提高P-ZWNIR NPs的胞吞效率促进其对肿瘤的渗透。使用MCS模型评估P-ZWNIR NPs辅助光疗治疗的抗肿瘤疗效(图3f、g)。与P-ZWNIR NPs(暗)相比,660 nm激光照射P-ZWNIR NPs显著抑制球体生长。与P-ZWNIR NPs +660 nm组相比,P-ZWNIR NPs+808nm(预照射)+660nm组有效地抑制MCS的生长(球体体积减少3.0倍),表明NPs对肿瘤穿透性的增强加强了其抗肿瘤疗效。
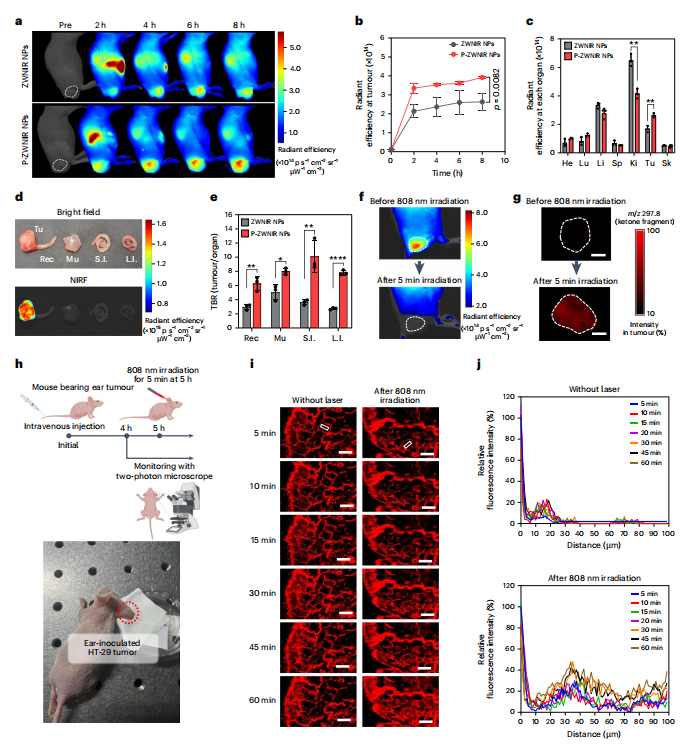
图4 P-ZWNIR NPs的肿瘤靶向性和穿透性
本研究将P-ZWNIR NPs在肿瘤分布阶段(~8 h)的体内肿瘤靶向能力与ZWNIR NPs进行比较(图4a)。ZWNIR NPs与P-ZWNIR NPs具有相似的积累模式,但P-ZWNIR NPs在肿瘤内的荧光强度是ZWNIR NPs的1.5倍(图4b)。除肾脏外,两种NPs在脱靶组织中的分布谱表现出显著的相似性(图4c)。由于P-ZWNIR NPs在肌肉和肠道组织中的荧光强度很低,本研究评估了它们在直肠肿瘤成像中的潜力。P-ZWNIR NPs对直肠肿瘤成像表现出明显的选择性(图4d)。P-ZWNIR NPs对肌肉、小肠、大肠和直肠等邻近正常组织的肿瘤-背景比值(TBR)显著高于ZWNIR NPs(图4e)。接着利用NIRF成像和基质辅助激光解吸电离(MALDI)质谱成像(MSI)可视化肿瘤中P-ZWNIR NPs的原位光漂白。肿瘤区域的荧光强度在808 nm激光照射下逐渐降低,随后稳定,表明光漂白在照射后5 min内完成(图4f)。激光照射5 min后,在肿瘤组织中检测到酮片段信号明显增加(图4g),表明了P-ZWNIR NPs的光氧化反应。进一步研究了P-ZWNIR NPs在耳部荷瘤小鼠的体内肿瘤穿透效率。静脉注射P-ZWNIR NPs后,用双光子显微镜直接观察肿瘤组织(图4h)。在808 nm激光照射前,P-ZWNIR NPs的荧光信号主要定位于血管内,在距离血管约20µm处检测到细微的荧光信号;808nm激光照射后,血管周围的荧光信号强度逐渐增强,且信号分布范围明显扩大,在距离血管100µm处检测到荧光信号(图4i、j)。
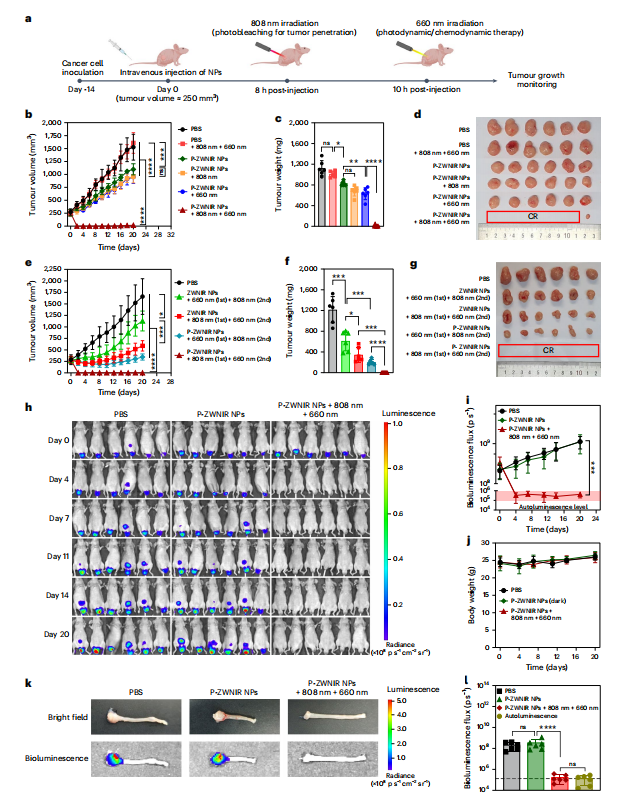
图5 在RC小鼠模型的P-ZWNIR NPs辅助联合光疗
本研究评估了P-ZWNIR NPs在皮下HT-29肿瘤移植小鼠中的光疗效果。当肿瘤体积达到250 mm3时,静脉注射。分别在注射后8h和10 h进行808和660 nm激光照射(图5a)。然后在没有进一步干预的情况下监测肿瘤体积20天(图5b)。第20天终止实验,切除肿瘤并称重(图5c、d)。PBS+808 nm+660 nm组的肿瘤生长速率与PBS组相当,表明单独激光治疗对肿瘤生长没有抑制作用。与PBS组相比,P-ZWNIR NPs单独治疗和P-ZWNIR NPs辅助的单次激光治疗显示出对肿瘤生长的改善抑制作用,但并没有导致肿瘤缩小。而P-ZWNIR NPs+808 nm+660 nm治疗完全消除了肿瘤。在6只小鼠中,有5只达到完全缓解,表明深层肿瘤渗透显著放大光动力/化学动力治疗的疗效。随后采用不同激光治疗方案进行抗肿瘤疗效研究,结果如图5e-g所示。在原位直肠肿瘤模型中评估P-ZWNIR NPs辅助光疗的疗效(图5h、i)。结果表明,P-ZWNIR NPs辅助的联合光疗实现肿瘤缓解。三组小鼠的体重分布无显著性差异,表明P-ZWNIR NPs毒性很小(图5j)。疗效研究结束后,切除直肠组织进行生物发光成像(图5k)。定量分析显示,PBS组和P-ZWNIR NPs组之间具有相似的信号。相比之下,P-ZWNIR NPs辅助光疗组的生物发光强度与自身生物发光强度相当,表明肿瘤完全缓解(图5l)。
全文小结:
综上所述,光漂白介导的电荷可转换P-ZWNIR NPs增强肿瘤的靶向性和穿透性,并促进晚期RCs的光疗。本研究是第一个利用七甲川菁染料快速光漂白特性实现肿瘤内NPs的高效电荷转换的研究。
多模态P-ZWNIR NPs有以下几个优点:
(1)直肠肿瘤的高度特异性成像,肿瘤靶向性增强;
(2)在NIR照射诱导的光氧化反应介导的电荷转换后,胞吞作用介导的深层肿瘤穿透;
(3)治疗效果良好,可根除临床相关大小的肿瘤和原位植入的直肠肿瘤,且没有任何明显的全身毒性。
因此,P-ZWNIR NPs辅助光疗的选择性肿瘤成像和强大的治疗效果可能为RC治疗提供一种常规手术或放疗的替代方案。
文章来源:
https://doi.org/10.1038/s41565-024-01757-4














