
急性心肌梗死(AMI)深刻影响全球健康,每年导致全球数百万人死亡。仅在中国,每年就有约两百万人死于AMI。及时有效的再灌注治疗,包括直接经皮冠状动脉介入治疗或溶栓疗法,在AMI患者中广泛应用,以减轻心肌损伤并限制梗死面积。这些治疗方法降低了AMI病例的短期和长期死亡率。然而,接受直接经皮冠状动脉介入治疗的ST段抬高型心肌梗死患者的住院死亡率仍介于2.2%至6.1%之间。这种现象的主要原因之一是再灌注引发了一连串的损伤,称为缺血再灌注损伤(IRI),其临床后果可能与最初的缺血性损伤一样严重。心肌细胞有限的再生能力导致在梗死后修复过程中形成纤维疤痕。这些纤维区域缺乏导电性和收缩功能,导致心肌重塑和心脏功能障碍。因此,减轻IRI对于减少心肌细胞死亡、抑制梗死后心肌重塑以及在再灌注后保留心脏功能至关重要。虽然抗氧化和抗炎治疗在缓解IRI方面显示出巨大潜力,但这些策略尚未取得令人满意的临床结果。
为此,
来自中国科学院长春应用化学研究所的丁建勋等团队
开发了一种热敏感型、可心肌内注射的聚氨基酸水凝胶——甲氧基聚乙二醇45-聚(L-甲硫氨酸20-共-L-丙氨酸10)(mPEG45-P(Met20-co-Ala10),PMA),并负载FTY720(PMA/FTY720),通过协同抗凋亡和抗炎作用来应对IRI。当将PMA水溶液注射到缺血的心肌中时,会发生溶胶-凝胶相转变,并响应活性氧物种(ROS)逐渐降解,按需释放FTY720。PMA与FTY720协同作用,通过清除ROS抑制心肌细胞凋亡,并调节促炎性的M1巨噬细胞向抗炎性的M2巨噬细胞极化,从而减轻炎症反应并促进血管再生。在大鼠IRI模型中,PMA/FTY720使凋亡细胞比例降低了81.8%,血管密度增加了34.0%,左心室射血分数(LVEF)提高了12.8%。在兔子IRI模型中,与单独治疗相比,基于凝胶的FTY720缓释使LVEF额外提高了7.2%。综上所述,这种经过设计的PMA水凝胶通过协同抗凋亡和抗炎作用有效缓解了IRI,为治疗心肌IRI提供了宝贵的临床应用潜力。相关工作以题为
“Myocardia-Injected Synergistically Anti-Apoptotic and Anti-Inflammatory Poly(amino acid) Hydrogel Relieves Ischemia-Reperfusion Injury”
的文章发表在2025年02月05日的期刊
《Advanced Materials》
。

【聚氨基酸的合成与表征】
如图1A所示,聚(氨基甲酸酯)(PMA)是通过L-甲硫氨酸N-羧酸酐(Met NCA)和L-丙氨酸N-羧酸酐(Ala NCA)的开环聚合反应合成的,其中以端氨基甲氧基聚乙二醇(mPEG-NH
2
;数均分子量(Mn)= 2000.0 g/mol)作为大分子引发剂。mPEG-NH
2
的成功合成通过61.5 ppm(−CH
2
CH
2
OH)处共振信号的消失和41.3 ppm(−CH
2
CH
2
NH
2
)处新信号的出现得到证实。Ala NCA的成功纯化通过6.1(−CONH−)、4.4(−CH−)和1.6 ppm(−CH
3
)处的共振信号得到证实。Met NCA的成功合成通过6.7(−CONH−)、2.3和2.1 ppm(−CH
2
CH
2
SCH
3
)处的共振信号得到证实。PMA的成功合成通过
1
H NMR谱、傅里叶变换红外光谱(FT-IR)和凝胶渗透色谱(GPC)得到证实。图1B中所有峰都进行了准确标注,甲硫氨酸残基(4.4、2.2和1.7 ppm)和丙氨酸残基(4.2和1.0 ppm)的代表峰确认了Met NCA和Ala NCA的成功聚合。PMet和PAla嵌段的聚合度通过比较主链中次甲基峰(−COCHNH−)与mPEG中亚甲基峰(−CH
2
CH
2
O−)的积分来确定,分别为20和10。FT-IR光谱中对应于二级胺基团在3300 cm
−1
、羰基在1650 cm
−1
和硫醚基团在1100 cm
−1
的吸收峰,以及GPC中比mPEG-NH
2
保留时间更短的单峰,也证实了PMA的成功制备。
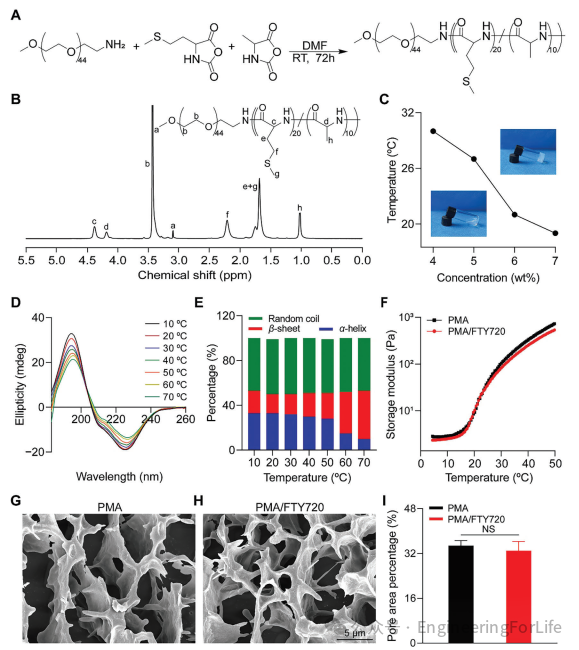
图1 PMA聚合物的合成与表征
作为一种内源性产生的活性氧物种(ROS),过氧化氢(H₂O₂)在本研究中被用于探究聚(氨基甲酸酯)(PMA)与ROS之间的反应活性。甲硫氨酸中的硫醚基团使PMA能够与ROS发生相互作用(图2A)。当将H₂O₂加入PMA水溶液中时,在4.5-4.1、3.0-2.6、2.3-2.0以及1.4-1.2 ppm处出现了多个共振信号,且峰强度随时间逐渐增强,并在大约48小时达到峰值(图2B)。这表明H₂O₂对硫原子的氧化提高了PMA的水溶性。对氧化过程的进一步观察发现,PMA与H₂O₂孵育后,在1250 cm⁻¹处出现了对应于砜基团的新吸收峰,以及在1030 cm⁻¹处出现了对应于亚砜基团的新吸收峰(图2C)。GPC结果显示,与PMA相比,出现了一个保留时间更短的单峰(图2D)。这些结果暗示着PMA中的硫醚基团被H₂O₂氧化,并转化为砜基团和亚砜基团。
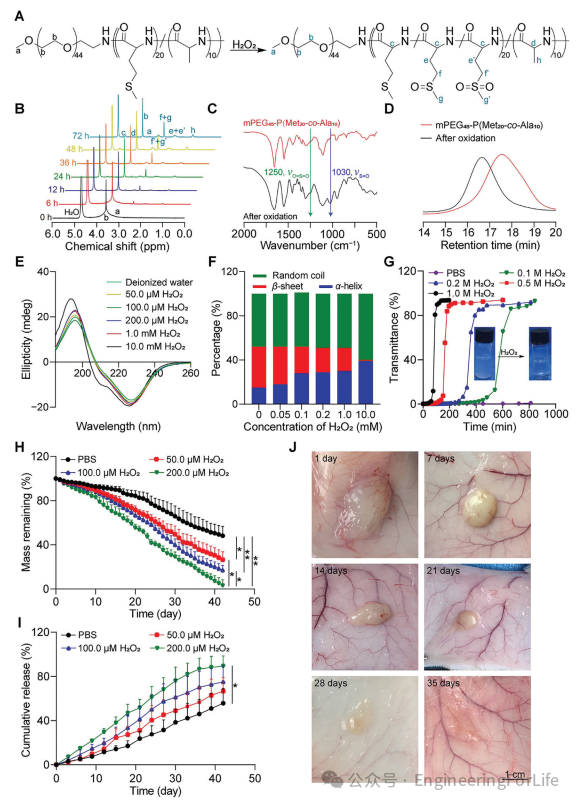
图2 PMA的氧化和降解过程
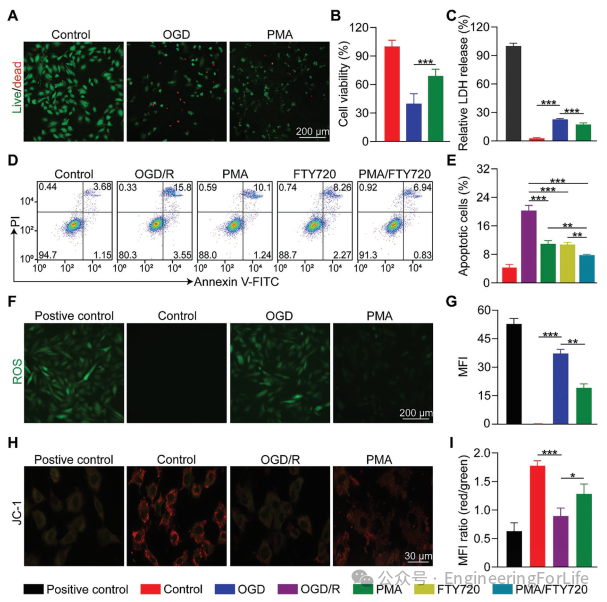
图3 PMA和FTY720的细胞保护作用
【PMA/FTY720在体外调节细胞行为中的作用】
通过将PMA与H9c2细胞共培养,本文评估了PMA对氧糖剥夺(OGD)的保护作用。活/死染色显示,OGD处理后细胞存活率显著下降,而PMA减轻了OGD诱导的细胞死亡(图3A)。OGD后活细胞数量降至41.1%,但添加PMA后反弹至59.4%。同时,与对照组相比,OGD处理导致死细胞数量增加了7.4倍,而添加PMA使细胞死亡率降低了53.8%。此外,本文使用细胞计数试剂盒-8(CCK-8)检测了细胞活力,结果显示PMA抑制了OGD导致的细胞活力下降(图3B)。本文还评估了乳酸脱氢酶(LDH)水平以指示细胞损伤。在OGD组中,LDH水平比对照组高8.4倍,但PMA使LDH水平降低了23.7%(图3C)。这些结果表明PMA减少了OGD诱导的细胞损伤。
先前的研究表明,H₂O₂促进巨噬细胞向M1型极化。因此,本文旨在通过清除ROS来验证PMA对巨噬细胞表型调节的影响。免疫荧光染色显示,用PMA或FTY720处理后,诱导型一氧化氮合酶(iNOS)的表达降低,而精氨酸酶1(Arg1)的水平升高。此外,同时补充PMA和FTY720协同增强了这种效果(图4A)。FTY720使iNOS含量降低了27.5%,Arg1含量增加了2.2倍。尽管PMA在调节中表现出相似的趋势,但未达到统计学显著性。当联合使用时,PMA/FTY720使iNOS含量降低了32.2%,Arg1含量增加了2.6倍(图4B,C)。
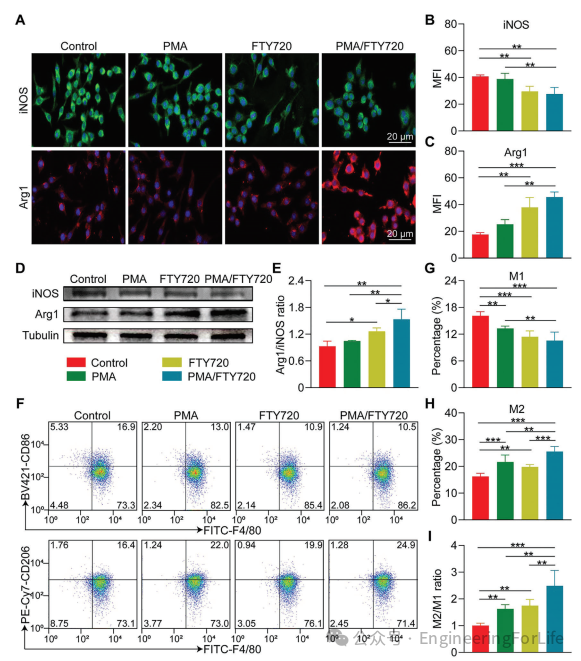
图4 巨噬细胞的极化调节
【PMA/FTY720在大鼠心肌缺血再灌注损伤模型中的治疗效果】
最初,将溶于PBS或PMA溶液中的Cy5注入跳动心脏的前壁,以评估心肌注射后PMA溶液的保留情况。结果表明,PBS组的荧光强度迅速下降,最终在24小时内消失。相反,PMA组的荧光强度在最初的快速下降后保持稳定超过96小时(图5A)。注射后6小时,PBS组的荧光强度已降至初始值的4.2%,而在PMA组中,它仍保持在26.8%。即使注射后96小时,PMA组的测量荧光强度仍保持在约14.0%。这些结果表明,该溶液在注入心肌后并未立即形成凝胶,可能是由于心肌的持续收缩导致部分注射溶液流失。热敏性PMA溶液的原位凝胶化延长了其在局部位置的保留时间,确保了PMA和封装药物在预期作用部位的持续存在。随后,本文建立了大鼠心肌缺血再灌注损伤(MIRI)模型,并通过心电图证实了其成功建立。通过测量建模七天后的血清心肌肌钙蛋白T(cTnT)和B型利钠肽(BNP)水平来评估心肌损伤程度和心功能。结果证实,PMA和FTY720均减轻了IR诱导的心肌损伤。此外,本文发现:联合治疗效果最为显著,与IR组相比,cTnT水平降低了31.7%,BNP水平降低了67.7%(图5B-D)。
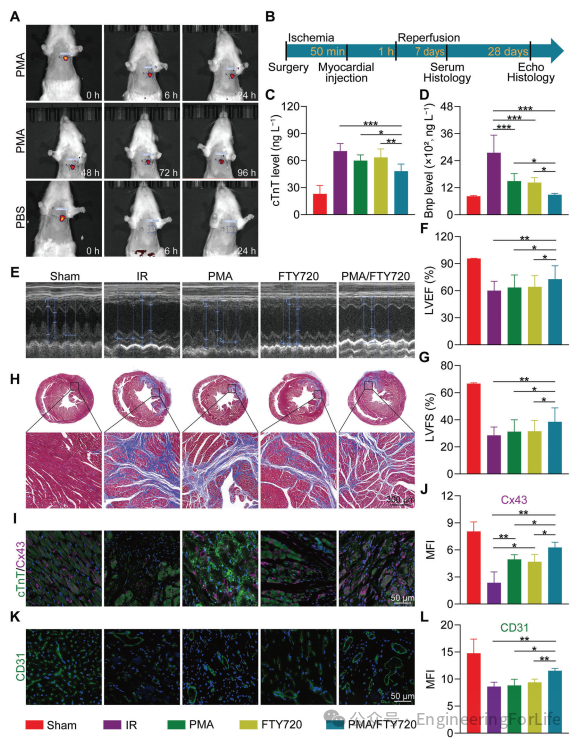
图5 PMA/FTY720的治疗效果
按照图6A建立的兔子心肌缺血再灌注损伤(MIRI)模型进一步验证了基于水凝胶的持续药物释放系统的优势。超声心动图结果显示,与PMA+FTY720组相比,PMA/FTY720组在心功能改善上更为显著,平均左心室射血分数(LVEF)提高了7.2%,平均左心室短轴缩短率(LVFS)提高了4.5%(图6B-D)。H&E染色和马松三色染色也显示,PMA/FTY720组由缺血再灌注(IR)引起的心肌损伤和纤维化显著减少(图6E,F)。此外,PMA/FTY720组中IR区域周围心肌细胞的肥大程度较轻,与PMA+FTY720组相比,相对细胞面积减少了26.4%,表明心肌重塑程度较轻(图6G,H)。
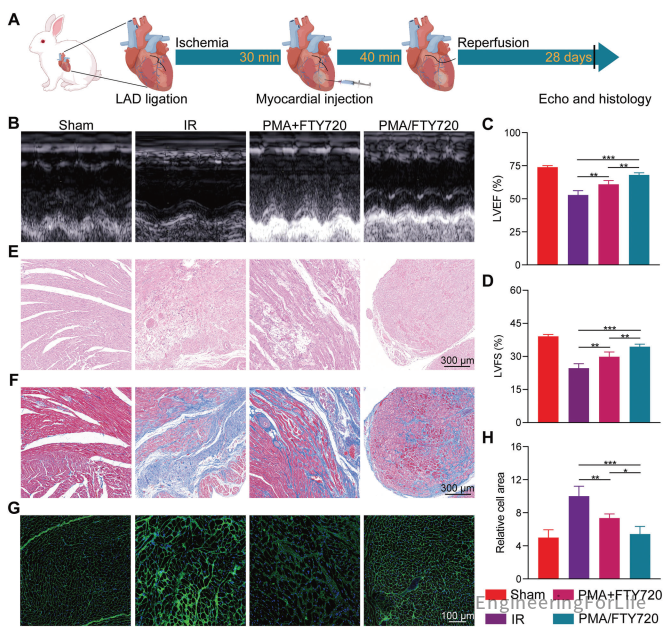
图6 PMA/FTY720与PMA+FTY720在兔MIRI模型中的治疗效果对比
【PMA/FTY720的MIRI治疗机制】
基于在细胞实验中观察到的PMA的保护机制,本文在大鼠心肌缺血再灌注损伤(MIRI)模型中验证了PMA/FTY720的治疗机制。在急性心肌梗死(AMI)后的前三天,急性炎症阶段占主导地位,其特征是M1巨噬细胞盛行,这些细胞对于清除细胞碎片至关重要。随后的四天里,炎症开始消退,修复过程开始。修复阶段的特征是M2巨噬细胞数量增加,这些细胞积极参与组织修复。
本文通过免疫荧光染色评估了治疗七天后大鼠心肌组织再灌注区域的炎症反应。遭受缺血再灌注损伤(IRI)的大鼠表现出M1巨噬细胞标记物诱导型一氧化氮合酶(iNOS)的表达增加,以及M2巨噬细胞标记物精氨酸酶1(Arg1)的水平显著降低(图7A)。PMA/FTY720治疗导致iNOS水平降低了77.2%,Arg1水平增加了1.6倍。iNOS/Arg1比值反映了M1和M2巨噬细胞之间的平衡。IR组中M1巨噬细胞的百分比超过了PMA/FTY720组,而M2巨噬细胞的比例则呈现相反的趋势(图7E-G)。流式细胞术分析显示,在治疗大鼠的心肌组织中,M1巨噬细胞减少,而M2巨噬细胞相应增加。PMA/FTY720取得了最有利的结果,表现为M2与M1巨噬细胞比例从IR组的1.9增加到PMA/FTY720组的3.6。同时,与M1巨噬细胞相关的细胞因子白介素-1β(IL-1β)的血清水平下降,而与M2巨噬细胞相关的细胞因子白介素-10(IL-10)增加。在PMA/FTY720组中,IL-1β含量降至对照组的49.0%,而IL-10含量升至对照组的2.6倍。这表明PMA/FTY720调节了巨噬细胞向M2表型的极化。
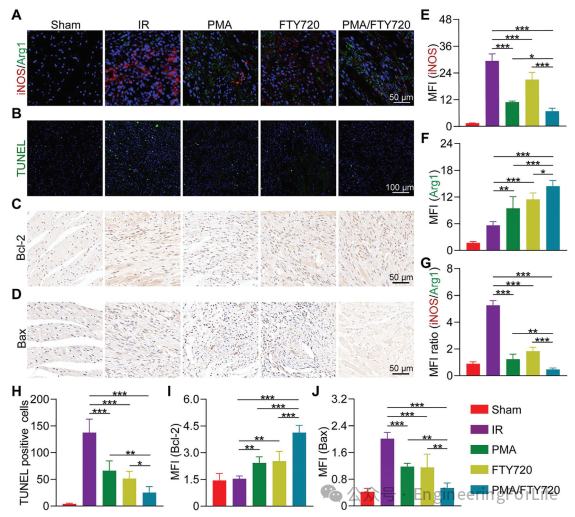
图7 PMA/FTY720的治疗机制
对来自Sham组、IR组和PMA/FTY720组的心肌组织进行了代谢组学和转录组学分析,以深入了解PMA/FTY720的保护机制。经过四周的治疗,本文观察到PMA/FTY720恢复了异常代谢物的水平,并使几种代谢物的表达正常化(图8A,B)。这些发现表明,在IR组中,与MIRI相关的各种代谢物(如穿心莲内酯、亚油酸、核黄素和牛磺酸)的下调显著,而在治疗后有明显的恢复。这些代谢物因其抗炎特性而闻名,这表明PMA/FTY720有助于减轻炎症。Tran等人证明,穿心莲内酯抑制了巨噬细胞的活化,降低了肿瘤坏死因子-α(TNF-α)的表达。此外,Zhou等人证实,穿心莲内酯加速了巨噬细胞从M1向M2表型的极化,下调了促炎细胞因子。同样,亚油酸、核黄素和牛磺酸也显示出类似的抗炎效果。这些结果与我们的研究结果一致,也证明了PMA/FTY720在炎症调节中的作用。
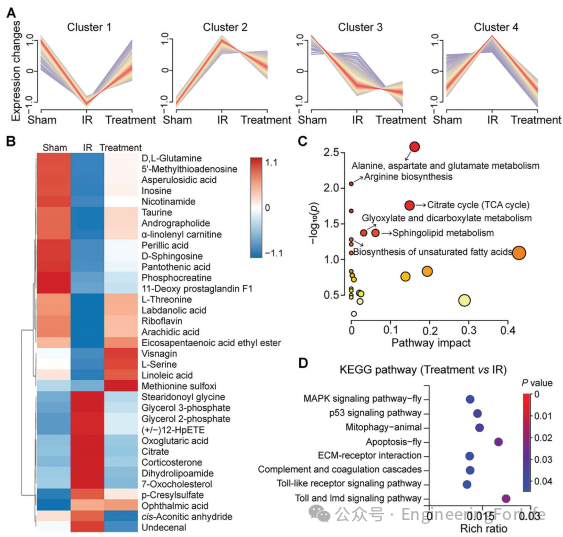
图8 PMA/FTY720的治疗机制
【总结与展望】
本研究利用一种生物活性热敏感水凝胶PMA/FTY720来调节IR微环境以治疗心肌缺血再灌注损伤(MIRI)。首先,PMA通过清除活性氧物种(ROS)减轻了由OGD/R诱导的细胞凋亡。除了其ROS清除作用外,PMA和FTY720协同调节巨噬细胞向M2表型极化。在心肌注射后,水凝胶的原位形成得到了验证,证明了即使在持续心肌收缩导致少量注射溶液泄漏的情况下,它仍能在注射部位长时间保留。水凝胶对再灌注微环境作出反应,按需释放FTY720。这种控制释放机制增强了PMA/FTY720的治疗效果,使其优于两种药物简单联合治疗,在兔子IRI模型中使左心室射血分数(LVEF)提高了7.2%。这种经过设计的PMA水凝胶对MIRI表现出协同治疗作用,在大鼠IRI模型中使凋亡细胞减少了81.8%,血管密度增加了34.0%,LVEF提高了12.8%。这项研究为MIRI提供了一种有前景的治疗策略,这种生物活性水凝胶具有很大的临床转化潜力。
参考资料:
https://doi.org/10.1002/adma.202420171
来源:EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






