科研经验 | 文献 | 实验 | 工具 | SCI写作 | 国自然

作者:叶军(转载请注:解螺旋·医生科研助手)
Caco-2细胞转运模型是首个被国外制药企业以及实验室应用的模拟肠道吸收的药物筛选模型,已广泛应用于药物在小肠吸收的评价和转运机制研究中。Caco-2细胞的结构和功能类似于人小肠上皮细胞,含有与小肠刷状边缘上皮相关的酶系。
与正常的成熟小肠上皮细胞在体外培育过程中出现的逆向分化不同,Caco-2细胞在多孔可渗透的聚碳酸酯膜上培养3周后可以自发分化为肠上皮细胞,形成致密的细胞单层,进而可用作肠道转运模型(图1)。Caco-2细胞模型培养和验证方法简单,与体内动物实验相比更为方便、经济。

1) 采用MEM完全培养液(含10%胎牛血清、1%非必须氨基酸、1%丙酮酸钠、1%谷氨酰胺和1%青-链霉素)在37℃和5% CO2条件下培养Caco-2细胞;
2) 每隔一天更换一次培养液。当细胞汇合程度达80%时,进行细胞传代。将细胞培养液吸出,用不含Ca2+和 Mg2+离子的HBSS小心清洗2次,加入0.25%胰蛋白酶-0.02% EDTA 混合消化液进行消化;
3) 取细胞适量接种到75 cm2培养瓶继续培养或进行铺板操作。
1) 收集对数期的Caco-2细胞,用MEM完全培养液将细胞浓度调整为2.0×105 cells/mL;
2) 在Transwell板(聚碳酸酯膜,0.4 µm,1.12 cm2)(图2)的基底侧(Basolateral side)加入1.5 mLMEM完全培养液,在顶侧(Apical side)加入细胞悬液0.5 mL;
3) 放入细胞培养箱内培养,每两天换一次培养液,培养一周后每日换液;
4) 继续培养至21天;
5) 采用Millicell ERS电阻仪(Millipore公司)测定跨上皮细胞电阻(大于500 Ω•cm2),确定细胞单层的致密性和完整性。

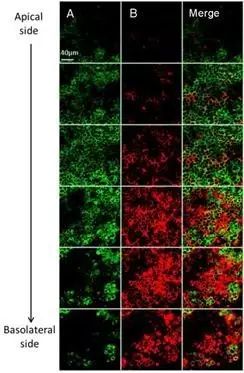
下面以荧光标记的药物为例,借助激光共聚焦显微镜来观察药物跨膜转运(图3)。
1) 取出Transwell板进行电阻测定,选择符合转运条件的细胞孔(电阻大于500 Ω•cm2)。用预热(37℃)的Hank’s缓冲液洗2~3 遍,并置37℃孵育平衡20~30 min,吸弃洗液;
2) 分别取0.5 mL荧光标记的药物溶液加入顶侧(Apical side)作为供给液,同时基底侧(Basolateral side)加入1.5 mL空白Hank’s 缓冲液作为接收液;
3) 37℃条件下转运2 h;
4) 转运结束后移除孔内荧光液,加HBSS小心清洗3次,洗去未进入细胞的荧光染料结束转运;孔内加适量4%多聚甲醛溶液,室温下固定20 min;
5) 固定完成后用HBSS清洗3次,加10 μg/mL Hoechst 33258适量,室温下染核1 h;HBSS清洗3次后,加2滴抗荧光淬灭剂,小心将单层细胞剪下至玻底小皿中,在激光共聚焦显微镜下进行Z轴横切,观察荧光标记药物的跨膜过程。
由激光共聚焦显微镜拍摄的图可以看出,带绿色荧光的药物A与带红色荧光的药物B在Caco-2细胞模型中的跨膜转运速率不同,其中药物A的跨膜转运速率慢于药物B,跨膜转运速率的不同与药物本身的理化性质密切相关。
除采用荧光标记的药物进行跨膜转运研究外,还可以采用非荧光标记的药物进行跨膜研究,此时测定药物的跨膜转运能力就需要借助其他检测方式来(如高效液相色谱)完成。