▎药明康德/报道
近日,美国生物制药公司Alder BioPharmaceuticals公布了其预防慢性偏头痛的在研新药eptinezumab关键3期临床试验的积极数据。这项名为PROMISE 1的治疗频繁间歇性偏头痛的临床试验达到了主要临床终点和关键次级临床终点。

偏头痛是一种影响非常广泛的慢性神经疾病,据估计10-15%的人群每月至少有一次偏头痛发作。偏头痛的典型特征是一侧头部带有搏动性的头痛,同时伴有恶心、呕吐、畏光、畏声等症状。在偏头痛患者中,大约有10%属于严重的慢性偏头痛患者,这些患者平均每月的头痛天数在15天以上,严重影响正常生活。对于这些患者,除了在头痛发作后使用止痛药物之外,并没有有效的长期缓解或预防头痛的药物。
Alder的在研新药eptinezumab是一个针对降钙素基因相关肽(CGRP)的单克隆抗体。研究显示,CGRP在偏头痛的形成过程中发挥了重要的作用,它可以扩张脑部血管,引起头痛,同时还能参与到痛觉的传递过程中。Eptinezumab通过特异性地结合CGRP,阻止偏头痛的产生和发展。
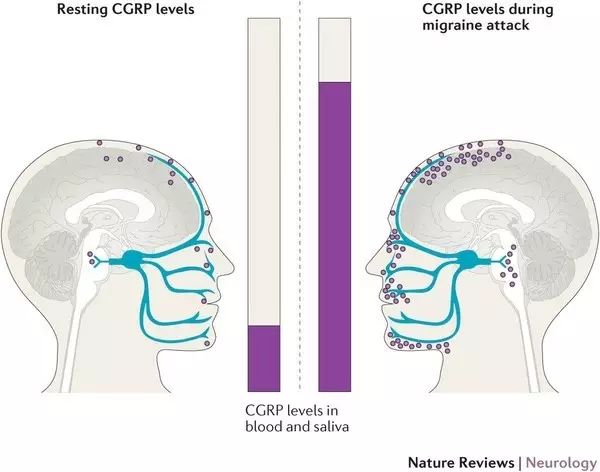
▲CGRP肽分子被认为在偏头痛中起作用(图片来源:《Nature Reviews》)
PROMISE 1是一项双盲、随机、安慰剂对照的3期临床试验,旨在评估患者在24周研究期间内,每12周接受一次静脉输注eptinezumab(300毫克或100毫克)的有效性和安全性。该试验的研究对象为888名诊断患有频繁间歇性偏头痛的患者。PROMISE 1的主要终点是从第1至12周,每月偏头痛天数和基线相比的平均变化。关键次级终点为患者从第1-4周和第1-12周,每月偏头痛天数减少超过75%的患者比例。
Eptinezumab在临床试验中取得了良好的结果。在患者中,接受300毫克或100毫克药物输注的患者,每月平均头痛天数从基线的8.6天,分别减少了4.3天和3.9天,两者的减少幅度都高于安慰剂组的3.2天(p值分别为0.0001和0.0179)。这些结果也达到了主要临床终点。
在用药1-4周后,接受eptinezumab治疗的患者中,不少人的头痛天数减少超过了75%。在300毫克或100毫克组中,该部分患者比例分别为31.5%和30.8%,显著多于安慰剂组的20.3%(p值分别为0.0066和0.0112)。而在用药的第1-12周,接受300毫克eptinezumab治疗的患者有29.7%其头痛天数减少超过75%,显著高于安慰剂组的16.2(p值为0.0007)。
值得一提的是,在接受300毫克药物的的患者中,每5个人中就有1个在接受治疗的前6个月里完全没有偏头痛。此外,这项研究中药物的安全性与安慰剂相似。安全性资料与之前报告的eptinezumab研究一致,完整的安全数据将在研究结束时提供。

▲Alder的总裁兼首席执行官Randy Schatzman博士(图片来源:Alder官方网站)
Alder的总裁兼首席执行官Randy Schatzman博士说:“Alder的目标是为正在寻求从偏头痛中获得解放的患者发现和发展同类最优(best-in-class)疗法。这些疗法有可能改变数以百万计的未得到有效治疗的患者的生活。这些积极的研究结果,与之前报告的eptinezumab研究一致,支持eptinezumab作为一种潜在的偏头痛预防疗法。我们的第二项关键3期临床研究的重点是慢性偏头痛,我们将在2018年下半年向FDA提交我们的生物制剂许可申请。”
Alder预计将在今年晚些时候完成对患有慢性偏头痛患者的募集。PROMISE 2的重点数据预计将在2018年上半年完成。我们希望这些试验顺利完成,早日为偏头痛患者带来新药。
参考资料:
[1] Alder Biopharma's Migraine Med Hits Goals In Late-Stage Trial
[2] Alder BioPharmaceuticals Announces Positive Eptinezumab Phase 3 Results for Prevention of Frequent Episodic Migraine

















