
手性药物是指分子结构中含有手性中心(包括手性碳、手性氮、手性硫等)的药物。1992年1月,FDA就颁布了《立体异构体药物的开发》技术研究指导原则, 对立体异构体药物的研究中需要进行的工作给出了指导性意见。2006年12月, CFDA发布了《手性药物质量控制研究技术指导原则》, 对手性药物的合成工艺、结构确证以及质量控制研究方面需要进行的研究工作进行了详细指导,为手性药物研究指明了方向。
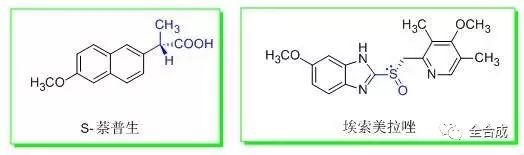
手性药物作为一类特殊的化学药物, 对其制备工艺的研究不仅要遵循《化学药物制备工艺研究的指导原则》,还应结合手性中心的引入方式不同,建立合适的过程控制指标以监控反应过程中构型的变化情况,主要归纳为以下三种情况:
1)直接从起始物料中引入
该起始物料应符合以下两个条件:一是有商品化来源,二是其化学结构,理化性质,制备方法和杂质情况等均有明确的信息。终产品的光学纯度主要取决于起始物料的光学纯度和后续反应过程对手性中心发生构型变化的可能性及程度。因此需要建立起始物料的立体专属性的分析方法,严格控制光学纯度,制定合理可行的限度。例如降脂药阿托伐他汀钙的合成中使用了外购的关键侧链作为起始物料之一(结构如下图),其中含有两个手性碳,需要建立该起始原料的光学质控指标, 否则将会影响到对终产品质量的评价。
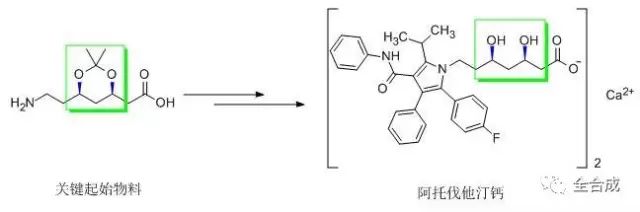
由于在后续反应过程中存在构型变化的可能性,就需要结合工艺中的过程控制,对每步反应的中间体中的立体异构体进行检测,分析和监控构型变化的可能性。
2)不对称合成工艺
采用立体选择性或专属性的反应(包括酶催化反应)在分子中引入所需构型的手性中心,终产品的光学纯度直接取决于不对称合成反应的立体选择性。在确定工艺之前应尽可能查阅相关的文献资料,充分了解不同反应的反应机制、反应条件、立体选择性等,以选取合适的反应。某些反应由于底物空间位阻的原因,本身就具有较大的立体选择性, 所需构型可能就是反应所得的优势构型。例如降压药依普利酮的合成过程中,C-C双键的环氧化反应步骤由于底物的位阻效应,具有非常高立体选择性。
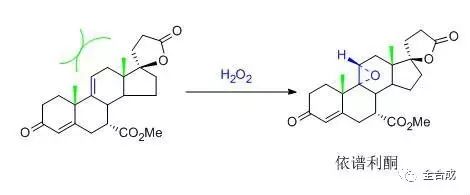
不对称合成反应立体选择性对终产品的质量有至关重要的影响,是整个合成工艺的关键步骤之一,因此要对工艺参数进行筛选和优化,充分的风险评估,确定关键工艺参数。对于引入手性中心后的中间体为手性控制的关键中间体,应建立该中间体的内控标准,重点关注和监控引入该手性中心后可能产生的立体异构体。例如抗癫痫药艾司利卡西平乙酸酯的合成,采用手性金属Ru催化剂,将酮对映选择性的还原为醇,得到所需要的构型,随后与乙酸酐反应,得到终产物。
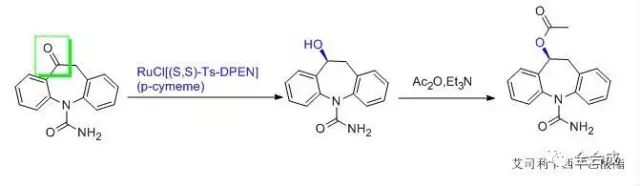
引入手性中心后,进行后续反应时仍可能产生构型变化,同样需要后续中间体中的立体异构体进行检测,根据终产品质控的难易程度,确定合理的中间体光学异构体控制限度。
此外,目前较常使用的一些手性催化剂如钌、铑等都有较大的毒性,可参考欧盟EMEA颁布的金属催化剂或金属试剂残留量规范限度指导原则,对重金属残留进行质控。
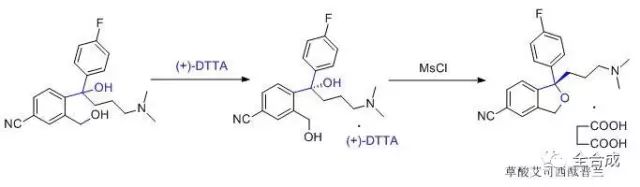
3)消旋体拆分
较为常用的仍然是采用手性拆分试剂与外消旋的中间体或终产品成盐,分离纯化得到所需的非对映异构体,再去掉拆分剂,从而得到所需构型的化合物。应注意选用价廉,易得,光学纯度高的拆分试剂;其次应尽量纯化所得的非对映异构体,这是控制光学纯度的关键步骤;如果是拆分外消旋的中间体,还要考虑后续反应步骤是否会引起构型的变化,同样需要对中间体的光学纯度进行质控。例如抗抑郁药草酸艾司西酞普兰的合成,使用手性酸作为拆分剂,得到光学纯的手性中间体后,经过缩合,成盐等步骤得到目标产物。
总之,不论手性中心是如何引入的,在其合成工艺的研究中, 一定要选用切实可行的分析方法来检测与控制产品的光学纯度,并在药品申报资料中完整地反映出来。

线下课程培训















