正文
作者:蒲公英-雨轩 来自:蒲公英
2019年12月31日,国家药监局发布信息,双价人乳头瘤病毒疫苗被获批上市。这是首个国产HPV(宫颈癌)疫苗被批准在国内上市。
 国家药品监督管理局批准厦门万泰沧海生物技术有限公司的双价人乳头瘤病毒疫苗(大肠杆菌)(商品名:馨可宁(Cecolin))上市注册申请,该药是首家获批的国产人乳头瘤病毒疫苗,适用于9-45岁女性。
国家药品监督管理局批准厦门万泰沧海生物技术有限公司的双价人乳头瘤病毒疫苗(大肠杆菌)(商品名:馨可宁(Cecolin))上市注册申请,该药是首家获批的国产人乳头瘤病毒疫苗,适用于9-45岁女性。
此次获批的双价人乳头瘤病毒疫苗(大肠杆菌)系国内首家申报生产的HPV疫苗,针对HPV16、18型,被纳入国家重大新药创制专项支持。
2019年5月11日,国际著名医学期刊JNCI: Journal of the National Cancer Institute在线刊出了厦门大学国家传染病诊断试剂与疫苗工程技术研究中心夏宁邵团队发表的题为“Efficacy, safety, and immunogenicity of an Escherichia coli-produced bivalent human papillomavirus vaccine: An interim analysis of a randomized clinical trial”的研究论文。
该论文报告了实验室和厦门万泰沧海生物技术有限公司自主研发的双价人乳头瘤病毒疫苗(大肠杆菌)三期临床试验的期中分析结果。

该研究是在全国4个中心5个现场的18-45岁健康女性中进行的多中心、随机、双盲、对照(戊肝疫苗)的三期临床试验,共入组7372名志愿者(试验组3689人、对照组3683人)。
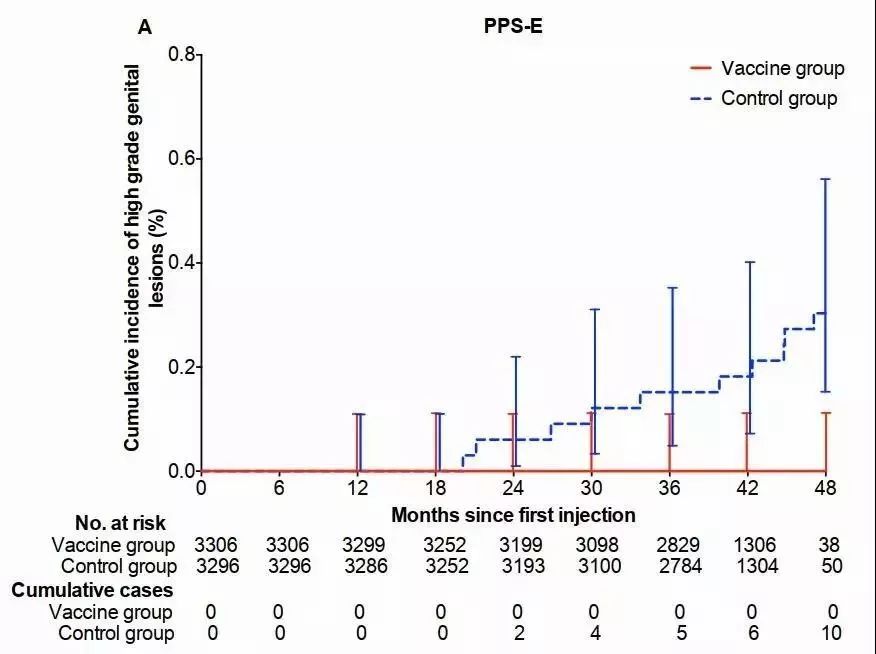
三期临床试验期中分析的结果显示,在符合方案(PPS)人群中,受试疫苗对HPV16和/或18型感染相关的病变终点(CIN2+和/或VIN2+和/或VaIN2+)的保护率为100.0%(95% CI: 55.6% - 100.0%),对HPV16和/或18型持续性感染(6月以上)的保护率为97.8%(95% CI: 87.1% - 99.9%)。
在试验期间未发生与疫苗接种相关的非预期不良反应和严重不良事件,未发生与疫苗接种相关的妊娠结局和新生儿健康状况的异常。
受试疫苗可有效诱导受试者产生较高水平的HPV16和18型中和抗体和IgG抗体并维持至少42个月。
该研究结果证实实验室自主研发的双价人乳头瘤病毒疫苗(大肠杆菌)具有良好的安全性、免疫原性和免疫持久性,可有效地预防HPV 16型和/或18型相关的宫颈高度癌前病变及持续性感染。
夏宁邵团队的16/18双价人乳头瘤病毒疫苗(大肠杆菌)采用独创的大肠杆菌原核表达类病毒颗粒疫苗产业技术体系研发而成,该体系工艺稳定、产能高且生产成本较低,可为发展中国家提供优质的可负担的HPV疫苗,对全球宫颈癌防控具有重要的意义。
目前HPV疫苗有三种:二价、四价、九价
分别是英国葛兰素史克公司生产的针对HPV16、18型的双价疫苗,美国默沙东公司生产的针对HPV6、11、16、18型的四价疫苗和针对HPV6、11、16、18、31、33、45、52、58型的九价疫苗。
二价宫颈癌疫苗
二价宫颈癌疫苗是针对HPV16和HPV18两个首恶之徒而研发的生物武器。由于HPV16和HPV18在所有引发宫颈癌的HPV亚型中占了70%以上的份额, 因此, 接种了二价宫颈癌疫苗, 女性同胞们今后患上宫颈癌的风险可大大减少。
四价宫颈癌疫苗
四价宫颈癌疫苗是在二价疫苗的基础上, 增加了HPV6和HPV 11二种低危亚型。这二种低危型也会引起生殖道肛周皮肤和阴道下部的外生性湿疣类病变、扁平湿疣类病变和低度子宫颈上皮内瘤样变, 同样也对人体健康造成损害。也就是说, 四价宫颈癌疫苗可预防更多的HPV感染, 不但可减少宫颈癌的风险, 还可以预防男女常见的性病皮肤病, 预防作用更加广泛。
九价宫颈癌疫苗
九价宫颈癌疫苗是在四价疫苗的基础上增加了属于高风险组的31、33、45、52和58五种HPV亚型, 是迄今为止功能强大、预防几率更大的宫颈癌疫苗。
综上所述,二价疫苗是“雪中送炭”,而增加了抗HPV 6和HPV11的四价疫苗是“锦上添花”,九价疫苗则是“更上层楼”。
要提醒一下,目前二价、四价与九价HPV疫苗适用的人群是不同的,公众可以根据自身年龄和经济状况,选择接种不同价型的疫苗。
二价HPV疫苗(希瑞适®、馨可宁(Cecolin))适用于9-45岁女性预防HPV16/18型感染;
四价HPV疫苗(佳达修®)适用于20-45岁女性预防HPV16/18/6/11型感染;
九价HPV疫苗(佳达修9®)针对16-26岁女性预防HPV16/18/6/11/31/33/45/52/58型感染。
宫颈癌是妇科常见的恶性肿瘤之一。
根据国家癌症中心公布的数据显示,2015年我国宫颈癌新发病例约10万例,死亡约3万例,意味着每天有近300名女性罹患宫颈癌、80余人死于该病,宫颈癌也是15岁至44岁女性的第三大高发癌症。
宫颈癌作用机制
HPV(人乳头状瘤病毒)感染是引起宫颈癌发生的主要病因。目前预防宫颈癌最直接、最有效的方法即接种HPV疫苗。
HPV病毒有L1、L2两种蛋白衣鞘,其中L1是主要成分,含有诱导中和抗体的主要表位。全球已有3种预防性HPV疫苗上市,即二价HPV疫苗(希瑞适®)、四价HPV疫苗(佳达修®)和九价HPV疫苗(佳达修9®)。
3种疫苗均是以利用基因重组技术,分别以昆虫细胞-杆状病毒或酿酒酵母菌作为表达载体,产生L1衣壳蛋白,HPV L1衣壳蛋白作为抗原有效成分,L1衣壳蛋白自行装配形成HPV型别特异的病毒样颗粒(virus-like particle, VLP),诱导机体产生特异型L1抗体。病毒样颗粒不含DNA,不具备复制能力。
1.接种HPV疫苗后,还需要继续做宫颈癌筛查吗?
无论接种何种HPV疫苗,接种后仍然要定期进行宫颈癌筛查。因为目前的疫苗都不能100%预防宫颈癌,即便是刚刚通过批准有条件上市的九价疫苗,也只是减少90%的宫颈癌。
不过,研究发现接种疫苗后由于宫颈癌发生率大幅下降,筛查的间隔时间有望延长,今后在宫颈癌筛查方面的花费也会大幅下降。但在筛查指南更新之前,接种疫苗后的女性还是要按照既往的筛查时间和筛查方案进行筛查,以防万一。
2.接种HPV价疫苗前需要检查HPV感染状态吗?
注射HPV疫苗前,会有简单的医生咨询。只要不是在怀孕期间,都是可以注射的。接种HPV疫苗以前不需要先检测是否已经感染HPV,受多于1种HPV病毒感染的机会相对小。不论是否已受HPV病毒感染,接种疫苗后,绝大多数女性均可获得不同程度的保护。
3.接种HPV疫苗安全吗?
HPV疫苗是全球第一个用于预防肿瘤的疫苗。它是利用病毒上一种特殊的蛋白质外壳来引发人体的免疫反应,不含有病毒DNA,因此接种疫苗不会造成病毒感染。
接种HPV疫苗后常见的不良反应包括头痛、发热、恶心、呕吐、肌肉及关节痛,接种部位的红斑、疼痛及瘙痒等。上述不良反应大部分为轻至中度,且短期内可自行缓解,无需特殊处理。
4.HPV疫苗的保护力能持续多久呢?
目前还不完全清楚。二价苗和四价苗上市已超过10年,目前的研究数据显示,接种人群的抗体水平依然维持在高水平,尚无需要强化接种的证据。九价疫苗是在2014年上市的,在对于9~15岁及16~26岁人群的研究显示,血清抗体在疫苗接种后第5年依然维持阳性。目前也没有需强化接种的证据。
根据目前的研究可以认为,接种后10年的保护能力是没有问题的。用数学模型推论,接种后50年保护能力也没有问题,不过这还需要时间检验。
5.接种了四价苗,还需要接种九价苗吗?
目前,还没有充分的证据证明,完成一种宫颈癌疫苗注射后,再接种另外一种会有更多获益。理论而言,完成了二价、四价、九价疫苗中的任一种接种程序后,都可以预防70%以上的宫颈癌。不推荐再进行另一种HPV疫苗的接种。
不过,对于很想要得到更加全面保护的女性,现已接种过疫苗,还想接种九价疫苗也是可以的,可以在上次接种完成一年再接种。

其实,HPV感染非常普遍,只要开始性生活,一生中被HPV感染的概率非常高,性活跃期妇女HPV感染率约为50%~80%。并非感染了HPV就一定会发展成宫颈癌,50%~90%的感染可在数月至2年内被免疫系统清除,不会导致长期的危害。
HPV是一种双链DNA病毒,属于嗜上皮细胞病毒,通过特异性感染人的黏膜上皮及皮肤组织,引起上皮组织的增生。迄今发现的HPV有100多种亚型,其中40多种亚型和生殖道感染相关。
和宫颈癌相关的HPV,可分为低危型和高危型两类。较常见的高危型有第16、18、31、45、52及58等亚型;其中16和18两个亚型属于首恶之徒。国内研究显示,超过84.5%的宫颈癌由HPV16和HPV18这两个亚型病毒感染后导致的。
HPV主要通过性接触传播,所以有性生活的女性都存在感染致癌性HPV的风险。此外,HPV的感染还可通过直接接触感染。有数据显示,HPV感染在女性中较为普遍,在一生中的某个阶段,每5个女性中就有4个会感染。若感染的是高危型HPV,则有可能进展为宫颈病变甚至发展成为宫颈癌。
自2006年美国默克公司Gardasil和Cervarix两种四价预防型HPV疫苗被获准用于临床以来。Gardasil9(美国默克,Merck)和Cervarix(英国葛兰素史克)等不同的预防型HPV疫苗相继获批上市,并在全球100多个国家推广,普遍接种后可望预防90%的宫颈癌、外阴癌、阴道癌和肛门癌。
2007年,澳大利亚做为首个为12~18岁女孩儿和年轻女性提供免费四价疫苗接种的国家,使得21~30岁女性中生殖道疣发生率从2007年的11.3%下降至2011年的3.1%,迈出了免费接种HPV疫苗第一步,为降低HPV感染和提高HPV疫苗接种率等方面做出了重大贡献。
从2016年7月二价HPV疫苗(希瑞适®)获得我国国家药品监督管理局批准批准上市之后,
四价HPV疫苗(佳达修®)和九价HPV疫苗(佳达修9®)也分别于2017年5月和2018年4月于我国上市。
2019年12月31日,国家药品监督管理局批准厦门万泰沧海生物技术有限公司的双价人乳头瘤病毒疫苗(大肠杆菌)(商品名:馨可宁(Cecolin))上市注册申请,该药是首家获批的国产人乳头瘤病毒疫苗,适用于9-45岁女性。
据厦门万泰官网介绍,厦门万泰沧海生物技术有限公司(以下简称“厦门万泰”)是一家集研发、生产、销售于一体的创新型疫苗企业,总部和生产基地设在中国厦门。
通过与厦门大学国家传染病诊断试剂与疫苗工程技术研究中心(以下简称“NIDVD”)合作,厦门万泰利用DNA重组技术在大肠杆菌中表达蛋白的核心平台,使之应用于疫苗生产。基于这个平台,世界上第一个戊肝疫苗--益可宁®于2012年10月在中国上市, 宫颈癌疫苗—馨可宁®(HPV16&18两价)已于2019年12月在中国上市,HPV九价疫苗正处于II期临床试验阶段。
参考资料:
国家药监局网站,首个国产重组人乳头瘤病毒疫苗获批上市
九价宫颈癌疫苗来了 告诉你想知道的,江苏卫生保健 2018,(07),24-25
有关宫颈癌疫苗的那些事,农村百事通 2018,(05),52-54
子宫颈癌疫苗新进展,世界最新医学信息文摘 2019,19(57),52-52+54 DOI:10.19613/j.cnki.1671-3141.2019.57.024
我室夏宁邵教授团队在JNCI发表双价人乳头瘤病毒疫苗三期临床试验期中分析结果,分子疫苗学和分子诊断学国家重点实验室(厦门大学)网站。















