8月31日全球首款CAR-T正式通过FDA审批上市让全球狂欢细胞免疫治疗新时代的到来。
然而不到一周之后,FDA因安全原因紧急叫停法国生物科技公司Cellectis正在进行的CAR-T试验。该公司首个人体试验对象是一名78岁患急性浆细胞样树突状细胞肿瘤(BPDCN)的患者,该受试者是在接受首次注射后8天去世,死亡原因是细胞因子释放综合征以及毛细血管渗漏综合征。

消息一出,Cellectis公司股价应声下跌30%,市值瞬间蒸发4亿美元。而有趣的是,此前诺华公司的CAR-T疗法通过FDA审核时,股价也并未应声出现大规模的上涨情况。
早在2017年2月7日,Cellectis公司就宣布其通用型CAR-T疗法UCART123获得了美国FDA的批准,进入临床试验。这也是第一款获美国FDA批准进入临床试验的此类产品。
而现在,该产品的研发遭受了严重挫折。
事实上,这并不是CAR-T研发实验第一次导致患者死亡的案例。Juno、Kite等公司在此前的CAR-T疗法研发过程中均有导致患者死亡的情况发生。
那么,全球CAR-T疗法研究进展究竟如何?目前国内外都有哪些公司正在进行CAR-T疗法的研发?在强烈副作用的隐忧下,CAR-T疗法此后的市场前景究竟如何?CAR-T疗法还面临着哪些挑战?我们进行了一次全面的梳理。
(以下内容参考中金公司:《生物创新系列之七:CAR-T 细胞治疗,血液肿瘤大放异彩》)
CAR-T属于肿瘤免疫治疗,是指应用免疫学原理和方法,提高肿瘤细胞的免疫原性,激发和增强机体抗肿瘤免疫应答,从而抑制肿瘤的生长。由于其毒副作用小、疗效明显等特点,肿瘤免疫治疗有望成为继手术、化疗、放疗和靶向治疗后,肿瘤治疗领域的一场革新。
肿瘤免疫疗法目前包括细胞因子、肿瘤疫苗、过继性细胞治疗、溶瘤病毒、免疫检查点阻断几种主要的治疗方法。
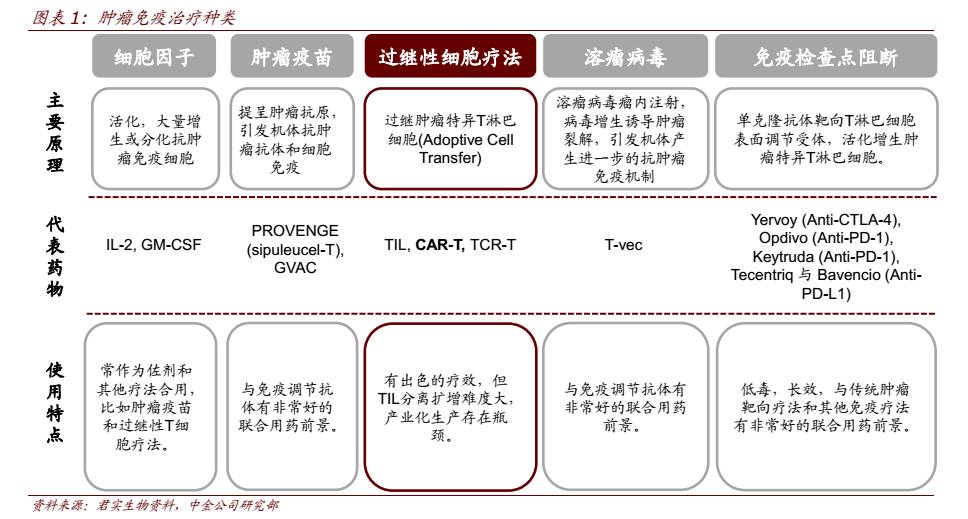
CAR-T 细胞治疗
:
不受 MHC 分子限制,肿瘤识别和杀伤更高效
细胞免疫疗法主要指
过继性细胞治疗(ACT)
,可分为非特异性和特异性,前者包括 NK、 CIK 等,后者包括 DC-CIK、TCR-T、CAR-T 等。
CAR-T 疗法(Chimeric Antigen Receptor T-Cell immunotherapy
)全称嵌合抗原受体 T 细胞免疫疗法
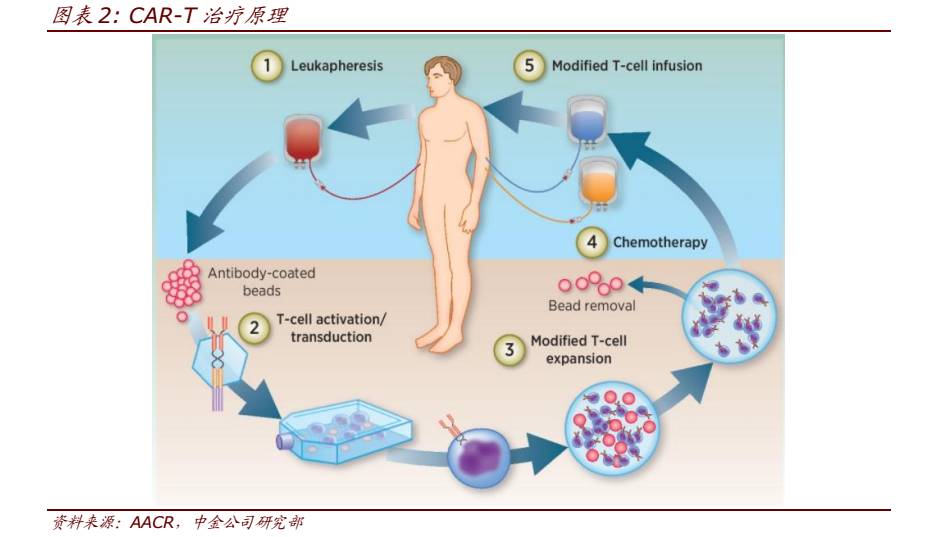
。其原理是将病人体内取得的 T 细胞,用基因工程的方法经激活、转染、修饰、扩增后,重新注射到病人体内,通过激发人体自身的免疫系统来消灭肿瘤。
相比于 TCR-T 细胞治疗,CAR-T 不需要识别 MHC 分子。由于 CAR-T 克服了 MHC 的限制性,可更有效的杀伤抗原特异性的肿瘤细胞,减少了由于肿瘤降低 MHC 分子表达而造成的免疫逃逸,同时具备抗原抗体结合特异性好、亲和力高的优势。
此外,由于打破病人对于 MHC 的限制后,CAR 改造的 T 细胞相对于天然 T 细胞表面受体 TCR 能识别更广泛的目标。
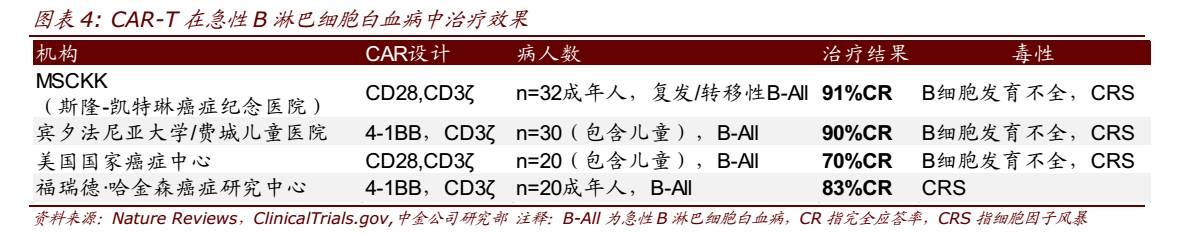
CD19靶向的 CAR-T 细胞在 B 细胞恶性肿瘤的治疗中表现惊艳。在已有的 CAR-T 治疗中来看,靶向 CD19 的 CAR-T 细胞研究的最多也最成熟。全球范围来看,已有多项 CD19 靶向的二代 CAR (CD28/CD3ζ)和三代 CAR (CD28/CD3ζ/41BB)开展对非霍奇金淋巴瘤 (NHL)、急性 B 淋巴细胞白血病(B-All)、慢性淋巴细胞白血病(CLL)、滤泡性淋巴瘤(FL)、 弥漫性大 B 细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)等血液肿瘤的临床试验,且表现出优异的疗效。
除靶向 CD19 外,越来越多的新型靶点的 CAR 结构开始应用于临床治疗。

CAR-T 细胞治疗
:
乐观前景下挑战与机遇并存
致死性引发担忧。
2017年3月,CAR-T 治疗的领头羊之一 Juno 因临床试验中出现多例脑水肿病人死亡而正式宣布放弃 CAR-T 产品 JCAR015 的II期临床研究。2017 年 5 月 Kite 制药 CAR-T 疗法 KTE-C19 同样出现一例脑水肿患者死亡,对于已提出 BLA 申请的 KTE-C19 无疑会产生负面影响。因此除疗效外,对 CAR-T 毒副作用的预防和处理也成为决定该技术能否上市的关键因素。
目前已知 CAR-T 治疗可能带来的副作用包括细胞因子释放综合症(CRS,Cytokine release syndrome)、神经毒性(Neurological toxicity)、脱靶效应(On-target/off-tumor recognition)、 全身性过敏反应(Anaphylaxis)等。

1) 药物免疫抑制:如上所述,对于 CD19 特异性 CAR-T 治疗最常见副作用 CRS 可用托珠单抗阻断 IL-6R,这种手段已证明能立刻缓解发热、低血压等 CRS 症状。皮质激素类药物(如地塞米松)也可作为缓解 CRS 的药物,但使用长期系统性糖皮质激素会削弱 CAR-T 细胞的持久性。
2) 对细胞加入“自杀基因”修饰:考虑到 CAR-T 副作用的不可预知性,已有尝试在 CAR-T 细胞中加入“自杀基因”(或“分子开关”)来做到可控凋亡,即令其表达一个可通过外源物质诱导的细胞死亡信号。例如单纯疱疹病毒胸苷激酶(HSV-TK)可使细胞在接受更昔洛韦治疗诱导下死亡。
正常情况下机体免疫系统能识别和杀伤恶变的细胞,从而清除肿瘤细胞或控制其生长。但是在机体免疫选择压力下,肿瘤细胞可以依靠自身的高突变特性,逃避免疫监视,逐步建立起免疫抑制微环境,以抵抗和抑制机体抗肿瘤免疫反应。
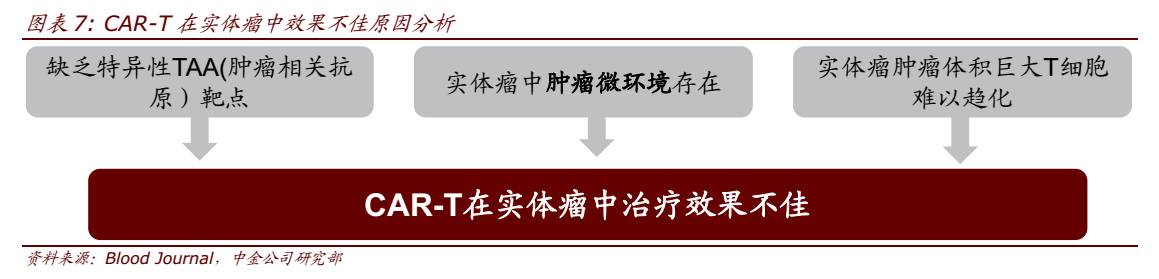
由于实体瘤中肿瘤微环境的存在,往往 CAR-T 细胞还未达到靶细胞处就已经失活。此外,由于实体瘤中缺乏特异性的 TAA (肿瘤相关抗原)靶点以及肿瘤体积巨大,T 细胞难以趋化等因素,使得 CAR-T 在实体瘤的治疗过程中挑战重重。
新型 CAR-T 设计改造目标
:
减少脱靶效应&增强疗效是核心
► 避免肿瘤抑制和逃逸:针对实体瘤中肿瘤微环境等情况,目前已有多种针对 T 细胞改造的,目前尝试较多的一个方向是将 CAR-T 与免疫检查点抑制剂结合起来。例如,CAR-T 与 PD-1/PD-L1 单抗联合用药或直接通过基因编辑敲除 T 细胞上的 PD-1 等方式。目前已有很多研究组在尝试开发抗 PD-1/PD-L1 或 CTLA4–CD80/CD86 信号通路的 CAR-T, 此类增强 T 细胞对肿瘤免疫的防御力的改造方式被称作“Armored CAR”。未来的 T 细胞很可能会包含多种形式的免疫检查点阻断以增强疗效。
► 增强输送能力:CAR-T 细胞在目标位点的积累量对其临床效果至关重要,特别对于实体瘤来说,“归巢”是其治疗关键因素。除局部给药以外,通过一些增强 T 细胞运输能力的设计也有望达到此效果。其中,细胞因子受体-配体结合作用是一种重要的机制,表达有细胞因子受体的 CAR-T 细胞进入肿瘤组织的能力能够得到增强。
► 增强特异性:具有更强特异性的 CAR-T 细胞能在不影响疗效的同时防止脱靶毒性。目前已出现在传统 CAR 结构上进行多样化改造的新型 CAR-T。包括:
1)
双 CAR 双靶,例 如 CD19 和 CD20,做两个 CAR 用一个 T 细胞来表达;
2)
双靶点 CAR,如将 CD19/CD20 融合起来,通过一个 CAR 传递下去,可以节省空间且提高敏感度;
3)
组合抗原,双 靶只有同时识别抗原后才能激活细胞内启动原件;
4)
时间上双 CAR,先识别肿瘤组 织里的一个抗原,激活转录因子后再激活真正的 CAR,有时差性的特异性等。
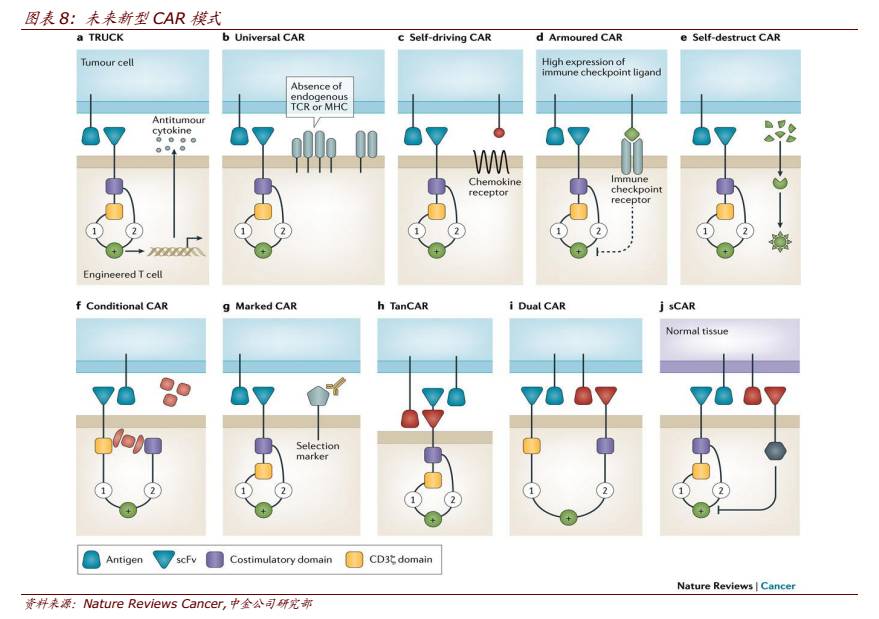
不同于传统的药物,CAR-T 细胞因其特殊的性质如何进行监管也成为一个难点。首先 CAR-T 细胞是活体细胞,因此受细胞治疗相关规定的管理;另一方面,因 CAR-T 均受基因工程改造,同样也属于基因治疗产品。

与美国 FDA 不同,欧盟的 EMA 发布了专门的文件将基因改造后的细胞归类为“医疗产品” (Medical Products)。2016 年 12 月中国国家食品药品监督管理总局药品审评中心发布关于《细胞制品研究与评价技术指导原则(征求意见稿)》的通知,根据征求意见稿,细胞制品将按与药品一致的评审原则处理。随着未来美国 FDA 关于细胞治疗的具体监管细则的出台,中国 CFDA 较大可能会参考和借鉴美国细则。
目前 CAR-T 细胞在制备过程中遇到最大的问题是如何解决污染
。目前为止,CAR-T 治疗还属于个性化治疗,不存在大规模生产。病人在常规采血后,医药公司或者科研单位运用冷链技术来进行运输和批量生产,之后再返回医院。在整个过程中主要问题是防止污染。
未来自动化与智能化是大趋势。目前 CAR-T 制备及其成本较高,通常情况下制备一个病人的 CAR-T 细胞就需要2周左右,远远不能满足商业化需求。目前关于 CAR-T 的商业化生产具体规范仍未出台,在放大生产的过程中,由原本的开放式/半开放式转为封闭式生产,缺少合格的自动化生产试剂等挑战下,如何实现商业化生产也成为未来 CAR-T 全面发展需要解决的问题。

国内细胞免疫治疗的发展紧跟美国。2016 年来自中国的 CAR-T 临床试验申请数量仅落后于美国,领先于欧洲、日本等传统强国。受 2016 年 5 月“魏泽西事件”影响,国家卫计委一度紧急叫停国内所有细胞免疫治疗的临床应用。2016 年 12 月 16 日,国家食品药品监督管理总局药品审评中心发布关于《细胞制品研究与评价技术指导原则(征求意见稿)》的通知,根据征求意见稿,细胞制品将按与药品一致的评审原则处理。随着监管力度的加大和门槛提高,国内具有技术储备的 CAR-T 研发企业有望迎来重大发展机遇。
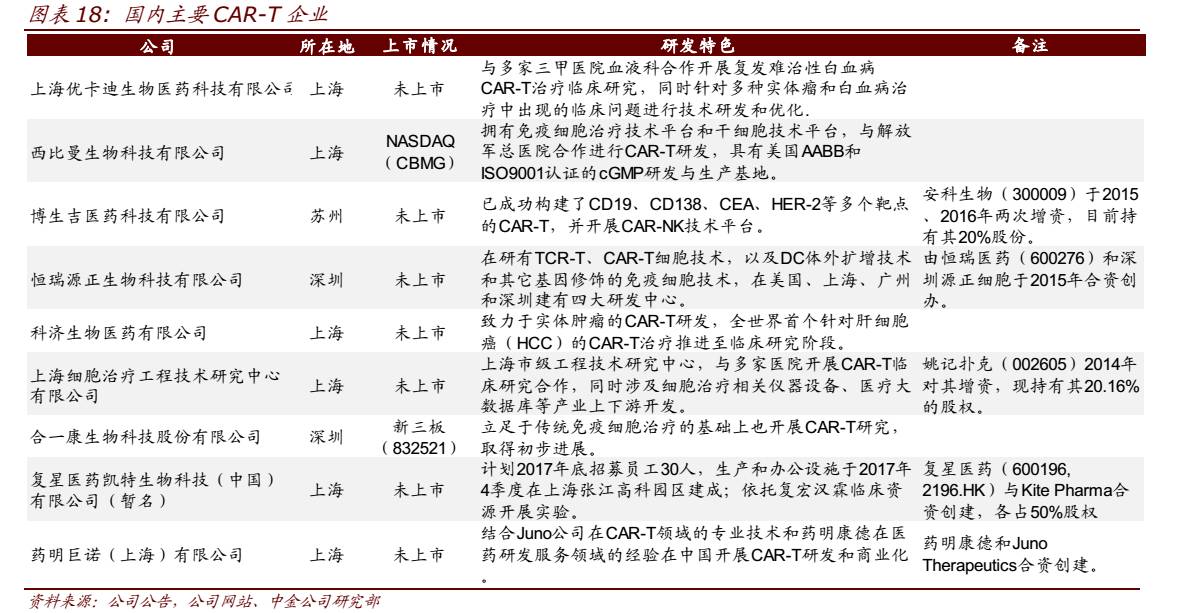
目前国内已有多家企业 CAR-T 研发项目推进至临床阶段,进度领先的有优卡迪、西比曼、科济生物、博生吉等;除传统针对血液肿瘤的 CAR-T 细胞外,科济生物针对肝细胞癌的治疗、以及博生吉针对 CAR-NK 技术的开发也颇具特色。此外,复星医药与国际巨头 Kite Pharma 成立复兴凯特生物科技有限公司、药明康德与 Juno 合作成立药明巨诺(上海)有限公司,志在打造成中国领先的细胞治疗公司。
CAR-T 全球血液肿瘤市场有望达 117 亿美元
目前 CAR-T 细胞治疗仍然集中在血液肿瘤治疗。考虑到 CAR-T 用于实体瘤的治疗进展较慢,且仍存在许多技术上的难题,短期上市可能性较小,本篇报告仅对 CAR-T 细胞治疗用于血液肿瘤的市场空间做出详细预测,主要考虑白血病、淋巴瘤和多发性骨髓瘤三个适应症。此外,考虑到目前 CAR-T 已有的实验数据仍较短暂,对于治疗后长期复发率还未知,所以认为短期内 CAR-T 较难取代干细胞移植的地位,仍为现有其他方法治疗无效后的选择。
经测算,淋巴瘤仍是 CAR-T 治疗的主要战场,未来市场空间有望达 59.0 亿美元,白血病市场空间有望达 35.9 亿美元,多发性骨髓瘤市场空间有望达 21.9 亿美元,CAR-T 细胞治疗在全球血液肿瘤市场空间合计达 116.7 亿美元。
考虑到目前血液肿瘤一线化疗、干细胞移植等治疗方法下患者生存质量较差且复发率高,随着 CAR-T 技术不断成熟,未来有望逐步走向血液肿瘤的一线治疗。此外随着实体瘤技术的不断突破,未来 CAR-T 技术有望打开数百亿美元级别市场空间。
CAR-T 国内血液肿瘤市场有望达 111 亿人民币
中国淋巴瘤与白血病亚型与欧美相比存在一定差异。淋巴瘤亚型中,我国 PTCL 明显高于欧美,FL 则明显低于欧美。我国白血病中 CLL 不足 5%,远远低于欧美~30%的比例,而急性白血病发病率更高、可选择的靶向药物更少,也就意味着 CAR-T 具备更大的市场空间。
考虑到国内骨髓移植费用在 35 万左右, CAR-T 在国内上市后定价 30~40 万可能性较大。CAR-T 细胞在国内淋巴瘤市场空间有望达 42.9 亿人民币,白血病市场空间有望达 56.4 亿人民币,多发性骨髓瘤市场为 11.5 亿人民币,合计 110.8 亿人民币。
与国际市场类似,随着技术不断成熟,未来国内 CAR-T 同样有望走向血液瘤的一线治疗,而实体瘤一旦突破,CAR-T 技术更是有望开拓数百亿人民币市场空间。
参考资料:
中金公司:《生物创新系列之七:CAR-T 细胞治疗,血液肿瘤大放异彩》
测序中国:《
事件经过| FDA叫停Cellectis通用型CAR-T疗法临床试验
》






