一项新的研究发现短暂的身体应激对健康和长寿有益,这关于一个称为自噬的过程。自噬作用是延长寿命的关键,也对身体从暂时应激状态下受益至关重要。
来源 ZME Science
撰文 Alexandra Gerea
翻译 榴莲君
审校 Takeko
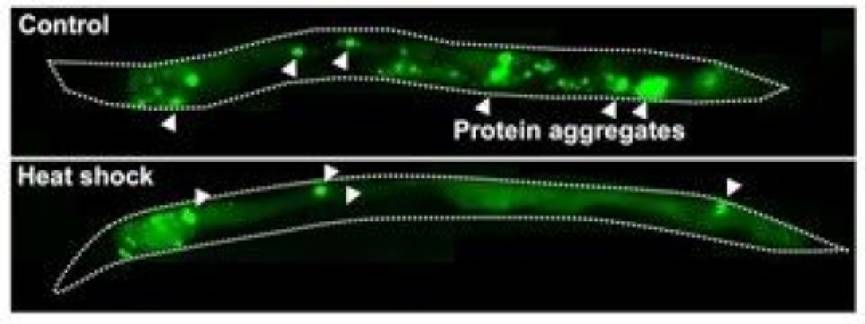
在患有亨廷顿氏舞蹈症的秀丽隐杆线虫模型中,短暂的热休克减少蛋白质聚集。[1]来源:CarolineKumsta博士
老话说的没错。生物学家在相当长的一段时间里已经知道了,短暂轻度的应激可使简单生物体和人体细胞在之后能够耐受更多压力。换句话说,那些没能杀死你的东西(且不会造成永久伤害的东西)会让你变得更强。现在,研究者认为他们终于知道了原因。关键是细胞自噬作用——细胞拆卸不必要或功能异常的组件的天然破坏机制。细胞通过回收利用细胞内旧的、破碎的或不需要的部分来重建新的部分。之前 Malene Hansen 博士就已经把自噬与长寿联系起来,他同时也是这项研究的通讯作者。
该研究团队将线虫于36℃的环境中饲养了一个小时,这温度远远地高于通常在实验室里的饲养温度。这种条件当然不适宜线虫的生长,但不危及生命。因为线虫的研究简单易行,研究人员很容易地证明了经过“桑拿”的线虫,其自噬作用增加。
汉森实验室(Hansen’s lab)的科学家及该研究的第一作者 Caroline Kumsta 博士说:“我们借助一类用于研究基础生物学的小型蠕虫——秀丽隐杆线虫(C. elegans),来研究自体吞噬在抗应激中的重要作用。秀丽隐杆线虫是非常好的模型系统,因为它们是透明的,所以你可以很容易地观察内部发生了什么。它们的多数基因和分子信号通路与人类在功能上相似,而且它们仅存活几周,这非常有利于对它们寿命的测量。
在这之后,他们推测这种应激反应或许可能帮助解决另外一个难题:对细胞生长过程非常不利的聚集蛋白质的积累。为了验证这种推测,Kumsta 使用患有亨廷顿氏舞蹈症(Huntington disease)的秀丽隐杆线虫模型设计了一个相似的实验。亨廷顿舞蹈症是一种遗传型疾病,随着患者年龄增长,神经元蛋白开始粘黏在一起形成大的团块,对细胞造成损伤。Kumsta 使患病线虫处于热应激的环境中,然后再研究线虫体内蛋白的积累程度,得到了相似的实验结果。
Hansen 表示,短暂的热应激有助于缓解蛋白质聚集的发现非常令人兴奋,因为这可能有助于开发出新的方法来减缓神经退行性疾病(如亨廷顿氏舞蹈症)病程的发展。该结果可能与阿尔茨海默病和帕金森氏症有关,它们同样是由具有聚集倾向的蛋白质积累而引发。
那么问题是:我们应该开始洗桑拿吗?正如实验室里的研究结果表明的:这只是一项线虫的研究,但人体细胞很有可能会有相似的反应。
Kumsta 开玩笑说:“很多人问我们,这是否意味着他们可以开始蒸桑拿或是做高温瑜珈,这可能并不是一个完全糟糕的想法——流行病学研究确实表明长寿与经常地洗桑拿有关。然而我们需要做更多的研究,来弄明白这是否像我们在线虫上观察到那样,与热应激引起的自体吞噬作用有利诱导有关。”
文章来源:
http://www.zmescience.com/science/news-science/makes-you-stronger-15022017/?utm_source=ZME+Science+Newsletter&utm_campaign=ea2f0cb459-ZME_Science_Daily3_6_2015&utm_medium=email&utm_term=0_3b5aad2288-ea2f0cb459-242630245&ct=t(ZME_Science_Daily11_8_2014)
查看更多分领域论文推荐,就到
www.keyanquan.net
也可提取下方二维码

论文基本信息
【题目】Hormetic heat stress and HSF-1induce autophagy to improve survival and proteostasis in C. elegans
【作者】Caroline Kumsta, Jessica T.Chang, Jessica Schmalz, Malene Hansen
【刊期】Nature Communications
【日期】15. Feb. 2017
【DOI】10.1038/ncomms14337
【摘要】Stress-response pathways have evolved to maintaincellular homeostasis and to ensure the survival of organisms under changingenvironmental conditions. Whereas severe stress is detrimental, mild stress canbe beneficial for health and survival, known as hormesis. Although theuniversally conserved heat-shock response regulated by transcription factorHSF-1 has been implicated as an effector mechanism, the role and possibleinterplay with other cellular processes, such as autophagy, remains poorlyunderstood. Here we show that autophagy is induced in multiple tissues of Caenorhabditiselegans following hormetic heat stress or HSF-1 overexpression.Autophagy-related genes are required for the thermoresistance and longevity ofanimals exposed to hormetic heat shock or HSF-1 overexpression. Hormetic heatshock also reduces the progressive accumulation of PolyQ aggregates in anautophagy-dependent manner. These findings demonstrate that autophagycontributes to stress resistance and hormesis, and reveal a requirement forautophagy in HSF-1-regulated functions in the heat-shock response, proteostasisand ageing.
【原文链接】http://www.nature.com/articles/ncomms14337















