BioArt按
:
此前有研究表明,MIIP基因调控肿瘤细胞的侵袭和迁移,然而具体机制并不清楚。10月16日,上海交通大学医学院附属第一人民医院
蒋玉辉
研究组等在
Nature Communications
杂志在线发表了题为“PKCε Phosphorylates MIIP and Promotes Colorectal Cancer Metastasis Through Inhibition of RelA Deacetylation”的研究成果,揭示了磷酸化依赖的MIIP调控NF-κB信号通路促进肿瘤侵袭转移的新机制。

论文解读:
以往研究表明迁移侵袭抑制蛋白
MIIP
(migration and invasion inhibitory protein ,MIIP)可以抑制IGFPB2介导的胶质瘤细胞生长和侵袭,并且可以结合组蛋白去乙酰化酶HDAC6(Histone deacetylase 6,HDAC6),影响胶质瘤细胞迁移【1】。然而 MIIP功能与肿瘤侵袭转移之间关系的具体分子机制有待阐明。在这项研究中,蒋玉辉课题组等研究人员发现
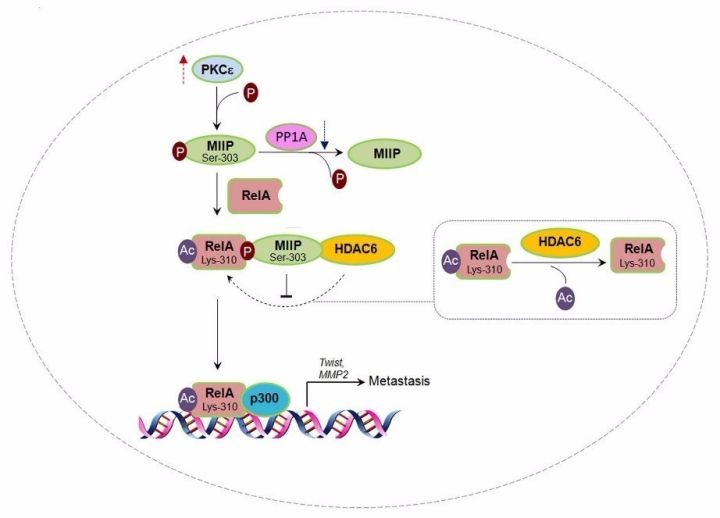
PKCε磷酸化MIIP可以保护RelA不被HDAC6去乙酰化,从而增强EFGR刺激的RelA转录活性和结肠肿瘤侵袭转移
(
下图
)。
此前,美国德克萨斯大学MD安德森癌症中心(University of Texas MD Anderson Cancer Center)
张微
研究团队发现了一种大小为45kDa、可以抑制脑胶质瘤细胞迁移和侵袭的蛋白,命名为迁移侵袭抑制蛋白(MIIP or IIp45)【2】。后续研究表明,MIIP的表达和多种肿瘤的恶性表形呈负相关【3】。有意义的是,该研究发现,在EGF刺激的条件下,PKCε依赖的磷酸化MIIP“变脸”为肿瘤细胞侵袭迁移的驱动因素。具体地,PKCε磷酸化作用在MIIP的保守位点Ser303,并促进其与RelA的结合,保护RelA不被HDAC6去乙酰化,从而促进下游基因(包括Twist,MMP2)的RelA K310乙酰化依赖性表达。
进一步研究还发现,除了PKCε活性外,MIIP磷酸化还受去磷酸化酶PP1的负性调节,并且这一对正负调节均作用在MIIP的保守位点,Ser303。因此,MIIP在不同的信号和环境条件下负调节HDAC6对RelA的作用,同时导致相反的结果。特别地,尽管可以在细胞浆中检测到MIIP Ser303磷酸化,但是MIIP/RelA复合体仅分布在细胞核中。以上结果揭示了MIIP在调控肿瘤细胞侵袭迁移方面的功能,并且这一功能可能基于其亚细胞定位而改变:在细胞浆中,MIIP对RelA的影响可能被胞浆中丰富的RelA而终止。
总的来说,这项研究揭示了在EGF-PKCε信号传导激活下MIIP调控肿瘤侵袭转移的新机制。同时很好的阐明了在不同的信号和环境条件下,MIIP对复合物HDAC6/RelA如何发挥不同的调节作用。
据悉,该论文的第一作者为复旦大学附属中山医院
陈涛
博士和上海交通大学医学院附属第一人民医院
李静婕
博士,
蒋玉辉
研究员、复旦大学附属中山医院
周平红
教授和美国Wake Forest Baptist Medical Center
张微
教授为共同通讯作者。本研究工作得到了国家中组部、国家自然科学基金委以及上海市科委的经费支持。
值得一提的是,今年6月,
蒋玉辉
课题组在
Nature Cell Biology
杂志上还报道了延胡索酸水合酶调节基因转录、影响肿瘤发生新机制(
详见BioArt此前的报道
:
蒋玉辉组NCB揭示延胡索酸水合酶调节基因转录、影响肿瘤发生新机制丨BioArt特别推荐
)
参考文献:
1.Ji, P. et al. Inhibition of gliomagenesis and attenuation of mitotic transition by MIIP.
Oncogene.
29,3501-3508 (2010).
2.Song SW, Fuller GN, Khan A, Kong S, Shen W, Taylor E, Ramdas L, Lang FF, Zhang W. IIp45, an insulin-like growth factor binding protein 2 (IGFBP-2) binding protein, antagonizes IGFBP-2 stimulation of glioma cell invasion.
Proc Natl Acad Sci U S A
;24,13970-13975 (2003).





