转移性和复发性隐匿性甲状腺癌的诊断是一个重大的挑战。核磁共振成像(MRI)作为一种非侵入性成像技术,因其高分辨率和多参数成像能力,在甲状腺癌的诊断中具有潜在优势。然而,目前的MRI造影剂缺乏对甲状腺组织的特异性,限制了其在检测隐匿性甲状腺肿瘤中的应用。
因此,开发新型、具有甲状腺癌特异性的MRI对比剂对于提高诊断准确性和改善患者预后具有重要意义
。
DNA纳米凝胶具有良好的生物相容性、多功能性和生物稳定性,在生物医学应用中具有很大的前景
,尤其是锰基纳米凝胶具有优异的顺磁性,在许多研究中被用作MRI造影剂。

鉴于此,
来自华中科技大学的明洁团队
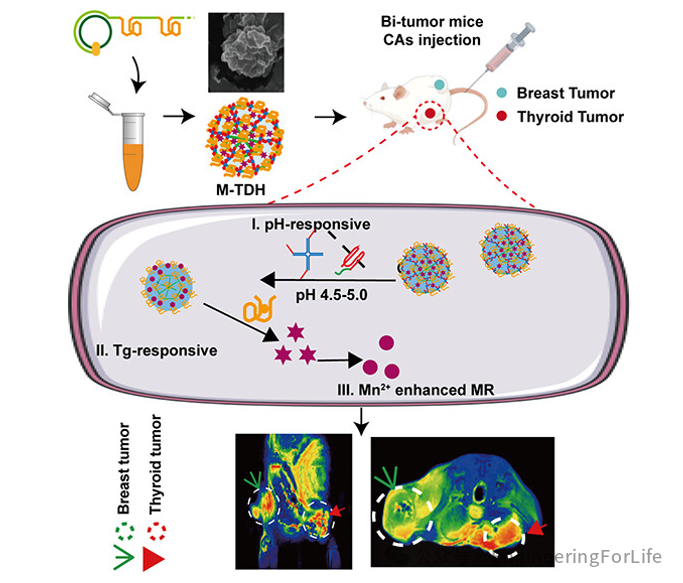
开发了一种装载Mn
2+
的
靶向甲状腺肿瘤的DNA纳米凝胶(M-TDH),用于T1加权MRI成像。这些纳米凝胶是通过滚环扩增(RCA)反应、支架组装和锰诱导生物矿化合成的。进入肿瘤组织后,Mn
2+
响应酸性pH值和甲状腺球蛋白(Tg)通过逐步释放,使特定部位的磁共振增强成像成为可能。
该体系的关键创新在于:(1)在酸性环境下,支架中的I-linkers通过Hoogsteen碱基配对形成三链体DNA结构,破坏纳米凝胶的稳定性并释放Mn
2+
;
(2)适体靶向和对Tg的识别促进甲状腺癌聚集,并促进纳米凝胶在靶部位的进一步切割释放;(3)大颗粒延长了血液循环时间,增加了靶部位的富集。
本文要点:
(1)
M-TDH的合成:
顺磁性Mn
2+
作为φ29 DNA聚合酶的辅助因子,在RCA反应中促进长单链DNA (ssDNA)的延伸。RCA过程在溶液中产生大量的双膦酸盐类似物PPi
4-
,自由的Mn
2+
离子与PPi
4-
相互作用形成不溶性的Mn
2
PPi,作为纳米凝胶的矿化骨架,而长ssDNA则作为矿化的生物模板。
利用生物矿化DNA纳米凝胶作为pH敏感的MRI造影剂,提出了一种针对甲状腺源性肿瘤的无创成像方法。
(2)
体外特性评估:
M-TDH在酸性环境中(如肿瘤微环境)
能够形成三链体DNA结构,破坏纳米凝胶的稳定性并释放Mn
2+
,增强MRI信号。Tg适配体的整合使得M-TDH能够特异性靶向甲状腺癌细胞。
细胞实验结果显示M-TDH在甲状腺癌细胞中显示出较高的摄取率,且对正常细胞的毒性较低。
(3)体内实验评估:
M-TDH在小鼠体内的分布实验显示,其在肝脏和肾脏中的信号增强,且在72小时后恢复到基础水平,表明M-TDH在体内的有效清除。
电感耦合等离子体-质谱分析显示,M-TDH在甲状腺肿瘤中的Mn
2+
含量高于乳腺肿瘤和其他主要器官,显示出良好的组织选择性。
(4)MRI成像性能:
M-TDH在甲状腺肿瘤中的MRI信号增强持续时间显著长于传统的造影剂,
表明M-TDH在甲状腺癌的MRI成像中具有潜在的应用价值。
参考资料:
https://doi.org/10.1021/acsami.4c19676
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正!






