众所周知,新版GMP中明确规定企业应建立企业内部标准,那么为什么要建立内部的质量标准,我们怎样建立这个质量标准呢?
大家可能都知道,国家标准(无论是GB、药典还是局/部颁标准)都是指最低标准,即在其有效期内都要符合的标准;而企业内部标准往往要求高于国家标准,以确保其在生命周期/有效期内仍能满足最低要求(可能是国家标准,也可能是客户标准)。那么我们怎么建立内部标准呢,内控标准和警戒限/行动限又什么关系呢?
1 概念
1.1 CQA(关键质量属性):
CQA是指物质(药品或活性成分)所具备的物理、化学、生物、微生物方面性质或特性,它应被限定在合适的限度、范围和分布之内,以确保符合预期的质量(ICH Q11)。
那么CQA等于质量标准吗?CQA是属于质量标准的一部分或一些特定的项目吗?
答案是否定的——CQA可以是质量标准的一部分,也可能根本就没有列入到质量标准中;同一个检验项目,对A产品可能是CQA,但对另一个产品可能不是,例如我们通常所说的溶出度。
质量标准是质量属性,但不一定是关键的;关键的属性是指那些对CPP和稳定性敏感的那些属性(例如降解物),也包括那些对制剂CQA有影响的那些原辅料的质量属性(例如粒度分布、晶型等对于固体制剂而言可能是)。
1.2 内控标准
企业内控标准是指企业内部为在生产过程中控制产品质量而自行制定的标准。
内控标准可能高于当时的国家标准和药典标准,目的是使企业的产品质量始终保持在一定的水平上,以更好地满足市场和用户的需要。
那么,是所有检验项目都要制定内控标准吗?
答案当然也是否定的,是否制定内控标准应与目的相适应。例如物料的氯化物、炽灼残渣等就没有必要制定内控标准。
1.3 警戒限和行动限
警戒限是一种警示限度,超出这个限度意味着系统可能将要发生偏离,需要引起关注甚至处理,以将这种潜在的危害/可能性消灭在萌芽之中。
行动限是一种警告限度,超出这个限度表明系统已经发生了偏离,并可能导致不符合的情况发生,应及时处理,必要时应停止该系统的运行,以避免不符合对产品质量产生不良影响。
1.4 OOS和OOT
OOS是指检验结果超出质量标准的规定。是一种发生在检验中的偏差,有严谨程序性的调查过程。 并不是所有超出标准都按照OOS的程序进行调查,典型的例如中间控制。
OOT是指检验结果超出正常的趋势。这种趋势可能通过统计分析得出,可以与警戒限/行动限关联,但并不一定关联。
OOT与警戒限/行动限的区别:
OOT的目的是为了确认检验结果的可靠性和调查发生趋势偏离的原因;
警戒限/行动限是为了避免系统发生偏离和不符合。
有时宁可错杀不能放过!
2 检验的目的
为什么说检验目的?因为检验目的直接决定了是否制定内控标准。检验目的主要有两种:确认符合性和指导生产、放行,前者我们没有必要制定内控标准,后者我们就需要考虑制定内控标准了。
2.1 确认符合性
确认产品/物料/中间产品/公用介质等符合要求,重要的是结论,而不是结果。包括:
Ø 鉴别
Ø 限量法的杂质检查,例如入厂API的氯化物、重金属等
Ø 一些非关键的质量属性 ,例如入厂API的残留溶剂(对于生产就不同了)、API有关物质中的工艺杂质
Ø 不影响制剂产品CQA的物料的质量属性,例如用于注射剂的API的粒度分布
2.2 指导生产、放行
确保结果对产品和生产的影响符合预期,或在控制的范围之内。包括:
Ø CQA检验项目,例如降解物
Ø 影响产品CQA的物料/中间产品/公用介质的检验项目,例如用于固体制剂的API的粒度分布
3 制剂产品内控标准
3.1 目的
确保产品在生命周期里质量持续符合预期和质量标准的规定,以确保患者用药的安全性和有效性。
3.2 影响产品生命周期内符合性的风险源有哪些?这里面就包括了:
Ø 内控标准
Ø 产品稳定性
Ø 产品均一性(批内产品个体差异,即生产能力)
Ø 检验的不确定度(单次检验差异,即检验能力)
下面是两个质量标准的模型:
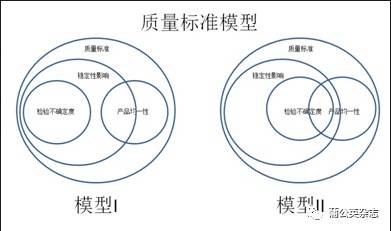
3.3 解释一下:
Ø 质量标准(产品符合性标准)应考虑稳定性、产品均一性和检验不确定度的影响。
Ø 稳定性检测数据中已经蕴含了检验不确定度;由于取样数量少代表性差,产品均一性可能会、但并不一定会影响稳定性数据。
Ø 根据检验方法不同,产品均一性可能会影响(例如投片法制备样品)单次检验的不确定度,也可能不影响(例如研磨法制备样品)。
Ø 当稳定性没有发生变化或变化较小时,影响质量标准的主要因素只有检验不确定度和产品均一性。
3.4 制订内控标准的原则
Ø 非CQA项可以不需要制定,使用国家标准即可。
Ø 对于稳定性较差的项目,应综合考虑稳定性(其中已经包括了检验不确定度)和产品均一性的影响。
Ø 对于稳定性较好的项目,可以综合考虑检验不确定度和产品均一性的影响。
3.5 含量内控标准的建立
3.5.1 三种计算方法
Ø 标准偏差法:2RSD(目的是为了折算到100%)
Ø 相对偏差法:(最大值-最小值)/平均值
Ø 95%置信限法:
3.5.2 检验不确定度
同一批产品不同检验员测定的结果
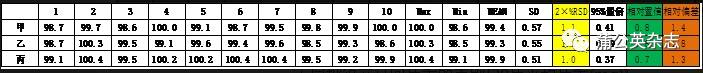
3.5.3 产品均一性
不同批次产品间片重的差别[20片平均片重(mg)]
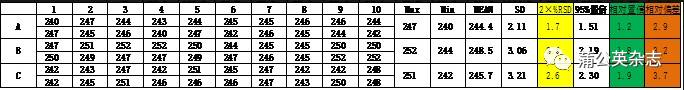
3.5.4 稳定性
不同批次产品稳定性测定的结果

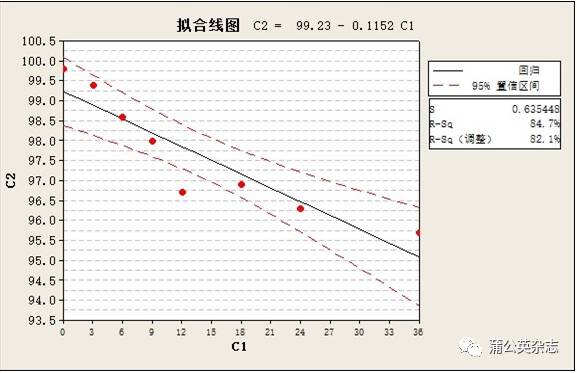
不同批次产品稳定性测定的结果(修正片重)

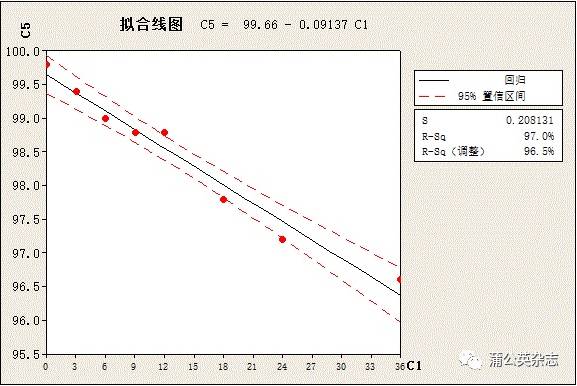
3.5.5 含量内控标准下限
Ø 存在稳定性下降趋势的产品
内控下限=标准下限+折片重稳定性下降值+均一性
例:以95%置信限计算上述最差结果
内控下限=90.0%+3.8%+1.9%=95.7%
Ø 不存在稳定性下降趋势的产品
内控下限=标准下限+不确定度+均一性
例:以95%置信限计算上述最差结果
内控下限=90.0%+0.8%+1.9%=92.7%
3.5.6 含量内控标准上限
内控标准上限=2T-LRT
式中LRT为内控标准下限
T为目标含量,按照药典要求理论为100%
中国的要求:含量在贮存期有下降趋势的,可以适当增加投料量,即T>100%。
3.5.7 含量内控标准的注意事项
Ø 内控标准与趋势限度:趋势限度体现的是生产控制能力,应在内控标准范围内。
Ø 内控标准与OOS:超标时放行、拒绝?
Ø 内控标准与警戒限/行动限:IPC片重检查可以设定行动限,超限重新调片重。
Ø 不折算片重/装量的检验方法,检验不确定度中已经包含了产品均一性。
3.6 有关物质内控标准的注意事项
Ø 自身对照法时,产品均一性影响几乎可以忽略不计;而外标法则必须要考虑。
Ø 检验不确定度重点考虑仪器间的差异,而不是进样差异和人员差异,尤其是对于低限度标准的杂质。
Ø 关注降解物,对于API工艺杂质不需要考虑。
Ø 只有标准上限,杂质95%置信限曲线应采用上侧线。
4 制剂原辅料内控标准
4.1 目的
确保使用受到控制的物料能够持续生产出符合预期质量的制剂产品。
所需控制的是,那些可能直接影响制剂CQA的CMA。
影响制剂CQA的因素:CMA、CPP、环境、包装、贮存。
4.2 物料API的内控
4.2.1 有关物质:
降解物:应确保生产出的制剂放行标准,需要考虑API的贮存,有一个客户标准,必要时再有一个厂内的复验标准。
工艺杂质:除非制剂有相应要求,已知的、未知的或总杂质,没有必要设置内控标准。
未知杂质:应不是降解物,确保制剂的未知杂质和总杂质。
4.2.2 外观
应考虑API本身的颜色对制剂的影响,尤其是液体制剂。必要时可以用UV-Vis控制。
4.2.3 晶型
一般药典/国家标准不控制,固体制剂可能影响BE和体外溶出度。控制方法:粉末X射线衍射、熔点、红外等。必要时应使用专属性强的方法。
4.2.4 粒度分布
一般药典/国家标准不控制,固体制剂可能影响BE和体外溶出度。控制方法:激光粒度、筛分法。
4.2.5 含量测定
较窄的范围没有必要内控,例如98.0%~102.0%。
4.3 辅料的内控
重点在于功能性控制,例如填充剂的粒度分布、粘合剂的黏度、缓冲剂pH值等。
特殊——十二烷基硫酸钠:
十二烷基比例差别大(含辛烷基、癸烷基、十二烷基、十四烷基等),可能影响溶出曲线。
5 制剂/API中间产品质量标准
5.1 目的
1)确保使用受到控制的中间产品能够持续生产出符合预期质量的API/制剂产品。
2)能够反映工序的重现性。
所需控制的是,那些可能直接影响API/制剂CQA的质量属性。
5.2 API中间产品的控制
5.2.1 有关物质
关键是特定杂质的控制
Ø 本工序和后续工序中难以去除的杂质;
Ø 在传递后生成的杂质不易除去的杂质;
Ø 影响后续工序收益的杂质;
5.2.2 含量
外标法含量测定与否取决于工艺和成本的需求,并不是必须的。
5.2.3 残留溶剂
确保所关注的残留溶剂是否除去,并不需要批批测,可以采用验证加抽检的方式。
5.3 制剂中间产品的控制
5.3.1 含量
应不超过制剂成品的标准范围,含量测定的目的是哪种?
Ø 指导生产?
Ø 工序确认?
用于指导生产往往结果可能是灾难性的,尤其是成品标准范围较窄的产品。这是由于取样的代表性和检验的不确定度造成的。
5.3.2 有关物质
只有那些在生产过程中CPP可能影响到有关物质的中间产品需要关注,例如工艺中有局浓或者高温降解的情况发生。
5.3.3 其他
Ø 粒度分布
Ø 外观(颜色)
Ø 水分
Ø pH
……
6 包装材料内控标准
6.1 与产品稳定性相关
Ø 粘合性能
Ø 密封性能
Ø 厚度/厚度均匀性
Ø 透光性能
Ø 注射剂相容性相关的溶出、脱落物
6.2 与包装工序相关
Ø 规格
Ø 上机性能
6.3 与销售相关
6.3.1 印刷性包材
Ø 色差
Ø 印刷质量
Ø 规格、样式和内容
——建议加编号和版本号控制
6.3.2 药品电子监管码
Ø 规格(尺寸)
Ø 可读性(使用抄码枪可以读出)
Ø 读数准确性(读出的数据是正确的)
Ø 产品一致性(前七位与申请药监码的一致)
6.3.3 运输牢固性能——产品与包材结合的牢固性
7 制药用水限度
7.1 目的
1)确保持续生产出符合生产能力的制药用水。
2)及时发现不良趋势。
对注射剂来说,那些可能影响制剂的CQA。
7.2 微生物限度
7.2.1 培养基筛选
需要根据水质情况确定选择使用哪类培养基:富营养培养基,还是低营养培养基。
7.2.2 样品量筛选
使用多少量用于检验合适?典型的细菌检测要求是30~300CFU/皿,我们应选择合适的水的数量,使检测结果有统计学意义。
7.2.3 计数
各国药典限度标准的单位都是CFU/ml,如果我们要按照这个标准报告,有很多结果将是“<1CFU/ml”,尤其是使用富营养培养基。
我们要根据样品筛选的量,考虑使用CFU/10ml、CFU/100ml这样的单位。
7.2.4 警戒限
Ø 要注意非洁净区取样所带来的干扰
Ø 要注意个别使用点的干扰,不常使用点应考虑定期排水
Ø 不能所有检测都低于警戒限,说明制定的警戒限基本没有什么意义
Ø 一般的制定原则可以是平均值加2或3倍SD,采用CFU/ml制定可能就没法计算了。
7.2.5 行动限
Ø 与警戒限有明显差别,否则没有意义了
Ø 与标准有一定差距,否则很危险
Ø 不应经常达到,警戒限要起到关键作用
Ø 例如限度的50%~80%
7.3 TOC
建议根据水质情况设定警戒限/趋势限。
注意环境干扰:检测环境、取样环境
7.4 电导率
建议设定制水的中间控制标准(行动限)
7.5 细菌内毒素
注射用水一般是注射剂细菌内毒素的主要来源,可以考虑定量法动态检测,并制定合理的行动限。
7.6 其他理化项目:
确认符合性检测,没有必要制定内控标准。
7.7 饮用水
7.7.1 检验项目选择:
对制水系统性能有影响的项目(负荷):碱土金属、氯离子、微生物限度等。
7.7.2 标准:
一是符合性、二是设备需求
8 环境监测和压缩空气内控标准
8.1 环境监测
可以考虑设定警戒限:
静态检测超限时,检查/更换过滤器、消毒;
动态检测超限时,生产结束后,确认空调还是生产的问题。
8.2 压缩空气
可以考虑设定警戒限,超限时,检查/更换过滤器
9 回收溶剂质量标准
回收溶剂标准并不一定要求符合新溶剂的标准,一般也很难达到其标准;新溶剂的检验项目也不需要都考虑进去,很多项目是为了控制溶剂生产用的,并不是工艺需求,而回收溶剂的标准更重要的是满足工艺需求。
9.1 外观颜色、黏度、馏程
至少要考虑外观颜色,这几项可以从侧面反应出回收溶剂中含有杂质量的多少。
9.2 紫外吸收
可以检测特定杂质或者总杂质,前者例如在某特定波长的吸收可能意味着有某种特定杂质没有除去;后者例如以新溶剂为空白扫描,考查溶剂的纯度。
9.3 水分
一般为必检项目,根据需要确定范围,尤其要注意有共沸溶剂的含水量。
9.4 GC
必须要考虑的检测项目,以确认溶剂的纯度,考查特定溶剂的残留情况,以及是否有异常溶剂出现,如果出现可能意味着有交叉污染的可能性。
9.5 HPLC
检测特定杂质用。
9.6 不挥发物
一般为必检项目,考查残留物,尤其是无机盐的残留。
ouryao-com·因为有你
















