
糖尿病患者通常面临着口腔溃疡愈合困难的挑战,这主要由高血糖水平导致的持续炎症、细菌感染风险增加以及血管生成受阻等原因导致。尽管局部治疗干预仍然是主要的治疗方式,但口腔环境的动态性,如持续的肌肉活动和唾液分泌难以维持药物的持续保留,从而限制了治疗效果。

鉴于此,
复旦大学陈峰教授联合同济大学赵新宇、郑龙坡教授
开发了一种新型多功能可溶性微针贴片(LHSQ-MN),该贴片由γ-聚谷氨酸(γ-PGA)和槲皮素(Qu)修饰的Mg-Zn层状氢氧化物盐(LHS)纳米片(LHSQ)组成,用于促进糖尿病口腔溃疡的粘膜愈合。
相关成果以
“Polyphenol-Modified Mg−Zn Layered Hydroxide-Contained Microneedle Patch Enhance Mucosal Repair by Remolding Diabetic Oral Microenvironment”
为题于2025年2月11日发表在
《Advanced Healthcare Materials》
上。
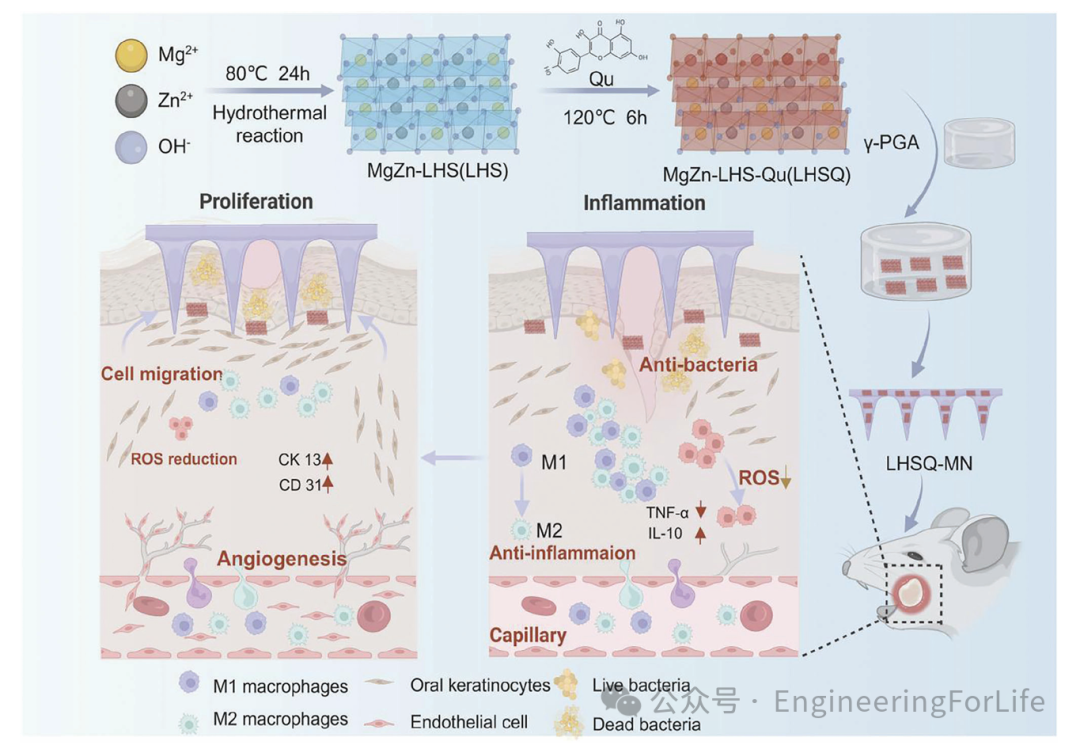
1.LHSQ的合成与表征
首先,作者采用水热法合成了LHS和LHSQ,并通过扫描电镜(SEM)观察其形貌,结果显示LHS和LHSQ均表现出由薄纳米片组成的皱褶形态(图2a-c)。能量色散X射线能谱(EDS)结果显示LHS中的Zn、Mg、O和C元素均匀分布(图2d)。傅里叶变换红外光谱(FTIR)结果显示Qu成功结合到LHS上(图2e)。此外,Zeta电位和紫外-可见光谱进一步证实了LHS表面改性成功。X射线衍射(XRD)图谱显示LHSQ由Zn
5
(OH)
6
(CO
3
)
2
和Mg
7
(CO
3
)
5
(OH)
4
·24H
2
O组成(图2f),然后作者通过X射线光电子能谱(XPS)进一步验证了LHSQ的元素组成,并确认了LHSQ复合材料中存在Mg
2+
、Zn
2+
和Qu(图2h-j)。
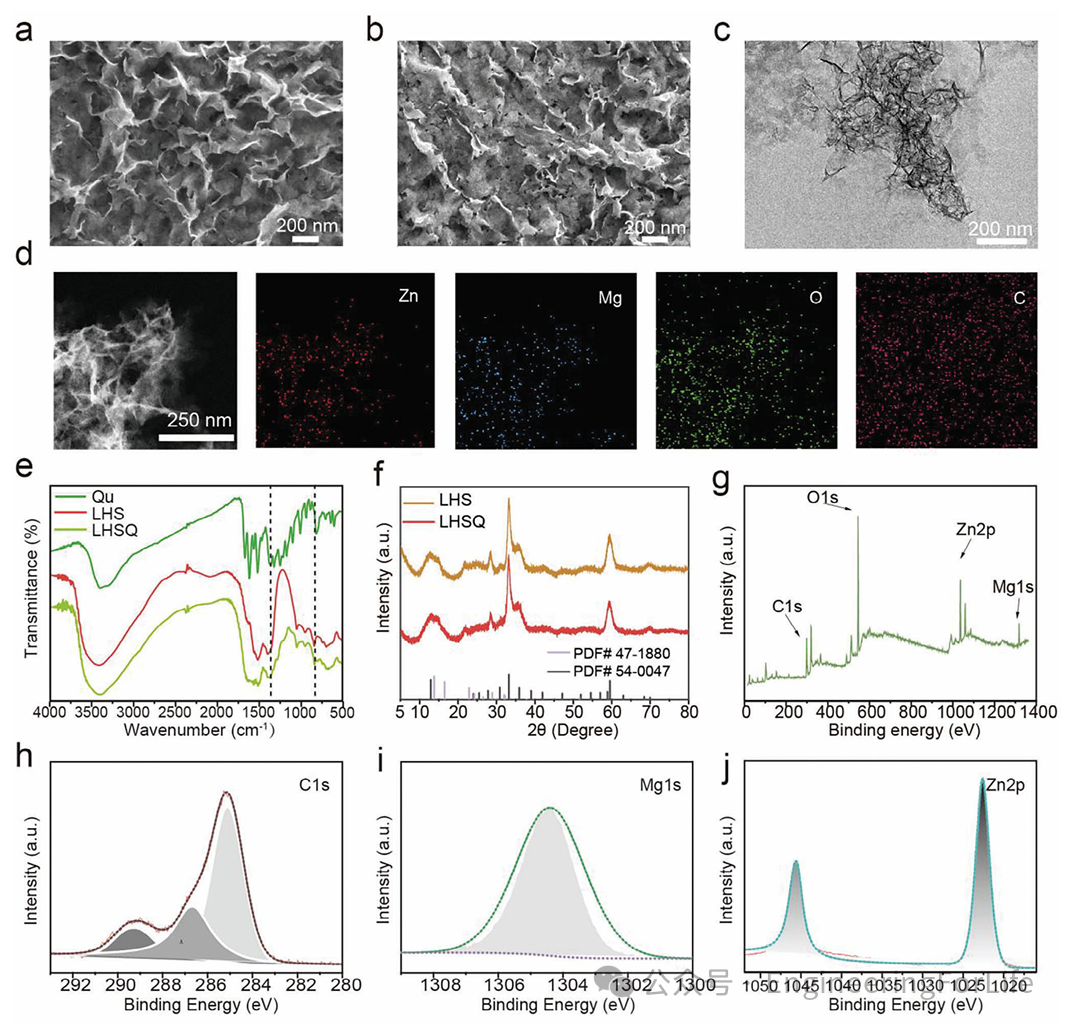
图1 LHSQ的合成与表征
2.LHSQ-MN的合成与表征
在作者之前的研究中,他们发现 γ-PGA 在冷冻干燥后具有良好的生物可降解性和强大的机械性能。因此,选择 γ-PGA 水凝胶作为制备微针(MN)的基质。首先,通过使用带有10×10针头阵列的微模具和溶剂浇铸法制备了LHSQ-MN 贴片,从而生产出各种微针贴片(图3a)。然后将混合物在40 ℃的烘箱中干燥过夜后,成功制备了LHSQ-MN 贴片。光学和SEM图像显示微针贴片具有高度为500μm、底径为200μm 的均匀锥形针头阵列(图 3b-c)。EDS结果确认LHSQ-MN中Zn、Mg、O和C元素的均匀分布,表明 LHSQ 已成功且均匀地结合到贴片中,能够用于粘膜愈合(图3d)。此外,机械性能是确保MN能够穿透皮肤组织并准确将药物或纳米颗粒递送到深层组织的重要指标,作者对LHSQ-MN贴片进行压缩测试,结果表明LHSQ-MN 具有优异的机械性能,有利于有效的粘膜穿透(图3e)。通过将LHSQ-MN放在75%湿度的封闭容器中评估其吸湿性并记录MN的形态,结果显示20分钟后,MN的尖端逐渐溶解,表明LHSQ-MN具有良好的生物可降解性(图3f)。
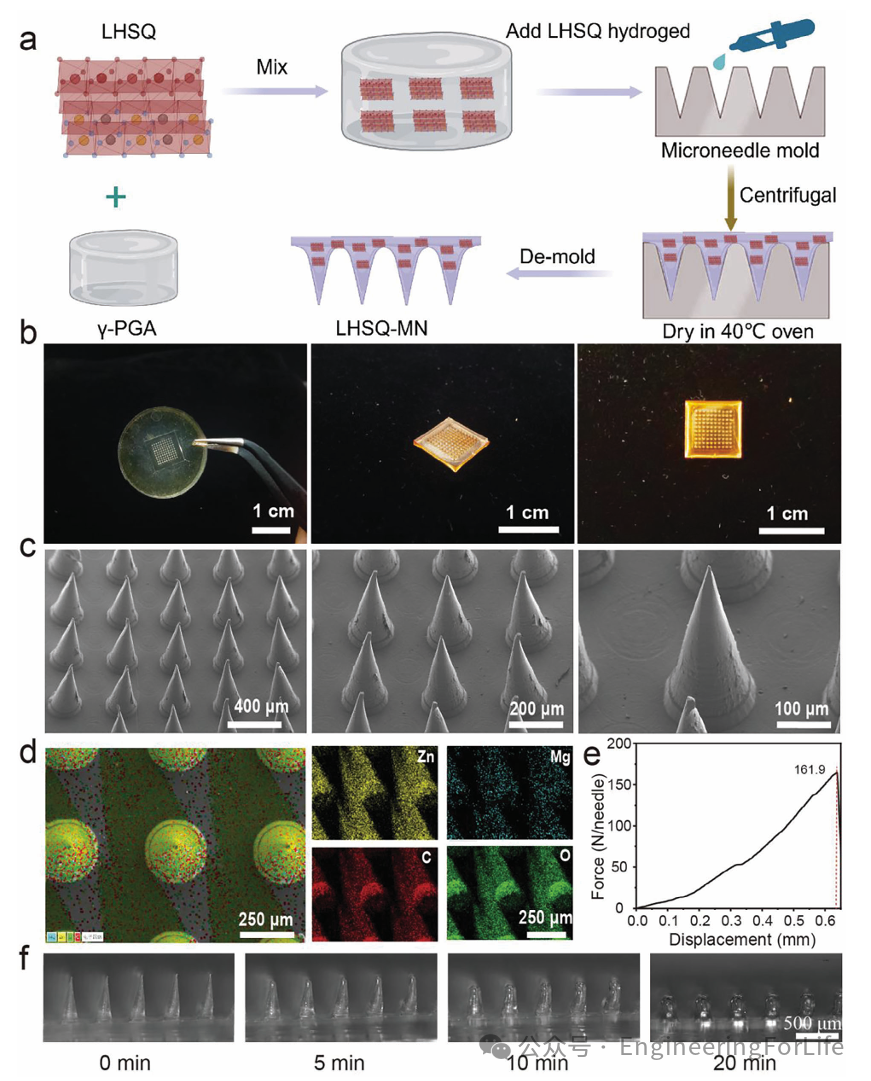
图2 LHSQ-MN的合成与表征
3.LHSQ-MN的体外抗菌性能
糖尿病口腔溃疡为细菌生长提供了适宜的环境,因为其高血糖水平和受损的黏膜屏障使得细菌容易繁殖和传播。因此,在设计口腔溃疡贴片时,抗菌性能是首要考虑的因素。为了评估LHSQ-MN的抗菌性能,作者选择了金黄色葡萄球菌(
S. aureus
)、大肠杆菌(
E. coli
)和变形链球菌(
S. mutans
)作为糖尿病口腔溃疡的代表性感染菌株,并采用平板计数法测量了不同MN样品的抗菌效果。光学照片显示,LHSQ-MN在低浓度(100 μg/mL)下对这三种细菌表现出最佳的抗菌效率(图4a)。与不含Qu的LHS-MN组相比,LHSQ-MN组的抗菌效果显著增强,这归因于Zn²⁺离子和Qu分子的协同抗菌作用,同时结果还显示了γ-PGA基质本身没有抗菌活性(图4b-d)。为了阐明其抗菌机制,作者使用SEM观察了与不同MN样品共培养后细菌的形态变化。在对照组中,三种细菌保持其形态,细胞膜光滑,而与LHSQ-MN共培养的细菌经历了广泛的损伤,包括细胞膜破裂或穿孔,这证实了其优异的抗菌性能(图4e)。
这些发现表明从LHSQ-MN释放的金属离子和Qu分子与细菌细胞发生相互作用,导致细菌基本成分的破坏和功能障碍,最终诱导细菌死亡并阻止其繁殖和增殖能力。

图3 LHSQ-MN的体外抗菌性能
4.不同微针贴片的毒性、增殖、迁移和血管生成能力
对于多功能敷料在组织修复中的应用,微针材料的生物安全性至关重要。作者首先评估了LHSQ-MN具有优异的生物相容性和血液相容性。其次,在糖尿病伤口的愈合过程中,由于高血糖对内皮细胞和皮肤角质细胞的不利影响,血管生成和细胞迁移受到损害。在先前的报道中,Mg
2+
和Qu通过刺激CDKs蛋白和VEGF信号通路来招募HUVEC,从而促进血管生成,刺激内皮细胞增殖,并改善细胞迁移和胶原沉积。因此,作者通过体外实验验证了LHS-MN和LHSQ-MN对细胞增殖的影响。结果显示,LHS-MN和LHSQ-MN在2天后都能促进细胞的增殖,其中LHSQ-MN在第3天对细胞增殖的促进能力比LHS-MN更强(图5a-b)。LHSQ-MN对细胞增殖的促进作用归因于Mg
2+
和Qu从MN逐渐释放到培养体系中。为了更深入地研究细胞迁移,作者进行了体外划痕实验。结果显示LHSQ-MN有效促进了细胞的迁移(图5c)。此外,Transwell实验进一步验证了其在体外促进细胞迁移的能力(图5f-e)。




