
世界上首批内源性逆转录病毒基因失活的幼猪(图片来源:eGenesis)
8月10日,《Science》期刊一篇在线文章再一次将杨璐菡拉入大家的关注视角。这位不久前刚刚荣获“2017年度全球青年领袖”的中国科学家作为通讯作者,发表了“利用CRISPR技术去除猪细胞内源性逆转录病毒基因”的最新成果,解决了猪器官异种移植的一个关键难题。
这一研究成果由美国eGenesis公司首席科学家杨璐菡、哈佛医学院的遗传学教授George Church联合浙江大学、云南农业大学、重庆第三军医大学及其他科研机构的科学家们共同完成。它对于移植医学意义重大,突破异种移植停滞12年之久的困境,为填补人体组织器官移植空缺提供了新的前进希望。

1异种移植的难题:免疫排斥、病毒感染
异种移植是指将一个物种的组织器官移植到另一个物种体内。它是解决器官移植“供不应求”的一大设想。其中,猪成了科学家们最为关注的对象,因为它们的器官大小与人体器官相对接近。而且,猪易于繁殖。但是,这一策略却面临两个重大挑战——免疫排斥(人与猪的生理差异大)和内源性逆转录病毒(porcine endogenous retroviruses,PERVs)。
内源性逆转录病毒是残留在猪基因组中的病毒序列。虽然该病毒对猪本身没有影响,但是在异种移植过程中,却存在感染宿主的可能性。
先前,科学家们已经成果将来源于猪胰脏器官内的细胞植入糖尿病患者体内,且并未发现PERV感染的迹象。但是,这一尝试移植的猪细胞数量很少。对于移植完整的猪器官,不仅仅面临免疫排斥的难题,还有造成PERV病毒在患者体内传播、感染的风险。
为了避免风险,科学家们希望能够利用基因编辑手段将猪基因组中的病毒序列失活。但是,这一策略仅仅只在实验室培养的细胞系上验证过,并没有在活体动物中实践。
2借助CRISPR,精准编辑猪基因组
柏林Robert Koch研究所的病毒学家Joachim Denner曾尝试利用锌指核酸酶(ZFN)编辑技术剔除猪细胞内的PERV病毒基因,但是却因为精准度不高损伤细胞本身而终止。
幸运的是,“魔剪”CRISPR得到了快速的发展和应用。George Church和杨璐菡相信,CRISPR技术在向导RNA(gRNA)和Cas酶的“高效搭档”下能够精准编辑猪细胞的基因组。
2015年,他们共同创立公司——eGenesis,专注于器官移植领域。杨璐菡出任公司的首席科学家。同一年,他们证实,CRISPR确实能够在猪基因组的62个位点敲除残余的PERV基因。但是,当时研究团队使用的是一种“不朽”的猪肾脏细胞(可以在培养皿中无限地生存和分化)。为了构建PERV病毒失活的猪,他们需要对提取自活猪体内的细胞进行遗传改造。

3CRISPR+克隆技术,收获世界首批无内源性病毒基因的猪仔
在最新的工作中,他们完成了这一突破,在活体猪身上证实了可行性。
研究团队首次证实,当猪细胞与人类细胞功能培养时,猪细胞内的内源性病毒会感染人类细胞。而且,被该病毒感染的细胞会再次将病毒传播给其他健康人类细胞。这无疑重申了异种移植病毒基因处理的重要性。
随后,他们对猪成纤维细胞基因组中的PERVs序列进行了定位和分析,共找到25个拷贝。以尚在子宫内的猪胚胎为研究对象,采集细胞对其进行CRISPR编辑。但是,这些细胞很脆弱:当病毒序列失活效率达到90%以上时,被编辑过的细胞将不能正常发育(这很可能与其DNA受损与关联)。
为了解决问题,研究团队配制了包含有DNA修复、促进细胞发育的“化学鸡尾酒”。最终,他们在确保细胞正常生长、分化的前提下实现100%的病毒剔除效率,获得了PERV病毒失活的猪细胞。
为了获得猪仔,研究人员随后采用了一种传统的克隆技术——体细胞核移植,他们将这些经过编辑的细胞核转移至来源于中国屠宰场猪卵巢中的卵细胞内。最终,他们将培育的胚胎植入代孕母猪的子宫内。
“在我们研究之前,‘编辑猪’的思路面临着很大的不确定性。”杨璐菡表示。现在,他们证实该技术能够产生活的、健康(至少目前看起来是)的猪,且成功率达到了1%(每100个植入胚胎最终生育出一个猪仔,与克隆技术本身的成功率一致)。
迄今为止,他们共培育出37只内源性逆转录病毒灭活的小猪,目前存活15头。理论上说,它们的寿命和普通猪的寿命一样长。
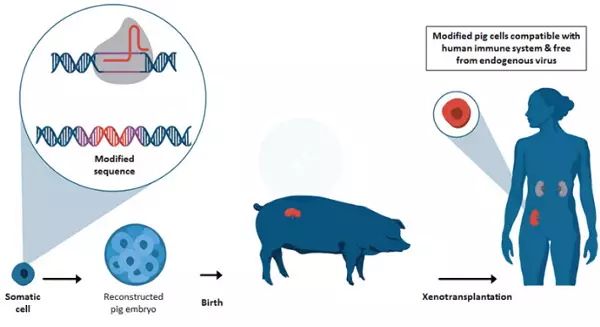
最新研究采取的策略(图片来源:eGenesis)
4其他学者的声音:增加异种移植的复杂性?
考虑到PERV病毒的风险并不确切,有科学家担心,这样的基因操作会增加复杂性,提高了异种移植的难度。“如果美国FDA批准‘PERV-free猪’用于临床治疗,这无疑延长了异种移植的准备时间,对急需器官移植的患者而言并不有利。” 阿拉巴马大学的移植免疫学家David Cooper认为,“同样,它还会增加临床试验的成本。”
“目前,我并不认为PERV很值得忧虑。” 摩马里兰大学医学院的心脏移植外科医生Muhammad Mohiuddin解释道。他的团队正在与United Therapeutics公司合作进行猪心脏异体移植的研究项目。他计划将猪的心脏移植入狒狒体内,去年研究团队发文揭示,这一器官能够在狒狒体内正常运作超2年。那么,他会对PERV进行编辑吗?“如果FDA要求如此,我们肯定是会照做的。” Mohiuddin回答道。
5下一个目标:解决免疫排斥
很显然,PERV并不是猪器官异种移植的唯一挑战。未来,科学家们需要去除引发免疫系统排斥的相关基因,需要插入阻止血液有毒反应的基因。
eGenesis正朝着这些方向努力。“相比于PERV的危险,解决免疫排斥问题的挑战性更大。”杨璐菡表示,“距离这些经过基因编辑过的猪器官真正投入临床试验,还需要几年时间。”
参考资料:1)CRISPR Opens Up New Possibilities for Transplants Using Pig Organs
2)Scientists use gene editing to eliminate viruses in live pigs
3)CRISPR slices virus genes out of pigs, but will it make organ transplants to humans safer?
本文系生物探索原创,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源生物探索。
















