
2024已进入下半场,金秋九月天气逐渐变冷,小伙伴们记得多穿衣服哦~9月正是新学期开始的时候,大家的课题步入正轨了吗?课题遇到瓶颈,研究癌症没有思路,文章写不出来?今天馆长就给大家介绍一篇研究“基于代谢途径的子宫内膜癌亚型”的文章,跟着大佬走,文章课题都不愁,那么馆长就带大家来看看这篇文章有何亮点以及创新之处吧~
1、子宫内膜癌代谢通路亚型分类
本文章的特色就是,揭示了子宫内膜癌(EC)在转录组学和蛋白组学水平上表现出的代谢重塑和异质性。将子宫内膜癌分为三种异质亚型,研究具有不同的代谢特征,预后基因组改变和对各种治疗的敏感性。
2、阐明代谢表现的潜在内在驱动因素
本文章还重点研究了相关基因的种系突变。另外对基于代谢途径的子宫内膜癌亚群聚类
进行
高通量组学数据分析和探索,为新药开发提供了道路,为推进精准临床治疗提供了帮助。
3、机器学习算法的巧妙运用
本文章的特色之一是利用了机器学习算法,LASSO和随机森林算法的应用确保了重要特征的选择,并使用逐步回归来分析相交变量,为研究提供了最优的预测模型,促进了风险分层的建立。
(PS:机器学习联合多组学,真正实现1+1>2,想复现的宝子,记得来找馆长哦,我随时在呢)
定制生信分析
云服务器租赁
加好友
备注“99”
领取试用

题目:基于代谢途径的子宫内膜癌亚型分型:多组学分析和机器学习算法的综合研究
杂志:Molecular therapy. Nucleic acids
影响因子:IF=6.5(2区Q1)
发表时间:2024年2月16日
后台回复“
666
”获取原文献,编号20240929
研究背景
子宫内膜癌(EC)是女性生殖系统中第二常见的恶性肿瘤,其基因组异质性引起了越来越多的关注,但对其代谢特征的了解仍然很少。作者通过全面的多组学分析探索EC中的代谢功能障碍,以开发用于精确治疗的有用分子靶点。本文通过多组学分析和机器学习算法对子宫内膜癌(EC)进行代谢通路亚型分类,旨在揭示其代谢异质性并开发精准治疗方法。
研究方法
研究人员利用TCGA、CCLE和GEO等数据库的转录组、蛋白质组和代谢组数据,将患者分为三个代谢通路亚型(MPS),并通过无监督共识聚类确定了不同亚型的临床特征、基因组改变、免疫微环境及化疗敏感性。
研究结果
转录组学和蛋白质组学研究揭示了EC的代谢重编程
为了研究代谢重编程是否发生在EC中,作者首先进行了主成分分析(PCA),比较了正常(准子宫内膜和正常子宫内膜)和肿瘤组织,发现了不同的代谢转录谱
(图1A、图1B)
。在GSE106191队列中,EC组织附近无异型性的子宫内膜增生患者与配对肿瘤组织也具有相似的代谢相关基因表达模式(
图1C)
。因此,作者进一步对EC与正常/癌前组织之间的差异表达基因(DEGs)进行基因集富集分析(GSEA)分析,以揭示代谢途径的显著变化。失调的通路似乎涵盖了大多数代谢过程,其中大部分在EC肿瘤样本中上调(
图1D - 图F)。
图1转录组学和蛋白质组学分析揭示了EC的代谢重编程
基于代谢途径的EC亚型
为了揭示EC的代谢异质性,作者对84条代谢途径的基因集变异分析(GSVA)衍生富集分数进行了共识聚类和NbClust检验分析,并确定3为TCGA队列的最佳聚类数。PCA也证实3是最适合聚类的数。随后,共有548例患者被分为3个不同的代谢途径亚组(MPS)簇:MPS1(35.9%)、MPS2(33.4%)和MPS3(30.7%)(
图2A、2B
)。MPS1表现出“热”代谢特征,几乎涵盖了所有代谢类别。MPS2在特定的脂质代谢和氨基酸代谢途径中表现出上调,包括初级胆汁酸生物合成、类固醇激素生物合成和亚油酸代谢等。相比之下,与其他两个簇相比,MPS3表现出相对“冷”的代谢表型(
图2C
)。作者进一步研究了三种代谢相关亚型的临床病理特征Kaplan-Meier (KM)生存分析显示,与其他两种亚型相比,MPS3亚型的总生存期(OS) (log rank检验,p < 0.05)和无病生存期(DFS) (log rank检验,p = 0.067)最差(
图2D
)。与其他两个聚类相比,MPS3聚类中浆液组织学类型、2-3级和III-IV期的EC患者比例更高(p < 0.001)(
图2E
)。MPS3组的患者比MPS1/2组的患者更老(p = 0.082)(图S2C)。TCGA分子亚群34与MPS簇的比较显示,MPS3簇主要由CN-H型组成,而MPS2簇则显示出较高比例的CN-L型(p < 0.001)(
图2F;表S3
)。亚群分析显示,EC的最大亚群(称为非特异性分子谱[NSMP],也称为CN-L)在MPS簇中表现出异质性代谢谱。重要的是,在MPS1亚组中,NSMP患者表现出较差的OS倾向(
图2G和2D
)。同样,在预后中等的MSI组或未分配组的患者中,属于MPS3亚组的患者复发持续时间较短,但差异未达到统计学意义(
图2E
)。总之,这些发现强调了TCGA分子亚型和代谢谱之间复杂的相互作用,揭示了NSMP EC预后的细微差别。
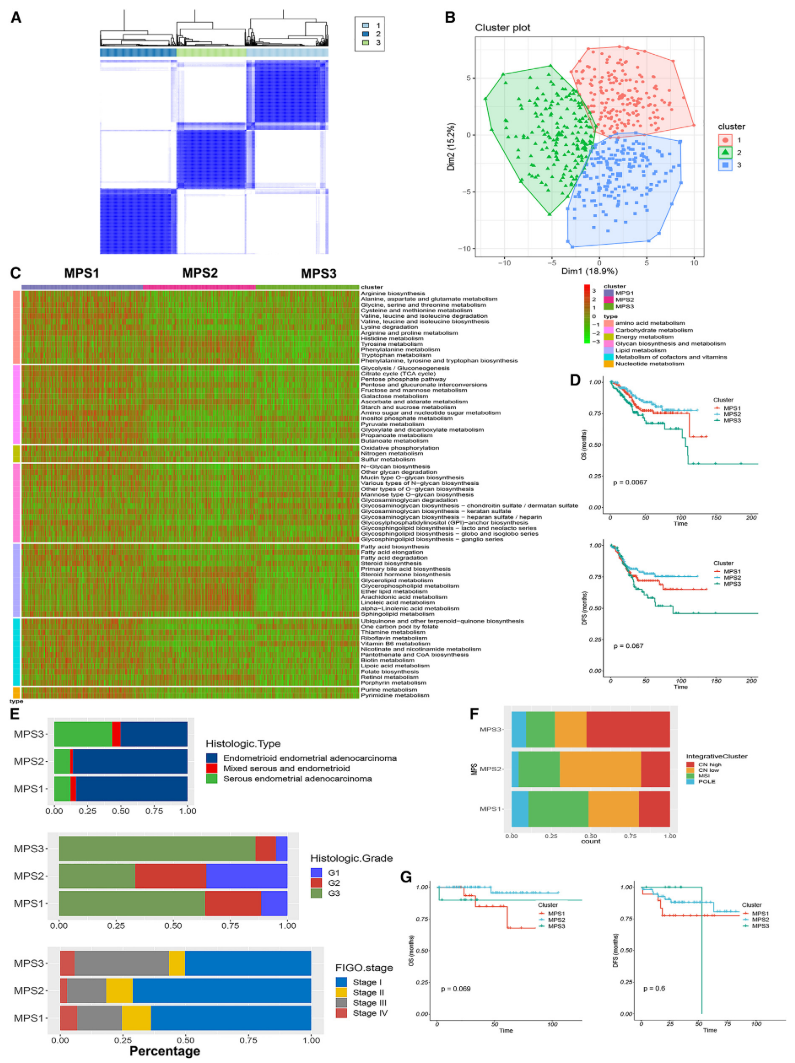
图2
EC代谢途径相关分层
MPS亚型之间的转录组学分析比较
弦图显示在每个MPS簇中具有显著改变的代谢基因的富集的代谢途径:(A)MPS 1簇,(B)MPS 2簇,和(C)MPS 3簇 (D)MPS 1和MPS 3簇的差异改变的标志致癌途径的GSEA图。(
图3:A-D
)。每个MPS聚类的EMT评分比较。ns,无显著性
(图3E)
。EMT相关基因SOX 9、TWIST 1、FOXF 1、ZEB 1、ZEB 2和GATA 6的比较箱形图
(图3F)
。热图显示代谢途径的富集分数与标志致癌途径之间的相关性
(图3G)
。
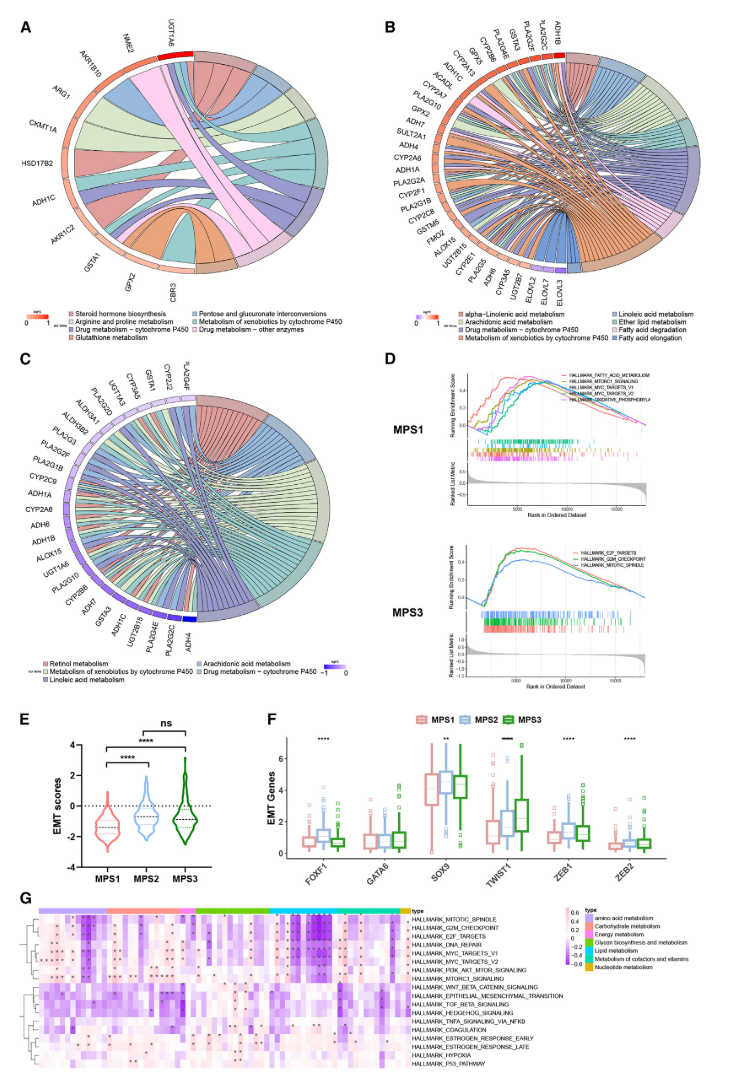
图3
基于代谢途径的亚型分型揭示了不同的转录组特征
EC中MPS簇的特征性基因组改变
TCGA队列中EC MPS亚组中10种致癌途径的突变频率比较
(图4A)
。示出TCGA群组中每个簇中前10个差异突变的代谢基因的突变频率和互连的Sankey图(与其他亚组相比;错误发现率< 0.05)
(图4B)
。MPS亚组间HRD评分的比较
(图4C)
。TCGA队列中EC MPS簇的染色体改变谱(D,MPS 1亚组; E,MPS 2亚组; F,MPS 3亚组)
(图4D-F)
。显示KEGG分析结果的点图,重点关注位于每个EC MPS亚组(G,MPS 1; H,MPS 2; I,MPS 3)显著扩增区域内的基因。
(图4G-I)
。
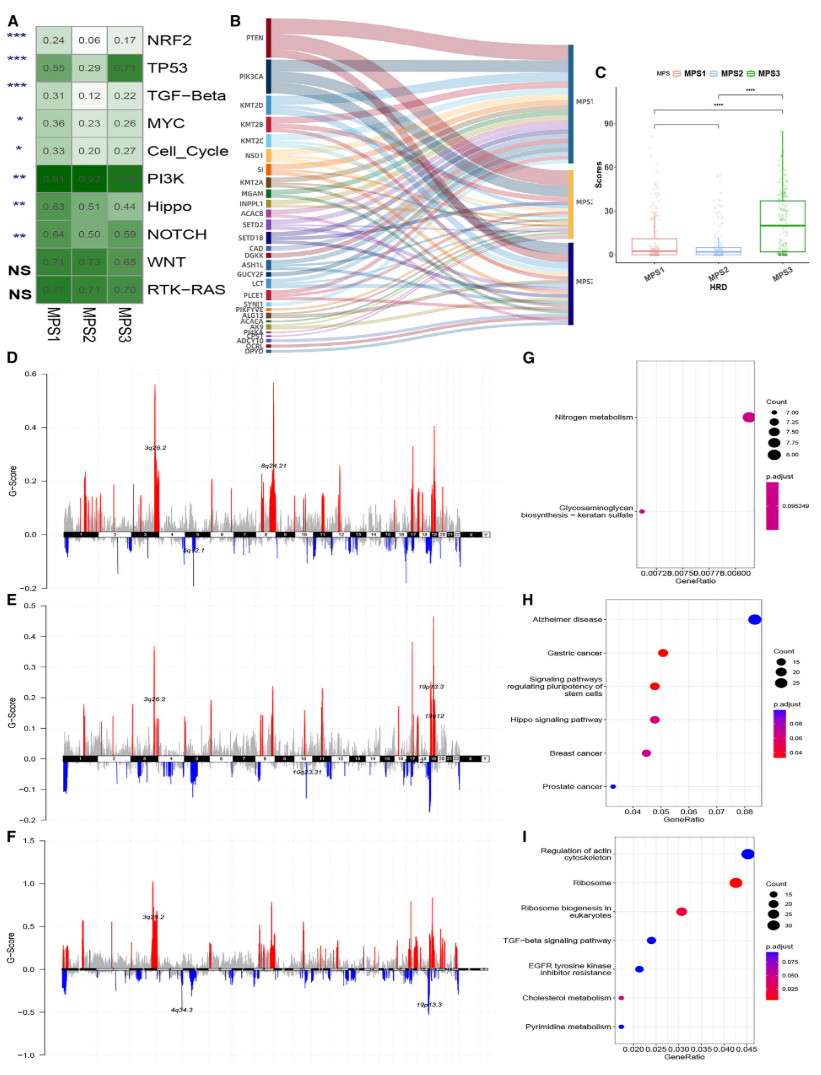
图4
EC中MPS簇的特征性基因组改变
MPS亚组中不同的免疫微环境浸润和对免疫治疗的异质性反应
比较TCGA队列中3个MPS亚组中通过CIBERSORT分析估计的22种免疫细胞的浸润水平
(图5A)
。比较TCGA队列中3个MPS亚组中发挥抗肿瘤(左)和促肿瘤(右)作用的免疫细胞总富集评分的箱形图
(图5B)
。TCGA队列中3个MPS簇的功能障碍评分(C)、排除评分(D)和TIDE评分(E)评估
(图5C-E)
。显示TCGA队列3个MPS亚组中总TMB的箱形图
(图5F)
。TCGA队列的3个MPS亚组中CD 274、CTLA 4、IFNGR 1、LAG 3和PDCD 1的表达水平分析
(图5G)
。朝阳图显示了TCGA队列中MPS聚类的预测缓解率
(图5H)
。
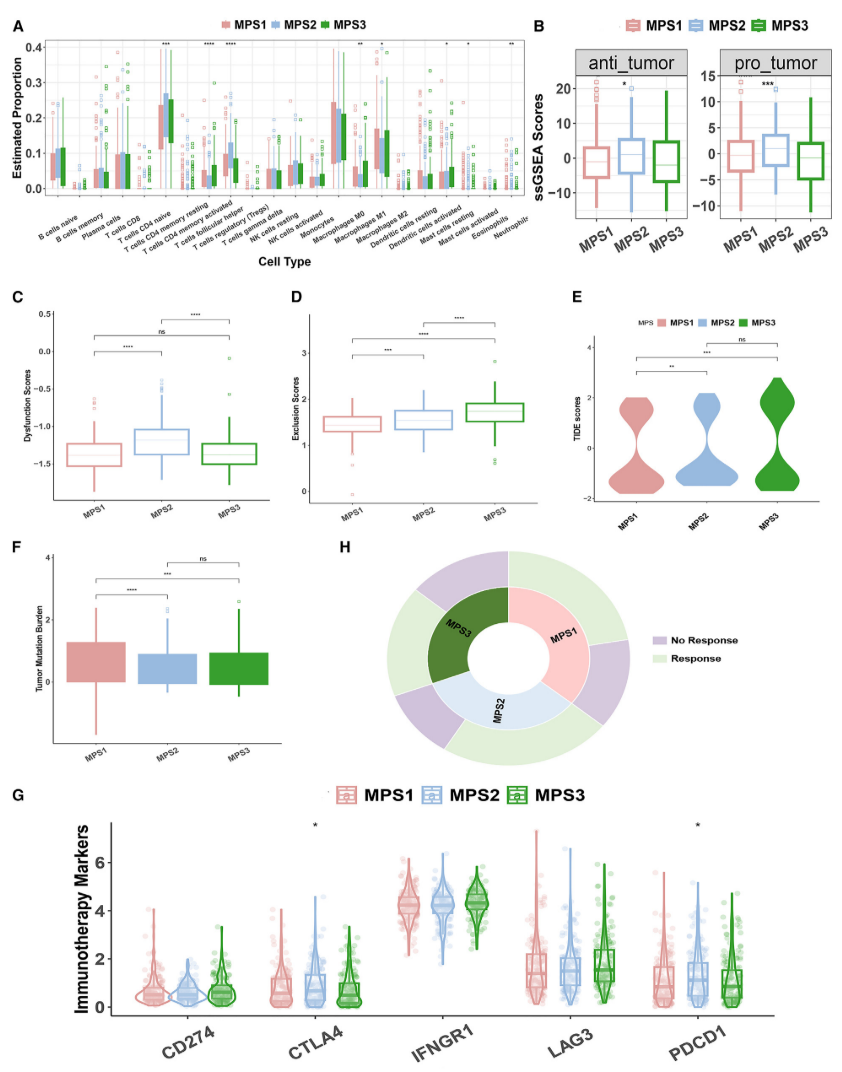
图5
不同的免疫微环境和免疫治疗对MPS的异质性反应
基于代谢途径的亚型分型反映了细胞水平上独特的化疗敏感性和代谢特征
概述在TCGA队列中开发具有更高药物敏感性的MPS独特治疗药物的策略的示意图
(图6A)
。基于TCGA队列中的PRISM(上)和CTRP(下)数据库,比较每个MPS亚组中差异敏感药物的AUC值(p < 0.05,logFC >0.2)
(图6B)
。TCGA队列中每种MPS的多西他赛AUC估计值及其预测基因标志物表达水平(BUB 1和RPN 2)的比较
(图6C)
。PCA图显示基于84种代谢途径的富集评分的TCGA肿瘤样品和CCLE细胞系的基于代谢的亚组
(图6D)
。火山图显示了CCLE EC组群中MPS簇之间的差异代谢物(p < 0.05,绝对logFC >0.05)
(图6E)
。GSEA图显示EC细胞MPS 3亚组中活化的标志途径
(图6F)
。基于CCLE EC中的PRISM数据库,比较每个细胞系MPS亚组中差异敏感药物的AUC值(p < 0.05,logFC >0.2)
(图6G)
。
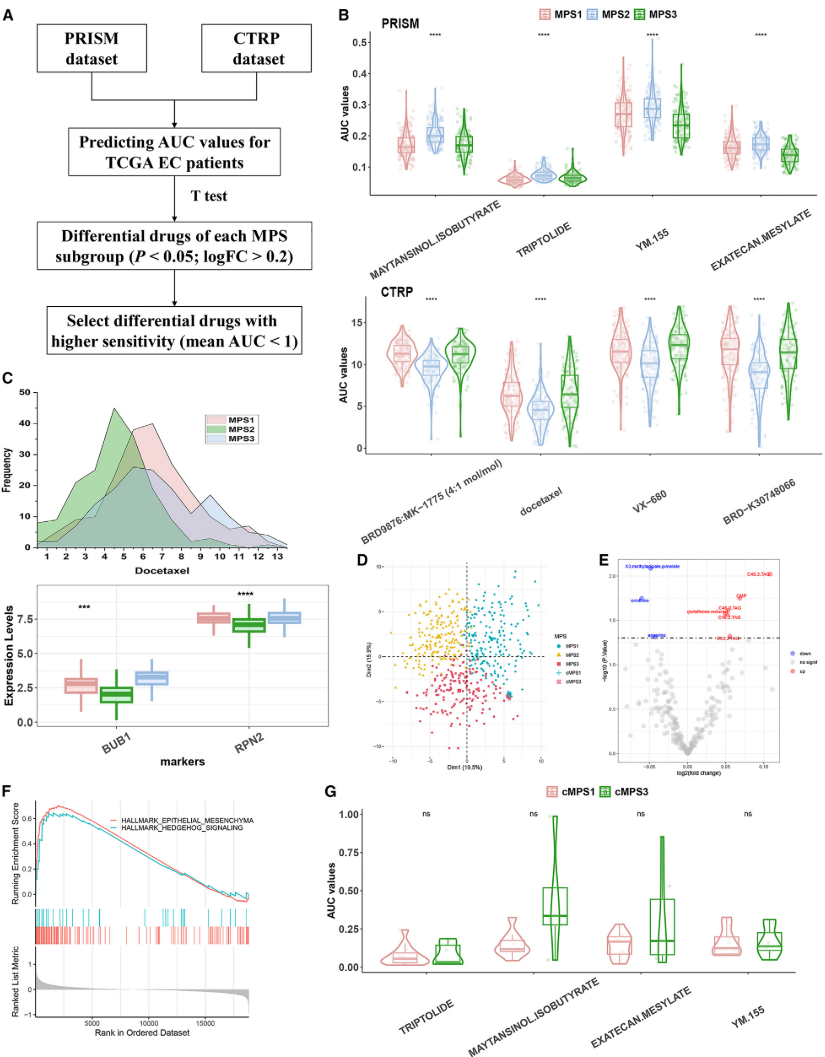
图6 基于代谢途径的亚型分型反映了细胞水平上独特的化疗敏感性和代谢特征
使用机器学习算法开发代谢相关预后风险模型
多基因预后标记发展的总体流程图
(图7A)
。LASSO-LR模型变量的选择和开发过程
(图7B)
。该图说明了在随机森林模型中树木数量的调整过程,其中x轴代表树木数量,它们轴显示相应的误差率
(图7C)
。多元Cox回归模型的平均C指数在所有可能的基因组合中进行评估

















