作者 l 夕阳武士
编辑
l
Childlikecat
2011年靶点为CTLA-4的Yervoy被FDA批准上市,2014年针对PD-1靶点的Pembrolizumab上市将免疫检查点的研究推向了热点,在市场的推动下,同类药物Nivolumab、Atezolizumab、Avelumab和Durvalumab相继问世,同时也推动了CAR-T细胞疗法、溶瘤病毒、双特异性抗体、基因编辑等疗法研究。肿瘤免疫治疗领域呈现出多点开花、百家争鸣的研究热潮。
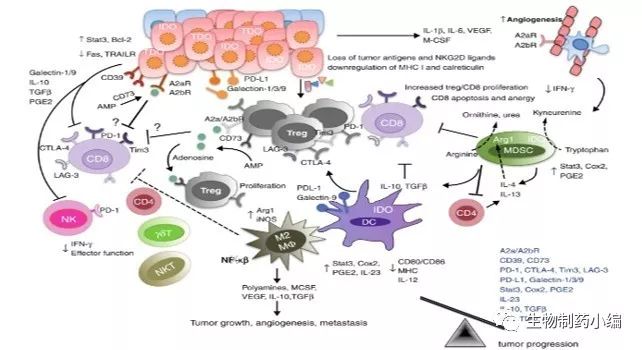
没有意外,在今年的ASCO会议中,和肿瘤免疫检查点抑制剂联合用药的临床试验成为了关注焦点。在会议上及poster中相继报道了多个生物药的研究进展,其中
CD47、LAG-3
的临床数据惊艳亮相,给研究者们打了一针强心剂。此外,
ICOS、CD122、CD27、TGF-β、CSF-1、GITR、IL-8、CD123单药或联合PD-1/L1
同样有着值得进一步推进临床的研究进展,接下来我们分别进行分析讨论。
一. CD47
CD47也被称为整合素相关蛋白(integrin associated protein,IAP),广泛的表达于细胞的表面,可与信号调节蛋白α (Signal regulatory protein α, SIRP α)、血小板反应蛋白(thrombospondin-1, TSP1)以及整合素(integrins)相互作用,介导细胞凋亡、增殖、免疫等一系列的反应。 CD47是一个5次跨膜蛋白,分子量在50kDa左右,属于免疫球蛋白超家族,胞外N端为IgV结构域。CD47在19世纪80年代首次被确认为人类卵巢癌的肿瘤抗原,继而CD47被发现在多种人类肿瘤类型中表达,包括急性骨髓白血病(AML)、慢性骨髓白血病(CML)、急性淋巴细胞白血病(ALL)、非霍金性淋巴瘤(NHL)、多发性骨髓瘤(MM)、膀胱癌和其他实体肿瘤。
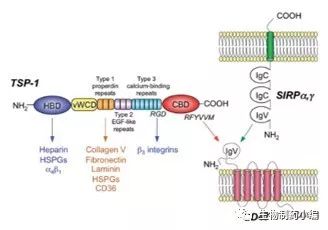
图1. CD47结构示意图
CD47是一个“别吃我”的自我信号,能够逃逸巨噬细胞的识别免疫。
通过CD47抗体或者配体阻断这个"别吃我"的信号,使巨噬细胞发挥吞噬作用,是一个容易理解的事情。关于这个机理Forty Seven的创始人斯坦福大学的Weissman博士做了一系列的工作论证。Liu等人研究表明,CD47抗体治疗是通过DC细胞和CD8+T发挥肿瘤杀伤效应的。DC细胞通过CD47抗体和亲吞噬分子协同作用,吞噬肿瘤细胞,并提呈肿瘤相关抗原给CD8+T,进而发挥CD8+T对肿瘤的特异性杀伤作用 。
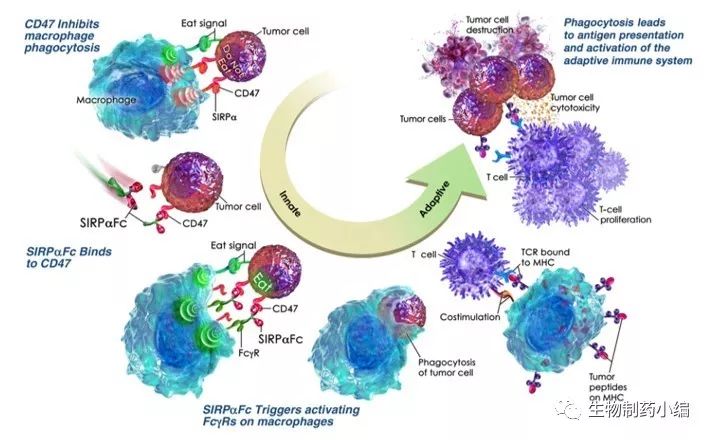
图2. CD47抑制剂治疗示意图
CD47作为研究开发靶点,已有多项数据表明在血液瘤、癌症干细胞及实体瘤中的有效性。如下列表图。
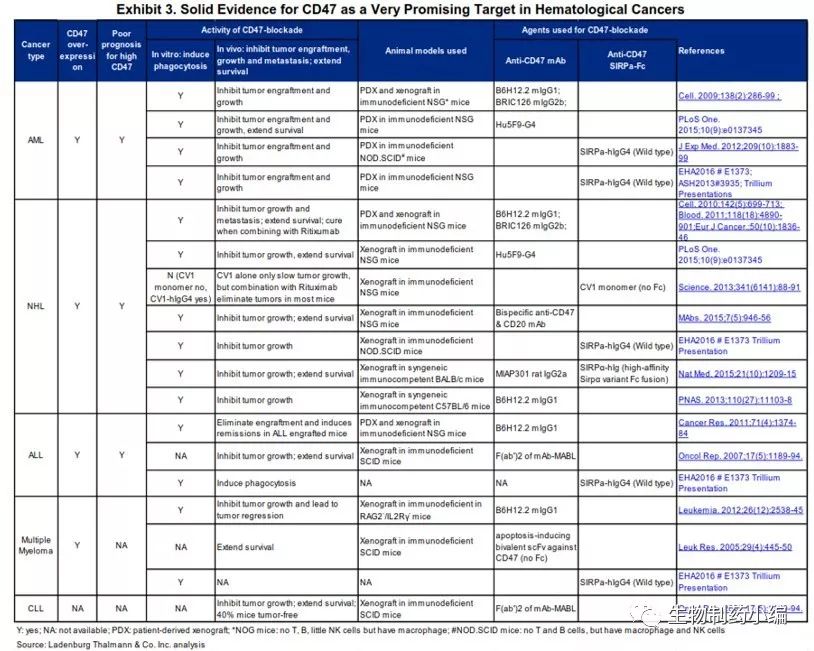
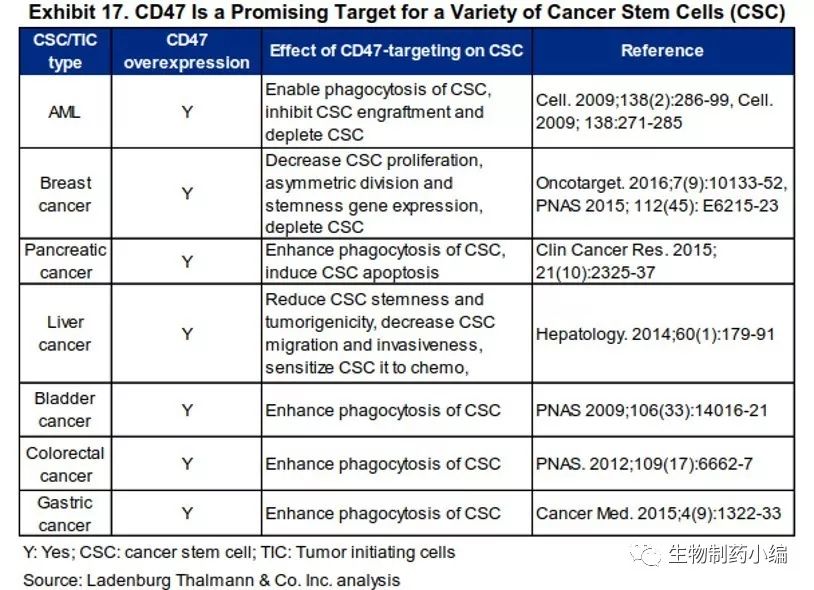
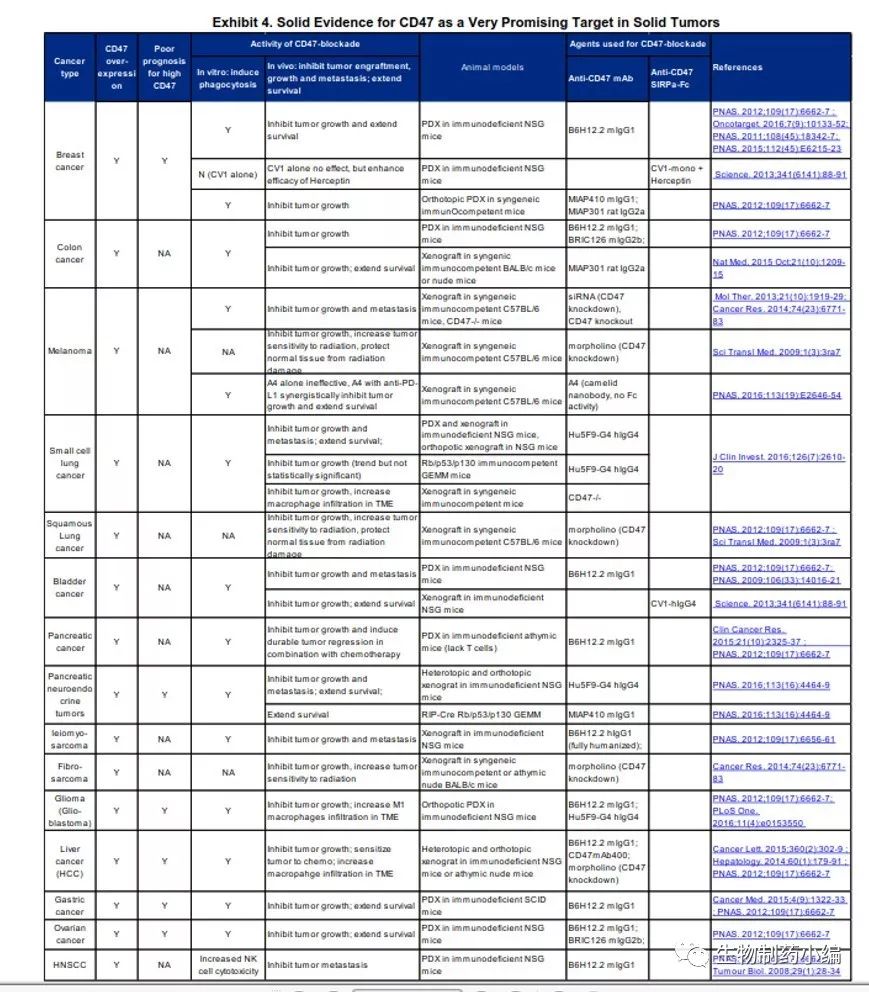
图3. CD47抑制剂治疗示意图
在动物模型中的肿瘤抑制有效性推动了CD47抑制剂的研发步伐,图4列表了CD47的临床前、临床的研究进展。速度比较快的有Forty Severn公司的Hu5F9-G4及Trillium Therapeutics Inc的TTI-621,本次ASCO也是重磅报道了Hu5F9-G4的研究进展。
本文我们重点讨论Hu5F9-G4和TTI-621的研究进展。
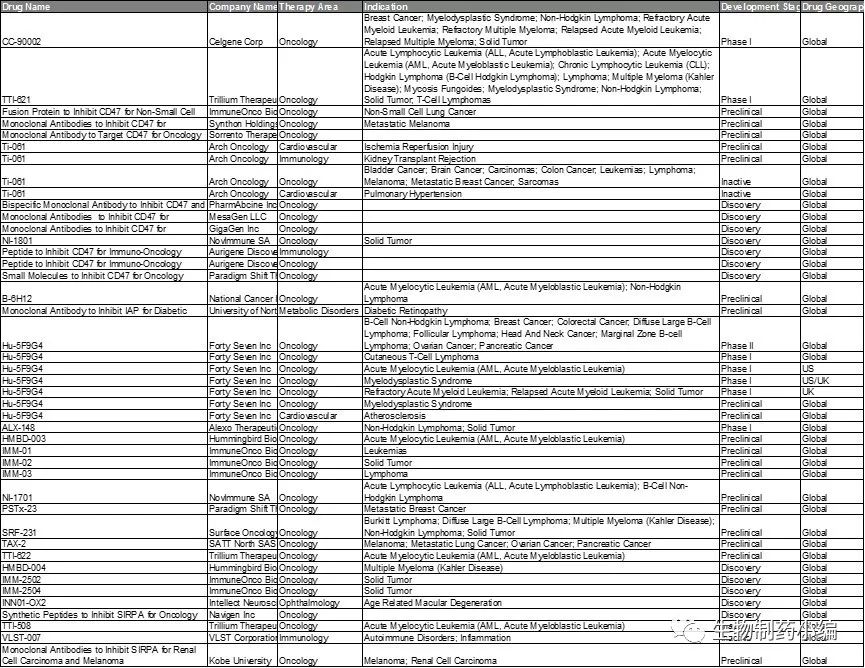
图4. CD47研究进展
1.
Hu5F9-G4
Forty Seven的第一项1b/2期临床试验设计如图5,使用5F9联合利妥昔单抗治疗DLBCL和FL患者。在试验的1b期部分,患者接受1 mg/kg预注给药剂量的5F9,以减轻靶向性贫血(on-target anemia),随后接受全剂量的利妥昔单抗和逐渐增加剂量5F9,剂量范围为每周一次10-30 mg/kg。至今年4月,1b期试验的所有剂量组中共有22名患者接受了治疗,其中包括15名DLBCL患者和7名FL患者。其中95%的患者被认为先前使用利妥昔单抗方案有难治性,患者之前接受过中位4次治疗。临床产生的副作用如图6。根据Lugano标准,研究使用PET/CT成像来测量临床活性,其中包括肿瘤大小和代谢活性测量。在所有22名可评估患者中,数据显示客观缓解率(ORR)为50%,完全缓解率(CR)为36%,FL 43%CR, DLBCL 33%CR,如图7,反应持续性如图8。
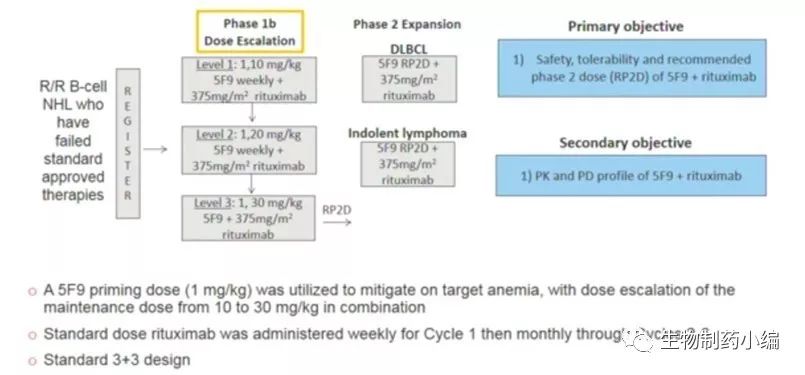
图5. Hu5F9-G4临床设计

图6.Hu5F9-G4临床副作用
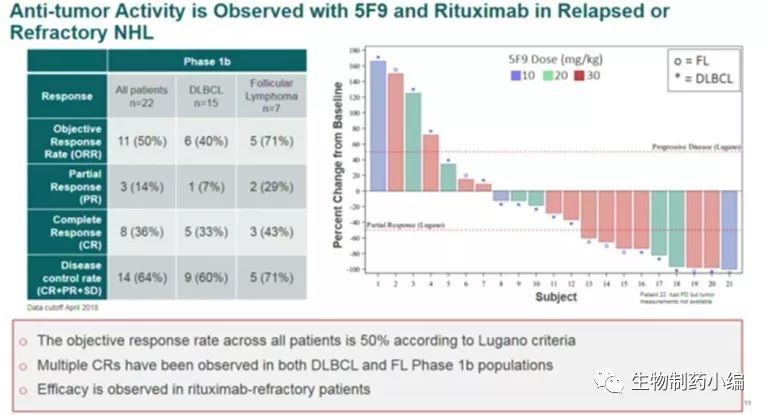
图7. Hu5F9-G4临床治疗效果
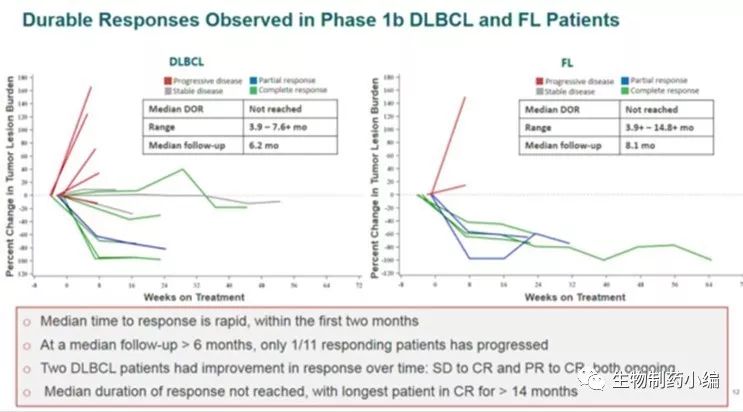
图8. Hu5F9-G4临床治疗持续作用
2.
T
TI-621
接下来我们看一下Trillium Therapeutics 的CD47抑制剂TTI-621,TTI-621是针对CD47的天然配体进行设计的融合蛋白,区别于Forty Severn公司的抗体抑制剂。其结构设计如下图,取CD47天然配体SIRPa的胞外区D1偶联人IgG1的Fc段构成重组融合蛋白。
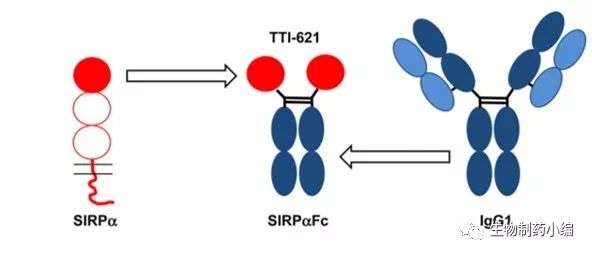
图
9.TTI-621
结构示意图
临床设计如下, DLBCL患者及扩展组接受了TTI-621单药或联合利妥昔单抗治疗,起始剂量0.1mg/kg,最高剂量0.5mg/kg。
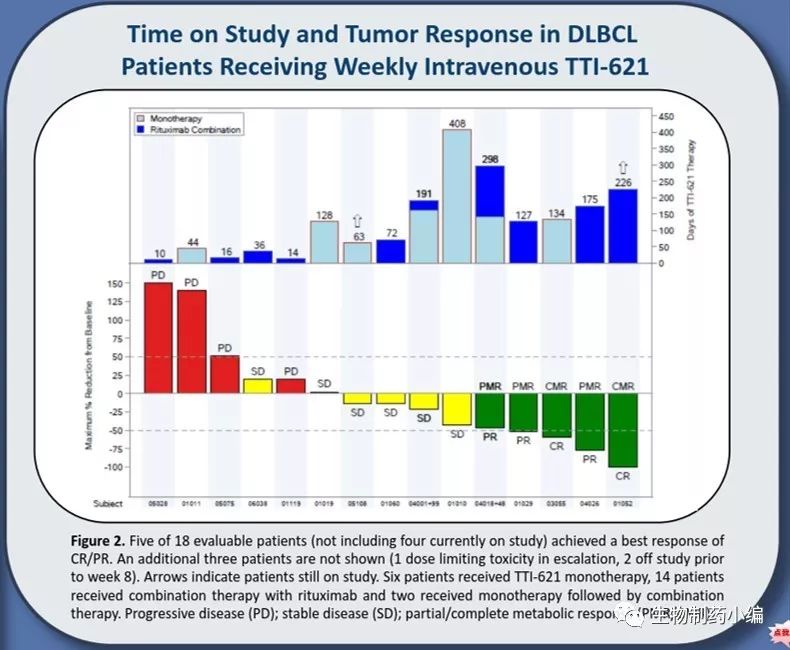
图10.TTI-621临床设计
药物动力学如下:药物半衰期在4-5天。
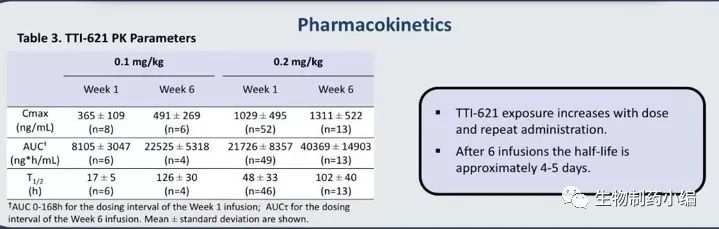
图11.TTI-621药物动力学(PK)
临床结果显示:5名患者在接受单药或联合治疗后产生CR/PR效果(6名接受单药治疗,14名联合用药治疗)。

图11.TTI-621临床结果
分析:
从两家的临床数据显示在联合利妥昔单抗复发的DLBCL患者都达到了不错的治疗效果,在使用剂量上,Hu5F9-G4最高达到30mg/kg,而TTI-621则为0.5mg/kg,这主要归因于Hu5F9-G4同红细胞的结合显著强于TTI-621同红细胞的结合力,因此Hu5F9-G4需要一定的起始剂量进行靶点沉默。在副作用方面,Hu5F9-G4会诱发贫血,但持续时间并不长,2周左右后则回复,TTI-621则不会诱发贫血。迄今两家公司都启动了数个临床试验,包括了多种血液瘤及实体瘤,单药或联合诸如CD20、PD-1/PD-L1抑制剂治疗,我们期待更多更好的临床结果。
二、LAG-3
LAG-3(lymphocyte activationgene 3,LAG-3,CD223)和CD4是同源蛋白,但是以更高的亲和力与主要组织相容性复合体Ⅱ类分子(major histocompatibility complex classⅡ,MHCⅡ)结合,主要表达在活化的T淋巴细胞、B淋巴细胞、自然杀伤细胞(natural killer cell, NK)和浆细胞样树突状细胞(plasma cytoid dendriticcells, pDCs),并负调控T细胞功能。研究表明LAG-3选择性地上调Treg表面的CD4,因此LAG-3抗体在体内可降低Treg活性。抑制或敲除LAG-3会解除Treg对T细胞的抑制功能。另外,在缺少CD4+T细胞的情况下,LAG-3抗体能够增加CD8+T细胞的功能。T细胞失能或者耗竭时会表达多种免疫检查点分子,在慢性感染模型及自身抗原识别模型中LAG-3和PD-1通常都有共表达现象。
协调抑制LAG-3及PD-1能够增强免疫应答,因此目前关于LAG-3抗体的临床试验都是单独或者与PD-1联用来观察效果。
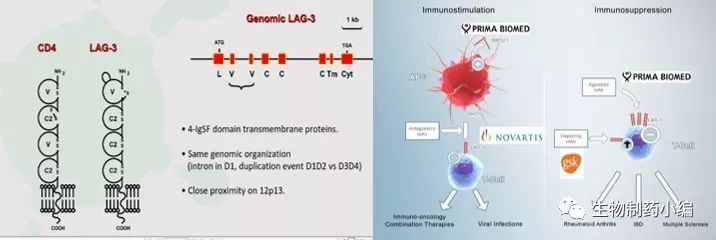
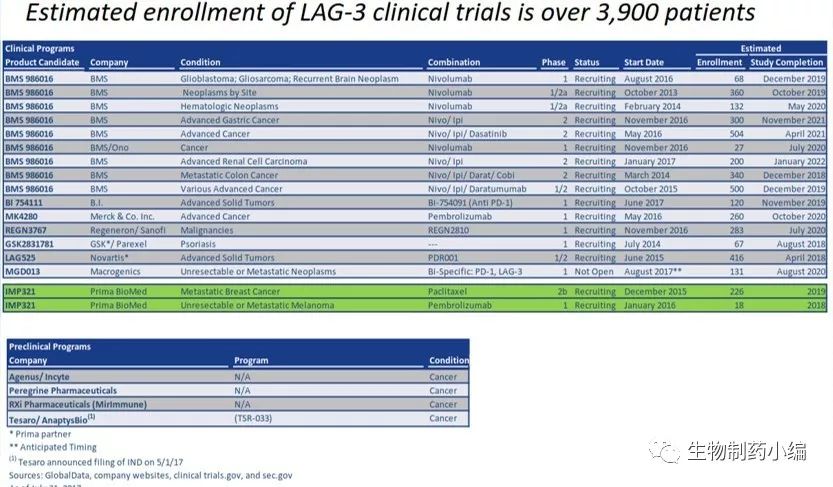
目前主要有以下几家公司进行LAG-3的临床试验:BMS的BMS986016,Regeneron和Sanofi合作的REGN3767,Novartis的LAG525,以及澳洲药企Prima Biomed的IMP321。如下图。
本文重点讨论下本届ASCO展示研究进展的IMP321、LAG525及REGN3767等。
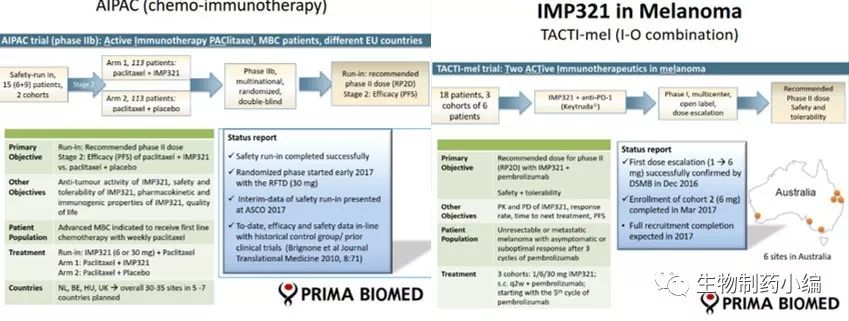
1、IMP321
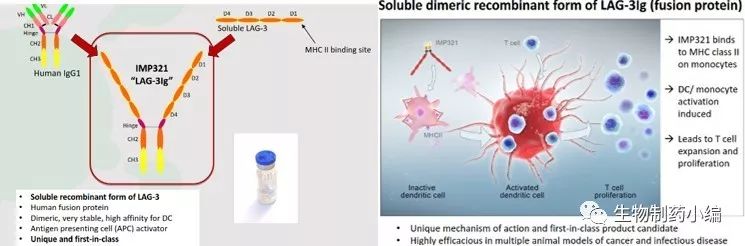
由Prima BioMed 开发的大分子抗癌化合物,是由LAG-3及Ig构成的二聚体融合蛋白, 作为抗原呈递细胞 (APC) 的激活剂,是可溶型的LAG-3,主要用于增加免疫系统对肿瘤的反应,免疫治疗作用如下图所示,通过竞争结合MHC达到对DC细胞、单核细胞的激活,进一步对T细胞的激活扩增。IMP321有两种临床用途,一种是“低剂量”(例如250 mg)作为癌症疫苗的佐剂,另一种是“高剂量”(如12次注射,每次6 mg)作为一线“化学-免疫疗法”,但IMP321却没有免疫原性的(临床试验中没有检测到anti-IMP321抗体)。
在2000-2008年,主要进行了药物的临床前研究,2005年起逐渐走向了临床的研究。目前Prima BioMed有两项IMP321在研的临床项目,分别是(1)与紫杉醇联合应用于HER2阴性转移性乳腺癌患者的随机双盲安慰剂对照研究,该II期临床试验招募226例患者,预计于2019年6月结束,2020年12月完成主要研究报告;(2)与Keytruda (Pembrolizumab,PD-1抑制剂)合用治疗不可切除或转移性黑色素瘤的I 期试验,用以评估IMP321安全性和可能的协同PD-1抑制剂的作用,本试验预计于2018年6月结束,12月提交主要的研究报告。临床设计如下图。
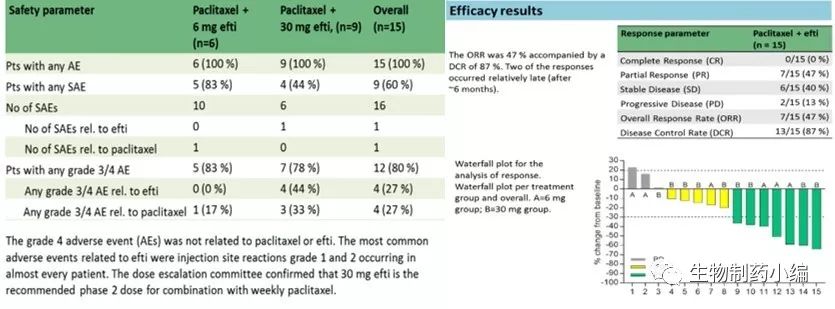
刚刚结束的ASCO公布了其最新研究进展,与紫杉醇联合应用于HER2阴性转移性乳腺癌患者的随机双盲安慰剂对照研究初步结果显示:其安全剂量达到30mg,临床试验证明其安全性和耐受性良好,疾病控制率DCR达到87%,总反应率ORR达到47%,部分缓解PR 47%,如下图所示。并且药效持续(APC的激活及树突状细胞和CD8 T细胞数量扩增)已经达到6个月。可以看出IMP321联合紫杉醇在转移性乳腺癌一线治疗中已初见成效。同时也提示皮下注射 30 mg为二期临床的推荐用量。
此外,IMP321已启动II期的招募工作,预计在7个欧洲国家的34个试验中心招募 226 名转移性乳腺癌患者(激素受体为阳性,接受过一线治疗紫杉醇但没有 Her2/neu 靶向治疗),进行 1:1 随机、双盲安慰剂对照试验。临床试验在第1、8、15天静脉注射 80mg/m2 紫杉醇,第 2、16 天皮下注射 30 mg IMP321 或安慰剂,持续 6 个循环。病情稳定或有好转者可每四个星期接受一次 IMP321 或安慰剂(最多 12 次)。主要终点为无进展生存期(Gress Free Survival);次要终点包括总生存和肿瘤反应、疗效起始及持续时间、病情稳固时间和生活质量。
其他在开展的临床试验还包括开放标记的一期临床研究,针对晚期实体瘤,评估IMP321(LAG-3Ig融合蛋白)单药注射于肿瘤内、腹腔内和皮下的可行性和安全性;联合Pembrolizumab(Keytrude)临床一期剂量递增治疗不可切除或转移性黑色素瘤,初步结果显示每两星期皮下注射一次 30 mg IMP321联合标准剂量 Pembrolizumab 是安全的,并会在更多的招募者中继续研究。联合用药使肿瘤缩小可能表明 APC 激活剂IMP321辅助标准免疫疗法可增进疗效。

2. LAG-525 (IMP701)
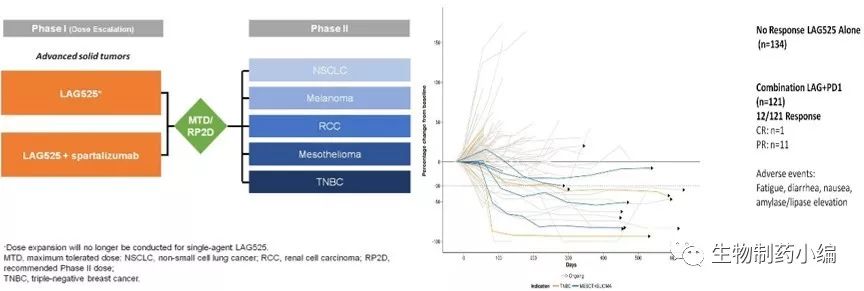
是针对膜蛋白LAG-3的单抗,能够起到阻断 LAG-3 APC、CD8+T细胞的抑制作用,促进 CD8+T 细胞激活和增殖。2012 年 CoStim 制药公司获得 IMP701 的许可,之后被诺华公司(Novartis)收购,并与 Prima BioMed 联合研发。2015年8月启动临床I期研究试验,预计2018年10月完成主要研究报告,招募病人从240人扩展到416人,主要采取联合PD-1治疗实体瘤。
目前已启动的临床试验包括联合(1)LAG525、Spartalizumab (Anti-PD-1)一二期临床试验治疗恶性肿瘤;(2)二期临床Spartalizumab (Anti-PD-1) 和 LAG525联合治疗针对晚期实体瘤和血液恶性肿瘤。
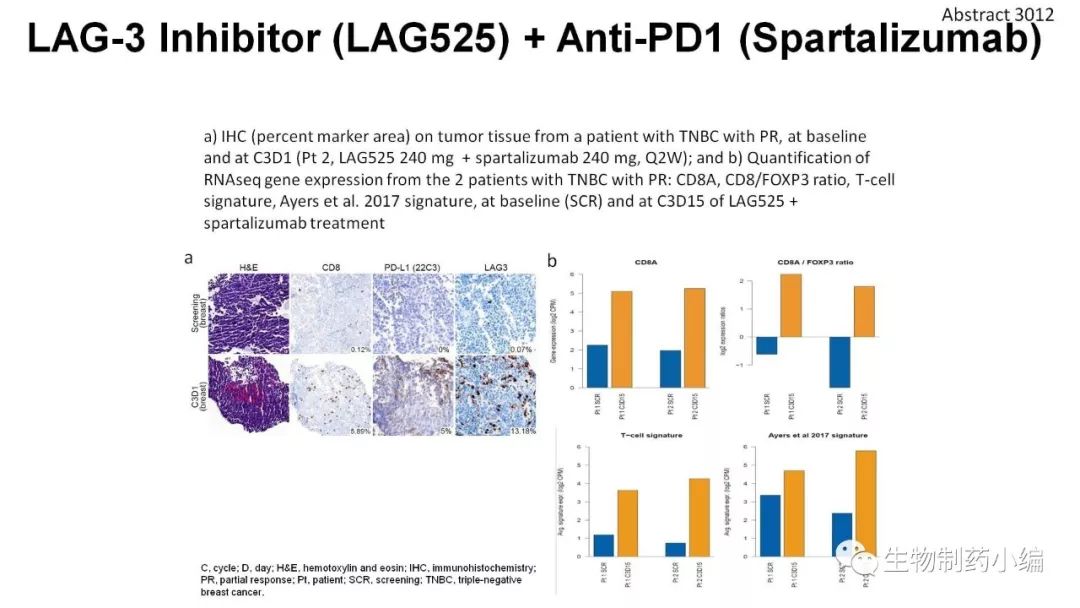
初步结果显示121 位采用联合用药的患者中有 11 位部分缓解PR、1 位完全缓解CR,其中包括 2/8 例间皮瘤和 2/5 例三阴性乳腺癌患者。三阴性乳腺癌的活检中发现生物标志物呈现从免疫冷淡到免疫激活的转变趋势(IHC)。病人的免疫系统得到激活,疾病得以控制。
3. REGN3767
是一个针对LAG-3全人源抗体,Fc采用IgG4,临床前研究表明REGN3767能够有效的阻断LAG-3与MHC-II的结合。在双基因人源化的小鼠LAG-3hum/hum&PD-1hum/hum 模型中,相比于PD-1抗体单药治疗,联合治疗能够更有效的抑制肿瘤生长。
剂量爬坡试验采用改良的 3+3 (4+3)模式,即 REGN3767 单独给药采用 4 个递增剂量,联合疗法采用 3 个递增剂量。安全性、耐受性和药代动力学评估之后,分别选定单独、联合疗法的 REGN3767 剂量,扩大试验规模。
首要临床终点包括安全性、药代动力学PK、药物耐受、扩增组的总反应率ORR;次要目标包括免疫原性、剂量扩增的安全性、药代动力学PK、扩增组的药效等。
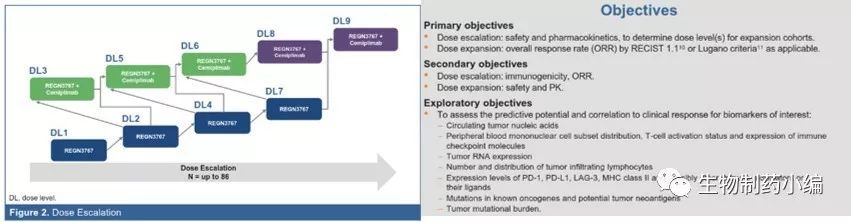
分析:
其他关于LAG-3抑制剂的研究进展这里不再赘述,迄今的研究试验表明LAG-3联合PD-1抑制剂具有更强大的肿瘤抑制作用,但同时也显示LAG-3抑制剂单药治疗并无显著疗效,联合治疗进展处于I/II期,患者从LAG-3抑制剂联合PD-1抑制剂治疗中的获益程度需要更多的临床数据去进一步论证。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

















