肿瘤免疫治疗开展的如火如荼,PD-1单抗
治疗更是捷报频传。但是,能通过PD-1类单抗治疗获益的人群只有20—30%,虽然YuceOne
®
ICI
能够准确区分哪些人群能够获益,但是剩余的
70%
的人群怎么办?实际上,免疫治疗中真正个性化治疗的领域是肿瘤新生抗原(
Neoantigen
),利用肿瘤新生抗原制备
CAR-T
、
TCR-
T等过继性细胞或者
肿瘤疫苗,已经成功治愈了很多例恶性肿瘤。
为了
让肿瘤免疫更有效
,我们特开“Neoantigen”专栏探究肿瘤新生抗原的前世今生,先从几个典型案例谈起。
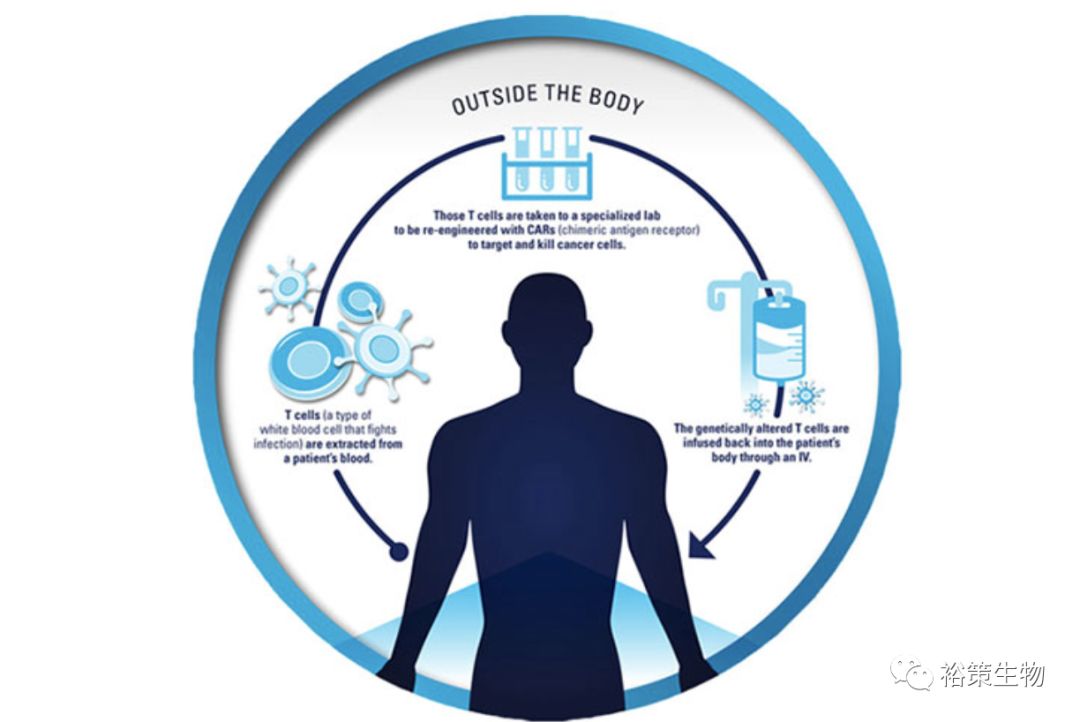
案例一:过继性细胞疗法治愈晚期转移性胆管癌
这是较早期的利用肿瘤新生抗原治疗人体肿瘤并取得良好效果的案例,2014年5月份发表于顶级权威期刊《Science》上。美国癌症研究所的Steven Rosenberg教授团队(肿瘤免疫治疗的鼻祖)利用从患者肿瘤组织中分离出来的肿瘤浸润淋巴细胞(TIL),在体外经基因工程改造使其能够识别某特异性新生抗原后,回输至患者体内,成功治疗了一例晚期转移性胆管癌患者。

背景-免疫研究证据缺少
人类免疫系统能够识别并清除入侵的外来物质,包括蛋白质、细菌、病毒等,部分恶性肿瘤突变产生的蛋白质也能够被T细胞识别为“非己物质”,进而激活T细胞的应答,来消灭该肿瘤细胞。在研究最为充分的肿瘤——黑色素瘤中,经常会发现一些由肿瘤突变激活的T细胞,这些T细胞在过继性免疫细胞治疗(ACT)中可能扮演了非常重要的角色。但是在普通的上皮细胞癌中,当时只有很少的证据证明肿瘤内源性突变能够激活T细胞的应答,更没有人知道这样的应答能不能用于个性化的肿瘤免疫治疗。更何况相比黑色素瘤,上皮细胞癌的突变往往更少,这直接导致了突变特异性的T细胞应答率降低。
展开ACT治疗尝试
研究团队设想,能否在肝癌中找到能够识别特异性突变的TIL,用于ACT治疗研究,其中一位经过了多次化疗的43岁转移性胆管癌患者加入了这项ACT研究。研究者首先切除了患者肺转移灶,对这个肺转移灶进行了全外显子测序,并从中分离出来一部分T细胞,也就是TIL,用于体外培养。测序结果发现了26个有意义的基因突变,这可能会产生很多异常的蛋白质,这些异常蛋白质我们称之为肿瘤新生抗原。
从患者体内分离到的TIL能不能识别这些肿瘤特异性抗原呢?经过一系列技术验证发现,在这部分TIL细胞中存在一类能够特异性识别ERBB2IP蛋白的T细胞,而ERBB2IP蛋白正是由突变产生的肿瘤新生抗原之一,这绝对是一个新的希望。
按照免疫学理论,将这些ERBB2IP蛋白特异性的T细胞回输到病人体内,应该可以消灭肿瘤细胞。于是,研究者将这部分从患者体内切除分离的TIL细胞在体外进行了扩增,然后将ERBB2IP蛋白特异性的T细胞浓度富集到25%,回输至患者体内,也就是ACT治疗。
治疗奇迹出现
两个月后奇迹发生了,肿瘤开始缩小,
7个月后肝脏肿瘤和肺部转移灶都缩小了30%以上
。为了验证是不是ERBB2IP蛋白特异性T细胞发挥的作用,研究者对回输细胞进行了一系列的体外表型和功能以及体内持久性验证发现,确实是ERBB2IP蛋白特异性T细胞发挥了重要作用。
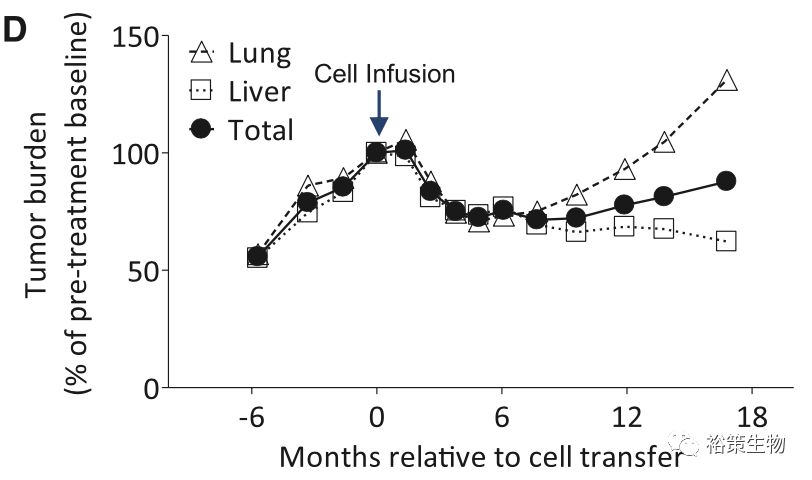
从上图中可以看出,患者的肝脏肿瘤在经过缩小后,继续维持了稳定状态。然而肺部肿瘤却有增长的趋势,为了进一步评估ACT治疗的抗肿瘤效果,时隔18个月后,研究者再次对该患者进行了ACT治疗,不过这次将ERBB2IP蛋白特异性T细胞,富集到了95%以上。奇迹再次发生了,而且比上次更快,回输不到一个月,
患者肿瘤尤其是肺部肿瘤出现了非常明显的缩小
(下图),之后的随访发现,肿瘤仍在持续不断的缩小,直至完全缓解。
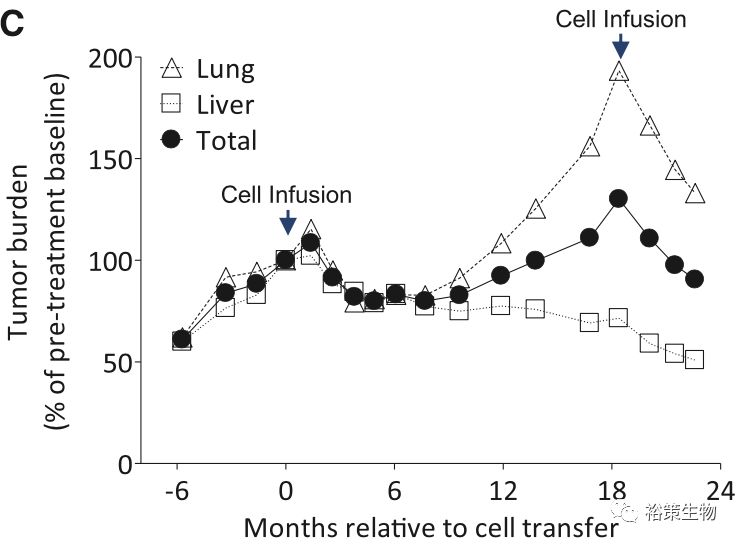 这是一位极度恶化的晚期胆管癌患者,接受过多种化疗方案,均宣告失败,做为最后的希望,该患者参与了Rosenberg的ACT治疗临床试验,将患者生命延长了数年甚至数十年,这是肿瘤新生抗原用于ACT疗法治愈晚期肿瘤患者的典型案例。
这是一位极度恶化的晚期胆管癌患者,接受过多种化疗方案,均宣告失败,做为最后的希望,该患者参与了Rosenberg的ACT治疗临床试验,将患者生命延长了数年甚至数十年,这是肿瘤新生抗原用于ACT疗法治愈晚期肿瘤患者的典型案例。
本专栏将围绕Neoantigen更新更多案例、研究进展、治疗实战。
新生抗原领域投资投资情况
成功的临床治疗效果令人振奋,基于neoantigen的精准免疫治疗的应用潜力也让人们看到了其巨大的市场价值,所以neoantigen的商业化应用也得到了资本的热捧,一系列的企业纷纷投身其中。
“
Neoantigen是肿瘤治疗最具前景的研究领域,裕策生物是一家专注于Neoantigen的优秀企业,是被投资界非常看好的企业。
”
——贝壳社创始人 王学刚
参考资料:Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer, Science vol 344.
欢迎在评论区发表看法,
评论获得点赞最高者,小编将赠送价值198元凌美笔一支
,文章发布2个工作日后送出。





