近日,纪念斯隆-凯特琳癌症中心(MSKCC)的免疫学教授Frederic Geissmann团队在最新一期的《自然》杂志上,刊登了他们在神经退行性疾病研究领域取得的突破性成果。
他们发现,携带常见致癌突变BRAF(V600E)的小胶质细胞(定殖在大脑内的巨噬细胞),可以直接导致神经退行性疾病!最让人激动的地方在于,采用BRAF抑制剂可以延缓小鼠神经退行性疾病的发展[1],目前已有多种BRAF(V600E)抑制剂获批用于治疗癌症。

Frederic Geissmann教授
一直以来,科学家们对阿尔兹海默病、帕金森病等神经退行性疾病都束手无策,其中最主要的原因是,我们不知道神经退行性疾病发生的根本机制!虽然研究人员在神经退行性疾病患者大脑内发现了活跃的小胶质细胞,但是这种活跃究竟是好是坏,还没有人能说清。
有人认为,被激活的小胶质细胞可以帮助修复受损的神经元,也有人认为神经元就是被激活的小胶质细胞损坏的。Geissmann教授团队的研究表明,携带致癌基因突变的小胶质细胞不是对神经元损伤作出反应,而是直接引起神经元损伤!这一结果挑战了传统思维,开辟了诊断和治疗神经退行性疾病的新途径!
Geissmann教授研究巨噬细胞等免疫细胞起源和发育十余年,他认为巨噬细胞在癌症的发生和转移中起到了重要作用,因此有必要搞清楚背后的机制。他涉足神经退行性疾病领域纯属偶然。
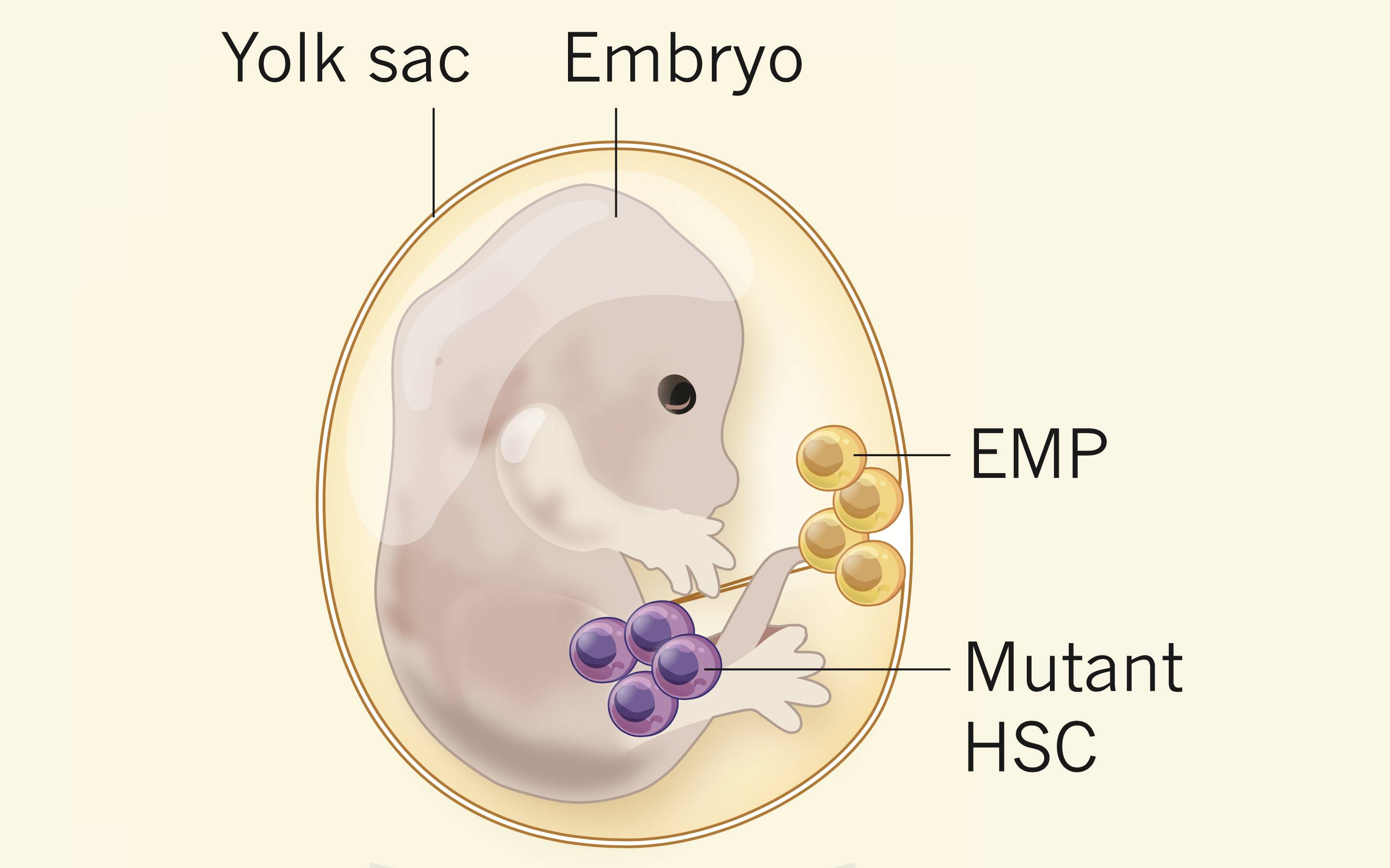
早在2012年之前,Geissmann教授在研究人体巨噬细胞起源的时候发现,虽然造血干细胞(HSC)可以分化成所有类型的血细胞,但是巨噬细胞并不是全部由造血干细胞分化而来。一些巨噬细胞在造血干细胞出现之前就已经存在于胚胎里了,它是由胚胎卵黄囊(yolk sac)中的一种我们从前并不知道的红系-髓系前体细胞(erythro-myeloid progenitors,简称EMPs)发育而来。Geissmann教授团队的这一颠覆认知的重要发现,于2012年刊登在顶级期刊《科学》上[2]。
当然,Geissmann教授的这一发现看上去好像和我们这篇文章沾不上边。不过机缘巧合,让Geissmann教授有了大发现。
研究癌症的科学家应该都知道组织细胞增多病(histiocytosis),这种病病因还不是很明确,但这个病其中的一个表现是巨噬细胞和树突状细胞等免疫细胞异常增殖,像极了癌症。因此,这个病一直由肿瘤专家治疗。
近年来有研究发现,约50%的组织细胞增多病患者的巨噬细胞携带BRAF(V600E)致癌突变[3],而这部分患者在发病多年之后,会患神经退行性疾病[4]。
这就让人好奇了!要知道BRAF(V600E)基因突变,可是经常出现在诸如黑色素瘤、结肠癌、甲状腺癌等各种癌症中的呀!就在这一刹那之间,Geissmann教授意识到神经退行性疾病与癌症之间可能有某种联系。
「如果神经退行性疾病是小胶质细胞引起的、类似于组织细胞增多病的克隆性增殖性疾病,或者简单地说,它是小胶质细胞癌变引起的疾病,那么患者的获益将是巨大的,」Geissmann教授接受说,「因为我们已经有检测和治疗的潜在手段。」[5]
然而奇怪的是,在查阅资料之后,他们发现之前已经有研究表明,造血干细胞中如果存在BRAF(V600E)致癌突变,只会导致白血病等癌症,并不会引起神经退行性疾病[6,7]。
这个时候,Geissmann教授在巨噬细胞起源领域的造诣就要起到很大的作用了。Geissmann教授团队很快意识到,大脑里的巨噬细胞(小胶质细胞)不是造血干细胞发育而来的,应该是卵黄囊中的红系-髓系前体细胞发育而来。同样的,与组织细胞增多病密切相关的巨噬细胞可能也是来自于此。
为了验证这个假设,Geissmann教授带领团队,与MSKCC治疗组织细胞增多症的专家Omar Abdel-Wahab合作,一起开展了相关的研究。
他们首先设计了一种基因工程小鼠,让BRAF(V600E) 突变基因只存在于小鼠胚胎卵黄囊中的红系-髓系前体细胞中。当小鼠出生并慢慢长大后,研究人员持续观察他们的行为、病理损伤的变化。同时,他们还改造了胚胎的造血干细胞(HSC)基因,不过BRAF(V600E) 突变要么让小鼠在胚胎期就死掉了,要么就在成年时产生了肿瘤。
他们发现,带有突变基因的小鼠的神经退行损伤进展缓慢,直到4-5月龄时,这种小鼠才表现出轻微的运动障碍,比如单侧后肢反射消失、步幅减小。之后随着小鼠月龄增加,小鼠逐渐表现出神经退行性疾病特征,9个月时,60%的基因突变小鼠完全瘫痪。
这再次证实了Geissmann教授2012年的研究成果,巨噬细胞不仅仅是来自于造血干细胞,小胶质细胞应该是由红系-髓系前体细胞发育而来。
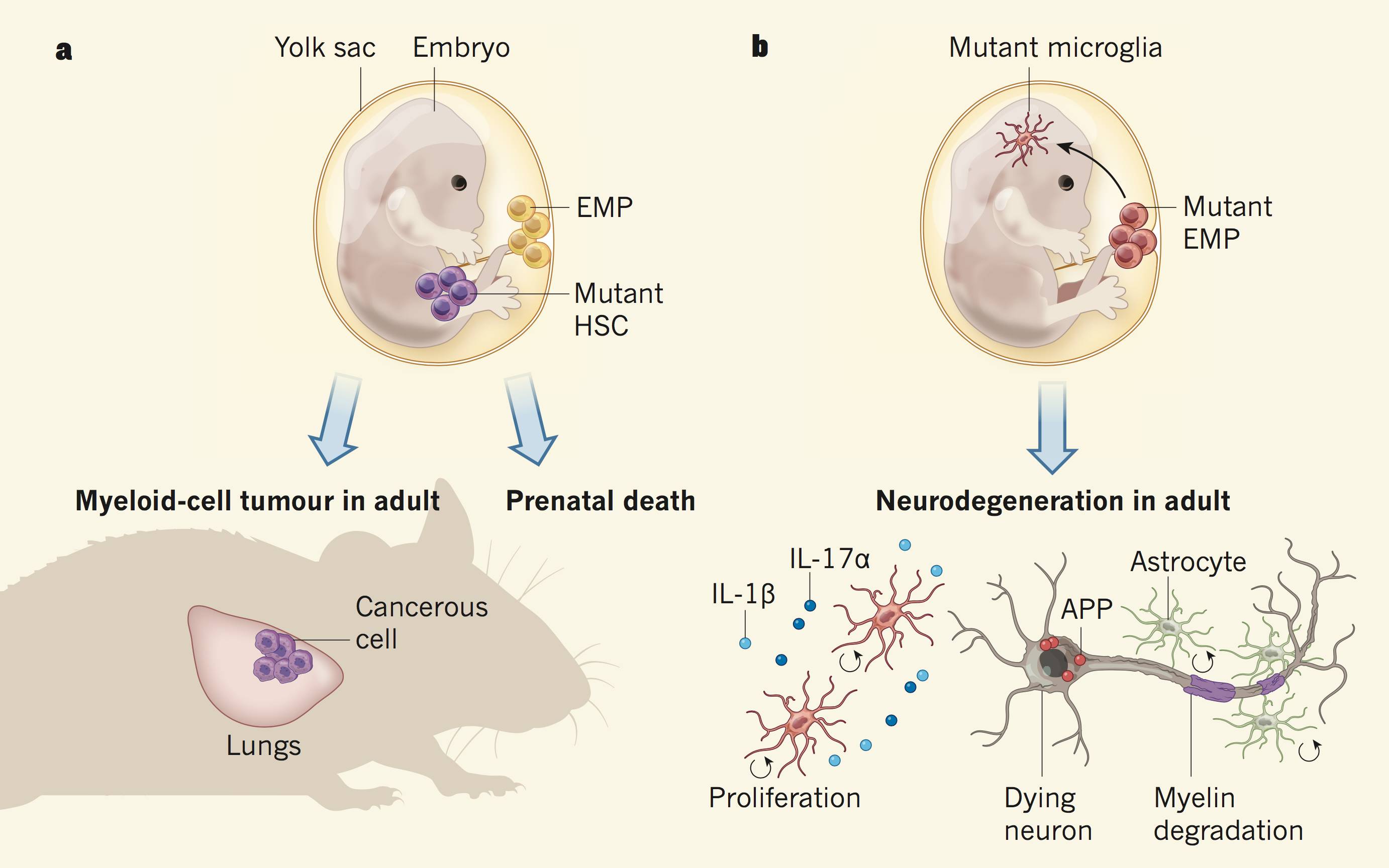
a、造血干细胞发生基因突变导致癌症;
b、红系-髓系前体细胞发生基因突变导致神经退行性疾病
对小鼠病理损伤检测发现,基因突变的小鼠,在1月龄时,小胶质细胞就表现出活化的现象,但此时却没有出现神经元损伤;6月龄时,大量的小胶质细胞发生增生、神经元损失、淀粉样前体蛋白沉淀等神经变性特征,这些特征跟组织细胞增多症患者中看到现象极为相似!
为了进一步探究小鼠的这些神经退行性症状是否依赖于BRAF(V600E)突变,研究人员分别在小鼠1月龄和3月龄时,给小鼠喂食BRAF抑制剂,并观察小鼠的行为、病理损伤变化。
他们发现1月龄时使用BRAF抑制剂治疗,推迟了神经退行性症状的发生,两种情况都缓解了疾病的进展。80%的采用抑制剂治疗的基因突变小鼠,到9月龄时仍然存活,并只表现出轻微的神经退行性症状。对这些小鼠的病理损伤检测发现,BRAF抑制剂减少了小鼠的病理损伤!
之后,研究人员又进行了深入的分析,他们发现,原来基因突变的小胶质细胞中,与细胞增殖分化有关的ERK蛋白被激活,这导致了小胶质细胞的过度增殖、同时发生形态变化。进一步的分析发现,与正常小鼠相比,基因突变小鼠的小胶质细胞中,有8000多个基因表达发生了变化,其中80%左右的基因表达上调,包括癌基因Ras的激活、致炎因子的表达等。
也就是说BRAF(V600E)基因突变通过激活ERK,驱动小胶质细胞过度增殖,改变了小胶质细胞的基因表达,产生各种炎症因子,进而导致了神经元的损伤、局部基质的重塑,最终表现为神经退行性疾病症状!
为了验证他们在小鼠中的结果,研究人员还搜集到了5名组织细胞增多症患者的脑组织活检样本,进行相关的检测。令人高兴的是,组织细胞增多症患者的检测结果与小鼠试验的结果一致!

Elvira Mass博士
论文的第一作者Elvira Mass博士表示,巨噬细胞就像人体组织的清洁工,它能够从血液中进入各个组织,在那里收集机体产生的各种垃圾,比如细胞碎片、入侵的病原体等。通常情况下,巨噬细胞辛勤地打扫机体产生的垃圾,给机体营造良好的环境。但是,有时这类细胞会因过度激活而用力过猛,把一些不该清除的东西也给清除掉了,那就会造成大麻烦。
这项研究,不但提供了神经退行性疾病的新病因,更让人激动的是,给治疗这类疾病提供了一种可能的药物——BRAF抑制剂!
目前,BRAF抑制剂已经被批准用于治疗BRAF基因突变的癌症。由于小胶质细胞在小鼠和组织细胞增多症患者的神经退行性特征是相似的,所以,研究人员希望,BRAF抑制剂也能用于治疗人类的疾病。
不过,Geissmann教授表示,由于血脑屏障的存在,这些药物还不能很好地进入大脑。所以需要对这些药物进行改进,以提高其潜在的疗效。
如果Geissmann教授的发现进一步在人体内证实,也许在不久的将来,阿尔兹海默氏病和帕金森病等神经退行性疾病患者,可能也会走进肿瘤医生的门诊,接受抗癌药物的治疗。正如Geissmann教授所言,作为神经退行性疾病治疗我们可能束手无策,但是作为癌症治疗至少还有有效的检测和治疗手段。

参考资料:
[1]http://www.nature.com/nature/journal/vaop/ncurrent/full/nature23672.html
[2] Schulz C, Perdiguero E G, Chorro L, et al. A lineage of myeloid cells independent of Myb and hematopoietic stem cells[J]. Science, 2012, 336(6077): 86-90.
[3] Diamond E L, Durham B H, Haroche J, et al. Diverse and targetable kinase alterations drive histiocytic neoplasms[J]. Cancer discovery, 2016, 6(2): 154-165.
[4] Lachenal, F. et al. Neurological manifestations and neuroradiological presentation of Erdheim–Chester disease: report of 6 cases and systematic review of the literature. J. Neurol. 253, 1267–1277 (2006).
[5] https://www.mskcc.org/blog/neurodegenerative-disease-kind-cancer
[6] Berres, M. L. et al. BRAF-V600E expression in precursor versus di erentiated dendritic cells de nes clinically distinct LCH risk groups. J. Exp. Med. 211, 669–683 (2014).
[7] Chung, S. S. et al. Hematopoietic stem cell origin of BRAFV600E mutations in hairy cell leukemia. Sci. Transl. Med. 6, 238ra71 (2014).
















