作者:哈 娜 海 鑫
哈尔滨医科大学附属第一临床医院药学部,哈尔滨 150001
【摘要】
目的
应用 Markov 模型针对氯吡格雷、替格瑞洛和基因检测治疗方案防治急性冠脉综合征(ACS)患者卒中和心肌梗死事件进行长期经济学研究,评价 3 种治疗方案用于中国 ACS 患者抗血小板治疗的有效性与经济学。
方法
根据 ACS 疾病自然史构建 Markov 模型,从支付者角度预测不同治疗方案下患者的医疗成本和获得的质量调整生命年(quality adjusted life years, QALYs),并计算增量成本-效用比(incremental cost-utility ratio, ICUR)。模型循环周期为 1 年,研究时限为 30 年。医疗成本和QALYs 均采用 3%的贴现率,并对多种因素进行了单因素敏感性分析和概率敏感性分析。
结果
在基础分析中, 与氯吡格雷组比较,替格瑞洛组和基因检测患者分别平均多获得 0.70 和 0.61 QALY,但累积人均成本分别增加 22 067.15 元和 38 479.37 元,ICUR 分别为 31 524.50 和 63 080.93 元/QALY。在阈值为 2017 年我国 1 倍人均国内生产总值(GDP)59 660 元/QALY 时,替格瑞洛具有明显的经济学优势。单因素敏感性分析和概率敏感性分析均显示该经济学评价结果稳定。
结论
对于中国 ACS 患者而言,最具有成本-效用的抗血小板治疗方案是直接使用新一代抗血小板药物替格瑞洛,其次是药物基因组学检测指导的个体化治疗方案。
【关键词】
Markov 模型;急性冠脉综合征;氯吡格雷;替格瑞洛;基因检测方案
急性冠脉综合征( acute coronary syndrome, ACS)是指冠状动脉内存在不稳定的粥样斑块,当其发生破裂或糜烂时,会引发血栓形成继而导致心脏急性缺血综合征发生,主要疾病类型包括 ST 段抬高型心肌梗死、非 ST 段抬高型心肌梗死和不稳定型心绞痛。根据《2018 年中国心血管病报告》相关数据显示,中国心血管系统疾病的发病率呈持续上升趋势。报告预测中国心血管疾病现患例数为 2.9 亿,其中冠状动脉粥样硬化性心脏病患者为 1 100 万;2002—2016 年急性心肌梗死(AMI)的死亡率仍呈上升态势,2016 年 AMI 死亡率城市为 58.69/10 万,农村为74.72/10 万
[1]
。因此,目前心血管疾病仍是导致中国城乡居民死亡原因的首要因素。同时根据 2016 年所有综合医院中 30 种监测疾病数据显示,AMI 已成为内科疾病序列中平均住院医疗费用最高的病种
[2]
。ACS 极高的发病率和病死率给中国患者和社会带来极大经济负担,如何合理控制和优化配置 ACS 的医疗资源,对建立科学的医疗保障体系和临床治疗策略的实施具有非常重要的借鉴和指导意义。
动脉粥样硬化斑块破裂或内皮溃疡基础上诱发血栓形成被认为是 ACS 发病的主要原因
[3]
。在血栓形成过程中,血小板活化扮演着重要角色
[4]
,而抗血小板治疗已被认为是 ACS 治疗的基石之一;不仅在斑块破裂的急性期,而且在防治动脉粥样硬化血栓形成的长期过程中,抗血小板聚集均是非常重要的治疗策略。国内外相关治疗指南均明确推荐应用P2Y
12
受体抑制剂联合阿司匹林作为抗血小板治疗的标准方案
[5-7]
。目前,临床应用的 P2Y
12
受体抑制剂包括氯吡格雷和替格瑞洛,两者的作用机制存在一定差异。氯吡格雷属于前体药物,需要通过体内代谢转化为有活性的代谢产物,然后选择性地与血小板二磷酸腺苷(ADP)P2Y
12
受体结合,不可逆地抑制 P2Y
12
受体活性而发挥抗血小板作用
[8]
;替格瑞洛则是通过直接与 P2Y
12
受体可逆性结合,非竞争性地抑制 ADP 诱导的受体信号传导而发挥作用
[9]
。上述作用机制的不同导致两种药物的临床疗效和安全性存在一定差异。
有研究表明,肝细胞色素 P450(CYP)某些基因位点的变异会影响氯吡格雷的药理学作用,降低血小板对药物的敏感性
[10]
。其中的关键成员CYP2C19 参与氯吡格雷的体内代谢,其基因多态性是决定发生氯吡格雷抵抗的关键因素
[11]
,因此对于应用氯吡格雷患者推荐进行 CYP2C19 基因检测。替格瑞洛发挥抗血小板作用的体内过程虽然不受CYP2C19 基因多态性影响,但是由于存在出血风险高,呼吸困难等不良反应,对于有颅内出血史、频繁发生病理性出血以及患有严重哮喘、慢性阻塞性肺疾病患者禁止使用替格瑞洛
[12]
。鉴于氯吡格雷和替格瑞洛各自的局限性,目前临床逐渐实施基于CYP2C19 基因检测指导患者采用个体化抗血小板治疗方案。对于不携带 CYP2C19 功能丧失(LOF)等位基因的患者推荐使用标准剂量的氯吡格雷,而对于携带 CYP2C19 功能丧失等位基因的患者,在没有临床禁忌证情况下,建议应用其他抗血小板药物(如替格瑞洛、普拉格雷等)
[13]
。
本研究拟从支付者角度出发,应用 Markov 模型对我国 ACS 患者 3 种抗血小板治疗方案,包括直接应用氯吡格雷治疗方案、直接应用替格瑞洛治疗方案以及基因检测指导个体化治疗方案(LOF 携带者应用替格瑞洛,LOF 非携带者应用氯吡格雷)的长期经济学效果进行评价,为临床治疗方案的选择提供决策依据。
本研究参照在全球范围内开展的 PLATO 研究样本人群的主要试验数据作为基础数据来源,同时检索国内官方公布和重要文献的相关数据。PLATO 研究是一项在 43 个国家(包括中国在内)开展的大型多中心、随机双盲、平行对照的Ⅲ期临床试验(NCT00391872)—比较替格瑞洛与氯吡格雷的“血小板抑制和患者后果结局研究”
[14]
。试验共纳入18 624 例 ACS 患者,分为替格瑞洛组 9 333 例,氯
 吡格雷组 9 291 例。其中替格瑞洛组 ACS 患者首次给予 180 mg 负荷剂量,继而在联合应用阿司匹林基础上给予替格瑞洛 90 mg,2 次/d,持续治疗 12 个月;氯吡格雷组 ACS 患者首次给予 300~600 mg 负荷剂量,继而在联合应用阿司匹林基础上给予氯吡格雷 75 mg,1 次/d,持续治疗 12 个月。研究比较了两组患者在预防心血管事件发生方面的疗效和安全性,其中主要疗效观察指标为在第 12 个月时, 由心源性死亡、心肌梗死及脑卒中组成的心脑血管事件累计发生率,主要安全性观察指标为大出血事件发生率。
根据ACS 疾病发展的自然进程,同时参考国内外公开发表的相似研究
[15-16]
,本研究建立的Markov 模型包括6 个状态:ACS 无事件(无进一步心血管疾病史)、非致死性心肌梗死、心肌梗死后、非致死性卒中、卒中后和死亡,其中死亡为吸收态。由于非致死性心肌梗死和非致死性卒中事件发生短暂,作为“隧道状态”只持续一年时间(一个循环)即转归进入下一个状态。6 个状态之间可能存在的相互转换关系见图1。本研究设定模型循环周期为1 年,研究时限为30 年。同时为简化模型便于研究做如下假设:1)所有患者在进入长期Markov 模型研究之前均处于ACS 无事件状态;2)假设模型开始时3 种治疗方案各有10 000 例患者处于无事件状态,患者在每个循环周期均可以经历任意一个并且仅其中一个临床事件。
Markov 模型假设患者依据一定的转移概率实现不同疾病状态之间的相互转换。通常文献中疾病状态之间的转换是以事件发生率来表示,需要通过转换公式
[17]
将事件发生率转化计算得到相应的转移概率。在转换公式
P
=1-exp(-
rt
)中,
r
为研究时间,
t
为事件发生率,
P
为通过计算得到的转移概率。在本研究中,替格瑞洛和氯吡格雷相关心源性猝死、心肌梗死和卒中的事件发生率来源于PLATOⅢ期临床试验
[14]
,基因检测指导个体化给药方案中 LOF 非携带者应用氯吡格雷以及 LOF 携带者应用替格瑞洛相关事件的发生率来源于 PLATO 临床试验的基因亚组研究
[18-19]
。基因检测指导个体化给药方案中 LOF 等位基因发生频率参照文献[20];其他状态之间的转移概率则通过检索研究设计科学严谨的临床研究文献[21-22]获取并计算得到相关数据。
本研究采用质量调整生命年(QALYs)作为健康效用指标,QALYs 是由患者处在不同健康状态下的效用值和时间的乘积计算得到。通常将完全健康状态的效用值设定为 1,死亡状态的效用值设定为 0。本研究中 ACS 无事件、非致死性心肌梗死、非致死性卒中、心肌梗死后、卒中后 5 种不同疾病状态的健康效用值通过参照 PLATO研究中对 18 000 多例患者所开展的欧洲五维健康量表问卷调查的结果数据进行确定和分析
[23]
。
本研究主要从支付者角度出发来衡量相关成本数据,故只计算干预措施的直接医疗成本。根据 PLATO 研究不同治疗方案的医疗资源使用情况,结合中国官方公布的医疗成本数据,计算得到替格瑞洛组和氯吡格雷组患者首发ACS 12个月的治疗成本。非致死性心肌梗死和非致死性卒中的状态成本参考文献数据,由于临床上发生急性心肌梗死与急性卒中事件第 1 年和随后的治疗成本存在一定差异,故在文献检索中分别检索第 1 年和第 2 年的治疗成本,并在模型中进行相关设置。上述成本数据主要参考国家卫生统计报告以及已发表的相关文献数据
[2,24-26]
,并根据中国消费者价格指数(consumer price index, CPI)折算至 2017 年的价格水平。在药品成本核算中,原研药氯吡格雷和替格瑞洛的药品费用来源于 2017 年(截止到 12 月底)全国平均中标价格,阿司匹林药品费用则通过将占据市场份额前 3 名具有不同商品名称的阿司匹林价格,根据不同销量进行加权处理计算得到平均价格中位数。
本研究采用增量成本-效用比(incremental cost utility ratio, ICUR)作为不同治疗方案经济学效益优劣性的评判标准,将 ICUR 与外部阈值标准比较以确定最佳治疗方案。按照《中国药物经济学评价指南及导读(2015 版)》
[27]
,世界卫生组织从不同国家经济发展水平出发,建议使用人均国内生产总值(GDP)作为评判是否具有经济学优势的阈值标准。具体评判标准为:1)ICUR 值小于 1 倍人均 GDP 表示十分具有经济学优势;2)ICUR 值为 1~3 倍人均GDP 表示具有经济学优势;3)ICUR 值超过 3 倍人均 GDP 表示不具有经济学优势。《2017 年国民经济和社会发展统计公报》数据显示,2017 年我国人均GDP 约为 59 660 元
[28]
,本研究选取该值作为阈值标准。采用 Treeage 2019 软件构建 Markov 模型,在模型中对成本和健康效用值均采用 3%的贴现率,同时进行半循环矫正(half-cycle correction)。
采用单因素敏感性分析和概率敏感性分析,解析各项参数对模型基础分析结果的影响。在单因素敏感性分析中,成本数据和健康效用值的取值范围为基础值上下浮动 20%,转移概率的取值范围为基础值上下浮动 10%,贴现率的取值范围为 0%~8%,结果以飓风图形式呈现。概率敏感性分析设定成本数据服从正态分布,健康效用值和转移概率服从 β分布,通过对模型进行 1 000 次蒙特卡罗模拟,以ICUR 散点图和成本-效果可接受曲线形式显示相关分析结果。
PLATO 研究结果显示,非致死性心肌梗死不会导致潜在非致死性卒中严重事件发生,同时非致死性卒中亦不会导致潜在非致死性心肌梗死严重事件发生
[14]
。因此本研究将非致死性心肌梗死和非致死性卒中之间的转移概率设定为 0,同时亦将心肌梗死后与卒中后两种疾病状态之间的转移概率设定为 0。对于 ACS 无事件状态、心肌梗死后、卒中后 3 种疾病状态在自身之间的转移概率则通过由 1 减去其他分支的转移概率计算获得。其他状态之间的转移概率参考 PLATO 研究结果及其他已公开发表的临床试验结果,通过转换公式计算获得。相关事件发生率结果数据见表 1,不同状态之间的转移概率计算结果见表 2。
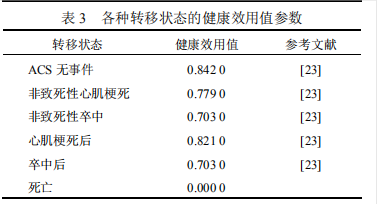
本研究所需的健康效用值参数主要来源于文献[23]。见表 3。
吡格雷组 9 291 例。其中替格瑞洛组 ACS 患者首次给予 180 mg 负荷剂量,继而在联合应用阿司匹林基础上给予替格瑞洛 90 mg,2 次/d,持续治疗 12 个月;氯吡格雷组 ACS 患者首次给予 300~600 mg 负荷剂量,继而在联合应用阿司匹林基础上给予氯吡格雷 75 mg,1 次/d,持续治疗 12 个月。研究比较了两组患者在预防心血管事件发生方面的疗效和安全性,其中主要疗效观察指标为在第 12 个月时, 由心源性死亡、心肌梗死及脑卒中组成的心脑血管事件累计发生率,主要安全性观察指标为大出血事件发生率。
根据ACS 疾病发展的自然进程,同时参考国内外公开发表的相似研究
[15-16]
,本研究建立的Markov 模型包括6 个状态:ACS 无事件(无进一步心血管疾病史)、非致死性心肌梗死、心肌梗死后、非致死性卒中、卒中后和死亡,其中死亡为吸收态。由于非致死性心肌梗死和非致死性卒中事件发生短暂,作为“隧道状态”只持续一年时间(一个循环)即转归进入下一个状态。6 个状态之间可能存在的相互转换关系见图1。本研究设定模型循环周期为1 年,研究时限为30 年。同时为简化模型便于研究做如下假设:1)所有患者在进入长期Markov 模型研究之前均处于ACS 无事件状态;2)假设模型开始时3 种治疗方案各有10 000 例患者处于无事件状态,患者在每个循环周期均可以经历任意一个并且仅其中一个临床事件。
Markov 模型假设患者依据一定的转移概率实现不同疾病状态之间的相互转换。通常文献中疾病状态之间的转换是以事件发生率来表示,需要通过转换公式
[17]
将事件发生率转化计算得到相应的转移概率。在转换公式
P
=1-exp(-
rt
)中,
r
为研究时间,
t
为事件发生率,
P
为通过计算得到的转移概率。在本研究中,替格瑞洛和氯吡格雷相关心源性猝死、心肌梗死和卒中的事件发生率来源于PLATOⅢ期临床试验
[14]
,基因检测指导个体化给药方案中 LOF 非携带者应用氯吡格雷以及 LOF 携带者应用替格瑞洛相关事件的发生率来源于 PLATO 临床试验的基因亚组研究
[18-19]
。基因检测指导个体化给药方案中 LOF 等位基因发生频率参照文献[20];其他状态之间的转移概率则通过检索研究设计科学严谨的临床研究文献[21-22]获取并计算得到相关数据。
本研究采用质量调整生命年(QALYs)作为健康效用指标,QALYs 是由患者处在不同健康状态下的效用值和时间的乘积计算得到。通常将完全健康状态的效用值设定为 1,死亡状态的效用值设定为 0。本研究中 ACS 无事件、非致死性心肌梗死、非致死性卒中、心肌梗死后、卒中后 5 种不同疾病状态的健康效用值通过参照 PLATO研究中对 18 000 多例患者所开展的欧洲五维健康量表问卷调查的结果数据进行确定和分析
[23]
。
本研究主要从支付者角度出发来衡量相关成本数据,故只计算干预措施的直接医疗成本。根据 PLATO 研究不同治疗方案的医疗资源使用情况,结合中国官方公布的医疗成本数据,计算得到替格瑞洛组和氯吡格雷组患者首发ACS 12个月的治疗成本。非致死性心肌梗死和非致死性卒中的状态成本参考文献数据,由于临床上发生急性心肌梗死与急性卒中事件第 1 年和随后的治疗成本存在一定差异,故在文献检索中分别检索第 1 年和第 2 年的治疗成本,并在模型中进行相关设置。上述成本数据主要参考国家卫生统计报告以及已发表的相关文献数据
[2,24-26]
,并根据中国消费者价格指数(consumer price index, CPI)折算至 2017 年的价格水平。在药品成本核算中,原研药氯吡格雷和替格瑞洛的药品费用来源于 2017 年(截止到 12 月底)全国平均中标价格,阿司匹林药品费用则通过将占据市场份额前 3 名具有不同商品名称的阿司匹林价格,根据不同销量进行加权处理计算得到平均价格中位数。
本研究采用增量成本-效用比(incremental cost utility ratio, ICUR)作为不同治疗方案经济学效益优劣性的评判标准,将 ICUR 与外部阈值标准比较以确定最佳治疗方案。按照《中国药物经济学评价指南及导读(2015 版)》
[27]
,世界卫生组织从不同国家经济发展水平出发,建议使用人均国内生产总值(GDP)作为评判是否具有经济学优势的阈值标准。具体评判标准为:1)ICUR 值小于 1 倍人均 GDP 表示十分具有经济学优势;2)ICUR 值为 1~3 倍人均GDP 表示具有经济学优势;3)ICUR 值超过 3 倍人均 GDP 表示不具有经济学优势。《2017 年国民经济和社会发展统计公报》数据显示,2017 年我国人均GDP 约为 59 660 元
[28]
,本研究选取该值作为阈值标准。采用 Treeage 2019 软件构建 Markov 模型,在模型中对成本和健康效用值均采用 3%的贴现率,同时进行半循环矫正(half-cycle correction)。
采用单因素敏感性分析和概率敏感性分析,解析各项参数对模型基础分析结果的影响。在单因素敏感性分析中,成本数据和健康效用值的取值范围为基础值上下浮动 20%,转移概率的取值范围为基础值上下浮动 10%,贴现率的取值范围为 0%~8%,结果以飓风图形式呈现。概率敏感性分析设定成本数据服从正态分布,健康效用值和转移概率服从 β分布,通过对模型进行 1 000 次蒙特卡罗模拟,以ICUR 散点图和成本-效果可接受曲线形式显示相关分析结果。
PLATO 研究结果显示,非致死性心肌梗死不会导致潜在非致死性卒中严重事件发生,同时非致死性卒中亦不会导致潜在非致死性心肌梗死严重事件发生
[14]
。因此本研究将非致死性心肌梗死和非致死性卒中之间的转移概率设定为 0,同时亦将心肌梗死后与卒中后两种疾病状态之间的转移概率设定为 0。对于 ACS 无事件状态、心肌梗死后、卒中后 3 种疾病状态在自身之间的转移概率则通过由 1 减去其他分支的转移概率计算获得。其他状态之间的转移概率参考 PLATO 研究结果及其他已公开发表的临床试验结果,通过转换公式计算获得。相关事件发生率结果数据见表 1,不同状态之间的转移概率计算结果见表 2。
本研究所需的健康效用值参数主要来源于文献[23]。见表 3。
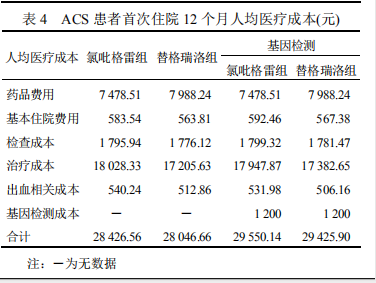
Markov 模型的成本参数包括 ACS首次治疗费用、再发非致死性心肌梗死和非致死性卒中的第 1 年治疗成本以及发生心肌梗死、卒中后需要持续治疗的成本。3 种治疗方案首发 ACS12 个月的医疗成本见表 4,上述 ACS 无事件状态成本、非致死性心肌梗死和非致死性卒中、心肌梗死后和卒中后的相关治疗成本综合数据见表 5。
对氯吡格雷组、替格瑞洛组和基因检测治疗ACS 患者的 Markov 决策模型进行回乘分析(Roll back),并在阈值为我国 1 倍人均 GDP(59 660 元,2017 年数据)下进行成本-效用分析,结果见表 6。回乘分析结果显示,氯吡格雷组、替格瑞洛组和基因检测治疗 30 年累积人均总成本分别为 257 270.74 元、279 337.89 元和 295 750.11 元,分别获得 9.77、10.47、10.38 个 QALYs。根据增量成本-效用分析,替格瑞洛组与氯吡格雷组比较的 ICUR 为 31 524.50 元/ QALY,基因检测与氯吡格雷组比较的 ICUR 为 63 080.93 元/QALY。本研究设置的阈值标准为我国 1 倍人均 GDP59 660 元/年(2017 年数据),根据回乘分析原理,可以得出替格瑞洛组增加的成本是完全可以接受的,具有经济学优势。
分别对氯吡格雷组、替格瑞洛组和基因检测治疗 ACS 的 Markov 模型进行队列模拟。循环到第30 个周期,各组治疗方案在不同状态结局的队列分布情况见表 7。相关队列分析结果显示,与氯吡格雷组比较,每 10 000 例患者中替格瑞洛组减少了 370 例死亡,基因检测治疗方案中的氯吡格雷组减少了 120 例死亡,替格瑞洛组减少了 500 例死亡。同时基因检测中,对于 LOF非携带者应用氯吡格雷治疗的患者在第 30 年,仍然处于无进一步心脑血管事件的比例与单纯应用氯吡格雷的患者比较提高了 2.7%;对于LOF 携带者应用替格瑞洛治疗的患者在第 30 年,仍然处于无进一步心脑血管事件比例与单纯应用替格瑞洛患者比较提高了 2.8%。
因为当阈值为我国 1 倍人均 GDP(59 660 元,2017 年数据)时,基因检测无药物经济学优势,故本研究仅对氯吡格雷组和替格瑞洛组进行单因素敏感性分析。运用 Treeage2019 软件对 Markov 模型中的参数,包括转移概率、健康效用值和成本数据等所有变量均进行单因素敏感性分析,以 59 660 元/QALY 作为支付意愿阈值,分析结果用飓风图形式表达,见图 2。图 2 显示,对结果影响最大的两个不确定因素是替格瑞洛治疗方案无事件状态医疗成本和氯吡格雷治疗方案无事件状态医疗成本,其他参数变化均未影响结果稳定性。
由于药品价格变化具有相同变化趋势,为了考察两个参数同时变化对研究结果的可能影响,基于一元敏感度分析结果,本研究针对 ICUR 影响最显著的两个参数(替格瑞洛治疗方案无事件状态医疗成本和氯吡格雷治疗方案无事件状态医疗成本)进行二元敏感度分析,结果见图 3。由图 3 可知,当两个参数同时改变时,支付意愿阈值(WTP)为 59 660 元/QALY 时,替格瑞洛组的净收益(包括净货币收益和净健康收益)占比均是最高的,替格瑞洛组具有更高的成本-效用优势。
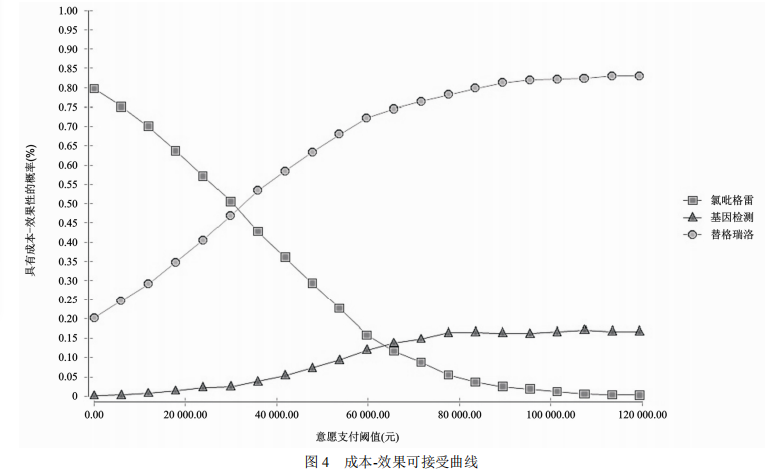
通过二阶蒙特卡罗模拟对模型进行概率敏感性分析,得到成本-效果可接受曲线,见图 4。如图所示,替格瑞洛组具有成本-效果性的概率随着 WTP 增加而增加,当 WTP 大于替格瑞洛组与氯吡格雷组两条可接受曲线交叉的 WTP 值(即 WTP 大于 35 796 元/QALY)时,替格瑞洛组具有成本-效果性的概率(56.3%)大于氯吡格雷组(40.0%)。当 WTP 大于基因检测与氯吡格雷组两条可接受曲线交叉的 WTP 值(即 WTP 大于 71 592 元/QALY)时,基因检测具有成本-效果性的概率(12.6%)大于氯吡格雷组(8.7%)。当 WTP 为本研究阈值 59 660 元/QALY 时,替格瑞洛组、基因检测和氯吡格雷组各自最具有成本-效果性的概率分别为74.7%、9.9%和 15.4%;当 WTP 为 119 320 元/QALY时,替格瑞洛组、基因检测和氯吡格雷组各自最具有成本-效果性的概率分别为 85.3%、14.6%和 0.1%。结果表明,当 WTP 大于 35 796 元/QALY 时,替格瑞洛组成本-效果优势始终具有最高的概率。
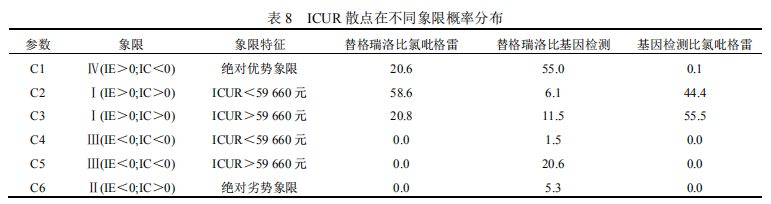
 为进一步确定模型参数的不确定性,本研究采用蒙特卡罗模拟法随机抽样 1 000 次来评估各参数变化对结果的影响。以增量效果作为横坐标,增量成本作为纵坐标,在成本-效果平面上以散点形式展示参数的波动情况,其中斜线代表 WTP 阈值(59 660 元/QALY),从而得到 ICUR 散点图,见图 5。相关 ICUR散点在不同象限的概率分布见表 8。替格瑞洛与氯吡格雷的 ICUR 散点图(图 5-A)显示,ICUR 散点全部分布在绝对优势象限(20.6%)和效果优势象限(79.4%),当阈值为 59 660 元/QALY 时,替格瑞洛组具有成本-效用优势的概率为 79.2%。替格瑞洛与基因检测的 ICUR 散点图(图 5-B)显示,ICUR 散点主要分布在绝对优势象限(55.0%)和成本优势象限(22.1%),少数散点分布在效果优势象限(17.6%)和绝对劣势象限(5.3%),当阈值为 59 660 元/QALY时,替格瑞洛组具有成本-效用优势的概率为 62.6%。基因检测与氯吡格雷的 ICUR 散点图(图 5-C)显示,ICUR 散点全部分布在绝对优势象限(0.1%)和效果优势象限(99.9%),当阈值为 59 660 元/QALY 时,基因检测具有成本-效用优势的概率为 44.5%。结果表明,与氯吡格雷组比较,替格瑞洛组和基因检测更具效果优势;当 WTP 阈值为 59 660 元/QALY 时,替格瑞洛组的成本-效用优势具有最高的概率。
为进一步确定模型参数的不确定性,本研究采用蒙特卡罗模拟法随机抽样 1 000 次来评估各参数变化对结果的影响。以增量效果作为横坐标,增量成本作为纵坐标,在成本-效果平面上以散点形式展示参数的波动情况,其中斜线代表 WTP 阈值(59 660 元/QALY),从而得到 ICUR 散点图,见图 5。相关 ICUR散点在不同象限的概率分布见表 8。替格瑞洛与氯吡格雷的 ICUR 散点图(图 5-A)显示,ICUR 散点全部分布在绝对优势象限(20.6%)和效果优势象限(79.4%),当阈值为 59 660 元/QALY 时,替格瑞洛组具有成本-效用优势的概率为 79.2%。替格瑞洛与基因检测的 ICUR 散点图(图 5-B)显示,ICUR 散点主要分布在绝对优势象限(55.0%)和成本优势象限(22.1%),少数散点分布在效果优势象限(17.6%)和绝对劣势象限(5.3%),当阈值为 59 660 元/QALY时,替格瑞洛组具有成本-效用优势的概率为 62.6%。基因检测与氯吡格雷的 ICUR 散点图(图 5-C)显示,ICUR 散点全部分布在绝对优势象限(0.1%)和效果优势象限(99.9%),当阈值为 59 660 元/QALY 时,基因检测具有成本-效用优势的概率为 44.5%。结果表明,与氯吡格雷组比较,替格瑞洛组和基因检测更具效果优势;当 WTP 阈值为 59 660 元/QALY 时,替格瑞洛组的成本-效用优势具有最高的概率。